Химиялық байланыстың типтері, валенттілік және тотығу дәрежесі



Химиялық байланыстың (типтері), валенттілік,
тотығу дәрежесі

Қосылыстағы атомдардың бір-біріне әсері арқылы жүзеге асатын күш табиғатынының мәнін түсіндіру;
Атомдар арасында химиялық байланыстың қалай түзілетінін анықтау;
Молекуладағы байланыстың түзілуін шартты түрде жазып үйрету7
Сабақтың мақсаты:
Notes: Сегодня наши задачи состоят в том, чтобы
Выяснить, природу сил, обусловливающих взаимодействие атомов друг с другом в соединении
Выяснить, как образуется химическая связь между атомами с позиций современной науки
Научиться условно записывать образование связей в молекуле, и конечно же объяснять эти записи.
Но прежде, давайте совершим небольшой исторический экскурс, заглянем в прошлое и посмотрим, что думали об этом древние. Щ.

Міндеті:
1. Химиялық байланыс жайлы ұғымды қалыптастыру.
2. Жай және күрделі заттардан химиялық байланыстың түрін анықтай білу, әр түрлі байланыс түрі бар заттарға түзілу схемасын құра білу; ковалентті, иондық, металдық, байланыстардың түзілу механизмін түсіндіре білу.

Міндеті:
3. Дамыту:
☺Интеллектуалды дағды- себеп - салдарды анықтап, соның негізінде қорытынды шығару, материалды жүйелеу, тұжырымдау сұрақтарын құрастыру.
☺Сөйлеу дағдысы - топта жұмыс жүргізу кезінде ғылыми тілде ойын жеткізе білу.
☺Коммуникативті дағды -дәлелді мысалдар келтіре отырып өз ойын жеткізу, өзгелердің пікірін тыңдай білу.
☺ Әлеуметтік дағды - топта жұмыс істеу.

Өткенге көз жіберейік, ертедегі адамдар бұл туралы қалай ойлады екен . . .

АУА
С
У
ОТ
Ж
Е
Р
ЭМПЕДОКЛ
(біздің эрамызға дейінгі V ғасыр)
Ғаламдағы бар тіршіліктің төрт түбірі бар :
От және су, және жер, шектеусіз әлем бөлігі;
Не болды, не бар, және не болады барлығы да
солардан түзіледі, жалғасын таба бермек….
Notes: Древнегреческий философ Эмпедокл, живший в V веке до нашей эры, учил, что мир состоит из четырёх сущностей: земли, воды, воздуха и огня.
В качестве сил, которые объединяют и разделяют и тем самым способствуют возникновению, превращениям и разрушению тел он выдвинул дружбу и вражду или любовь и ненависть. Об этом он и написал в своей поэме.
Сначала послушай, что четыре корня всего существующего:
Огонь и вода, и земля, и безграничная высь эфира;
Из них (образовалось) всё, что было, что есть и что будет.
…То любовью соединяется всё воедино,
То, напротив, враждою ненависти всё несётся в разные стороны.
…И эта постоянная смена никогда не прекращается…
Щ

ДЕМОКРИТ
(б. э. д. 460 - 370 ж. ж. )
Әлемде тек қана атомдар, бос кеңістік және қозғалыс бар, деп оқытты.
Ол атомдардың бос кеңістікте соқтығысуының механикалық қажеттілігін ойлап тапты.
Түсінікті болуы үшін, атомдарды бір-бірімен бекіту үшін ілгешекпен, ілгекті пайдаланды.
Notes: Древнегреческий философ Демокрит считается основоположником материалистического взгляда на атомистическое строение материи.
Демокрит учил, что все тела состоят из бесчисленного количества сверхмалых, невидимых глазом, неделимых частиц-атомов, которые непрерывно движутся в пустоте. Их никто не создавал, никто не может уничтожить, хотя разрушить тела, составленные из атомов - труд небольшой.
Демокрит не верил в богов, не допускал случайностей, поэтому для объяснения столкновения атомов в пустоте придумал какую-то механическую необходимость или «рок». А чтобы было понятно, как атомы держатся друг за друга, он снабдил их петельками и крючочками.
Щ

Платон өзінің шәкірттеріне өте көрнекі түрде үшбұрыштың бөлшектері арқылы орындалатын барлық өзгерістерді көрсетті.
Notes: Античный философ Платон представлял атомы как плоские тела - прямоугольные треугольники двух видов: равнобедренные и с катетом, равным половине гипотенузы.
Они удобны для конструирования более сложных фигур. Четыре равнобедренных треугольника составляют квадрат, а из шести прямоугольных треугольников образуется равносторонний треугольник.
Щ
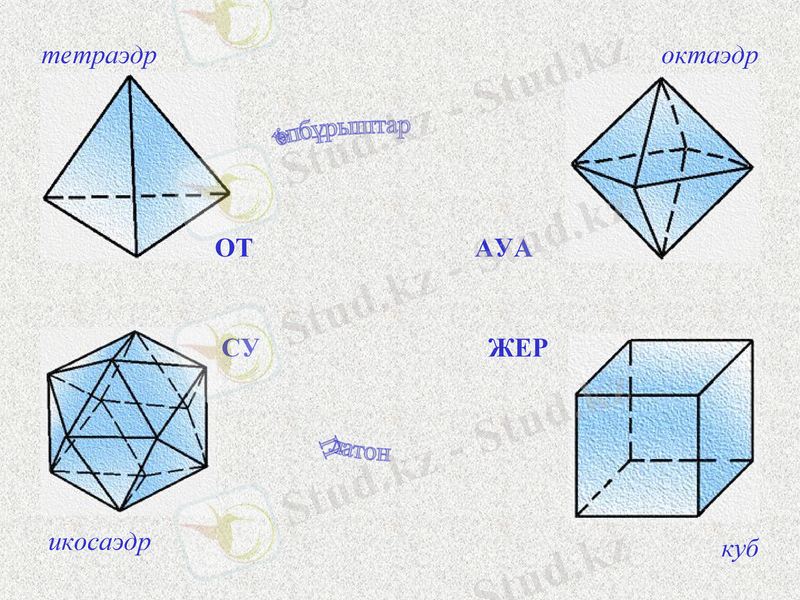
октаэдр
Notes: Равносторонний треугольник в свою очередь является одной из граней тетраэдра, октаэдра и икосаэдра, а квадрат - гранью куба. Эти правильные многогранники Платон выбрал в качестве мельчайших сложных атомов (стихий) . Платон очень наглядно объяснял ученикам все возможные превращения с помощью частиц-треугольников.
А вам я предлагаю пофилософствовать вместе с Платоном выполнив задание, которое весит на стенде (напомнить, что это по желанию) - срок: неделя.
Щ

ЙЁНС-ЯКОБ БЕРЦЕЛИУС
(1779 - 1848 ж. ж. )
Электрохимиялық теория
Химиялық элементтер арасындағы байланысты олардың электрлік қасиеті тұрғысынан қарастырды. Яғни, химиялық элементтердің бір түрінде оң, ал екіншілерінде теріс заряд басым болады. Оң заряды басым элементтерге металдарды, ал теріс заряды бар элементтерге металл еместерді жатқыза отырып, химиялық қосылыстар осылардың арасындағы тартылыстан туындайды деп есептелінді.
Notes: Взгляды Демокрита и Платона господствовали довольно долго.
В начале 19 века шведский химик Йёнс-Якоб Берцелиус предложил электрохимическую теорию сродства. Он считал, что атомы притягиваются друг к другу благодаря наличию у каждого из них двух противоположных электрических зарядов, находящихся на некотором расстоянии друг от друга. Идея о том, что силы, удерживающие атомы в молекуле, имеют электрическую природе, оказалась верной.
ЭКСПЕРИМЕНТ - получение водорода:
Пропустите одну строчку тетради???
на доске записать уравнение реакции в молекулярном виде и с помощью графических формул.
Состав веществ определяли экспериментально.
Рассмотрим схему взаимодействия цинка с соляной кислотой.
Щ


ХИМИЯЛЫҚ БАЙЛАНЫС
- химиялық қосылыстағы атомдардың бір-біріне әсері арқылы жүзеге асатын күштер жиынтығы
Notes: Сегодня на уроке мы начинаем изучать новую тему: ХИМИЧЕСКАЯ СВЯЗЬ. Запишите тему урока. Что же мы понимаем под «химической связью»?
Щ. Химическая связь - это совокупность сил, обусловливающих взаимодействие атомов друг с другом в химическом соединении. Запишите.
Щ.

Химиялық байланыс түзілген кезде атомдардың электрондық құрылымы өзгеріске ұшырайды.
Атомдардың электрондық құрылымы анағұрлым тұрақты болған жағдайда ғана химиялық байланыс түзіледі.
Химиялық байланыс түзілуде ең басты рольді электрондар атқарады.

Сыртқы электрондық қабаты ns2np6 типті болған жағдайда электронды октет және 1 s2 аяқталған, анағұрлым тұрақты болады.
Басқа элементтің атомдары химиялық байланыс түзу кезінде осындай электрондық құрылым түзуге ұмтылады. Атомдар арасында тұрақты (аяқталған) электрондық құрылымда болатын ең маңызды екі түрлі химиялық байланыстың түрі иондық (электровалентті) және ковалентті байланыс бар.

Иондық химиялық байланыс электртерістілігі бойынша айырмашылығы үлкен металл мен бейметалл атомдары арасында түзіледі.
Иондық химиялық байланыс қарама -қарсы зарядталған иондардың электростатикалық тартылысы нәтижесінде жүзеге асады.
Иондық байланыс

Иондық байланыс теориясын 1916 жылы неміс ғалымы
В. Коссель ұсынған болатын. Бұл теория типтік металдар мен типтік бейметалдар атомдары арасында: CsF, CsCl, NaCl, KF, KCl, Na2O, CaO түзілетін байланысты түсіндіреді. Осы теорияға байланысты иондық байланыстың түзілу кезінде типтік металл атомдары электронды береді, ал типтік бейметалл атомдары электронды қосып алады.
КОССЕЛЬ (Kossel),
Вальтер
1888 - 1956 ж. ж.


Иондар түзілу арқылы жүзеге асатын байланыстарды иондық байланыс, қосылыстың өзін иондық қосылыс деп атайды. Иондық қосылыстардың қайнау, балқу температурасы жоғары, қызуға тұрақты, олар полюстік еріткіштерде тез ериді, ерітінділері электр тогын жақсы өткізеді.
+
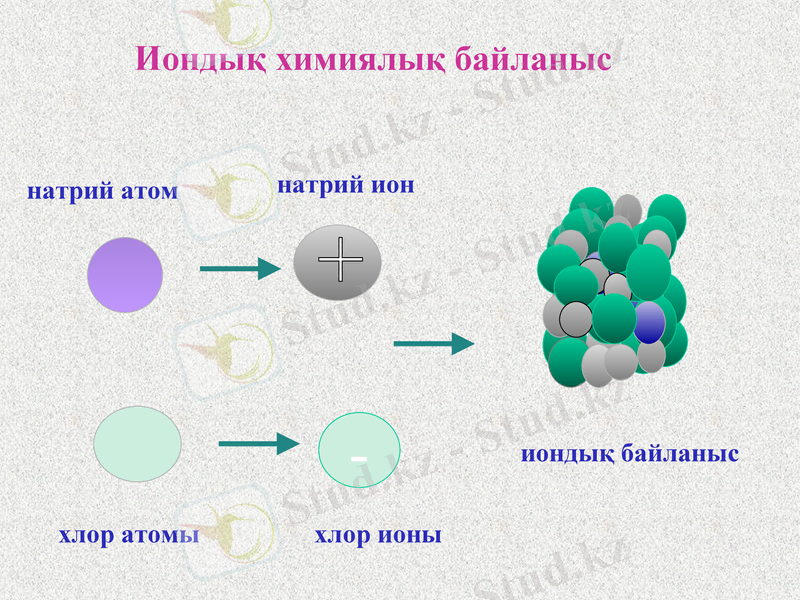
натрий атом


Ковалентті байланыс - бұл атомдар арасында ортақ электрондық жұп есебінен жүзеге асырылатын химиялық байланыс.
Ковалентті байланыс
Ковалентті химиялық байланыста электрон жұбының атомдардың арасында орналасуына қарай полюсті және полюссіз деп екіге бөлінеді.

Джильбер Льюис

Полюссіз ковалентті химиялық байланысты молекулада электрон жұбы атомға ауыспай, симметриялы түрде ортада орналасады. Полюссіз химиялық байланыстағы қосылыстардың қайнау және балқу температуралары төмен, полюсті еріткіштерде иондар түзбейді, электр тоғын өткізбейді.

Сутек атомының электрондық формуласы 1s1.
Сутектің электртерістілігі 2, 1.
S - электрондарының электрон бұлттары сфера (шар)
тәрізді, олардың өзара әсерлесуін былай көрсетуге болады:
сонда s электрондарының бұлттары өзара қабысып,
екі электрон екі ядроға да ортақ, олардан бірдей
қашықтықта орналасады.

Сутегі молекуласындағы атомдардың ұсталып тұрған күштерінің табиғатын алғаш 1927 жылы ағылшын ғалымдары Гейтлер мен Лондон кванттық механика тұрғысынан түсіндірді. Олар Шредингер теңдеуі бойынша
байланыстың екі сипатын - энергия мен ядро аралық ұзындықты есептеді. Сутегі молекуласы төрт микробөлшектен тұрады. Екі атом бір - біріне жақындаған кезде тартылыс күші, ал екі ядро мен екі электрон арасында тебілу күші пайда болады. Осы тартылыс және тебілу күші теңескен жағдайда молекула тұрақты күйге келеді.
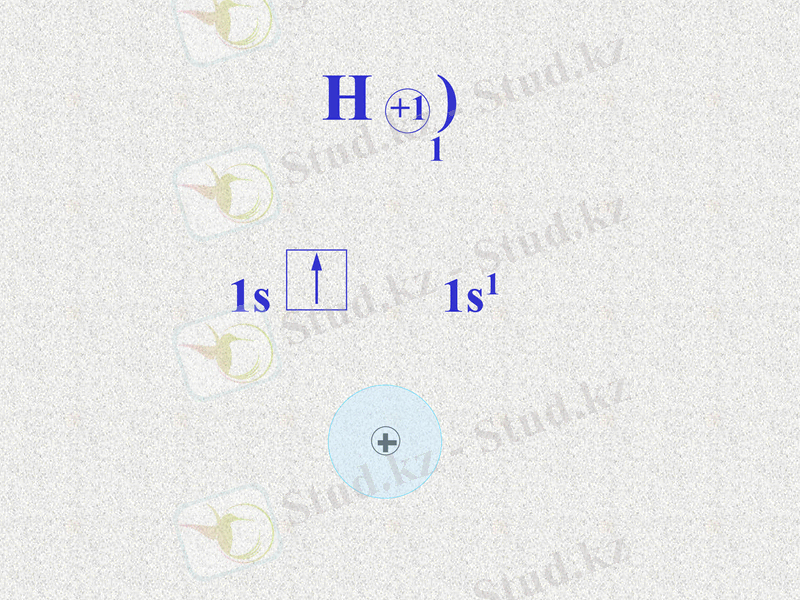
H +1 )
1
Notes: При взаимодействии цинка с кислотой атомы цинка вытесняют атомы водорода из молекулы кислоты, а образующиеся атомы водорода соединяются в молекулу. Атом водорода представляет собой ядро, окружённое электронным облаком в форме шара, причём облако образовано одним электроном. Щ

H-
-H
H2
Сутек молекуласындағы байланыстың түзілуі:
Notes: Давайте попробуем разобраться как образуется связь в самой простой молекуле - молекуле водорода. Используем те знания, которые у нас есть.
Нарисуйте на доске строение атома водорода.
Проверяем. Щ
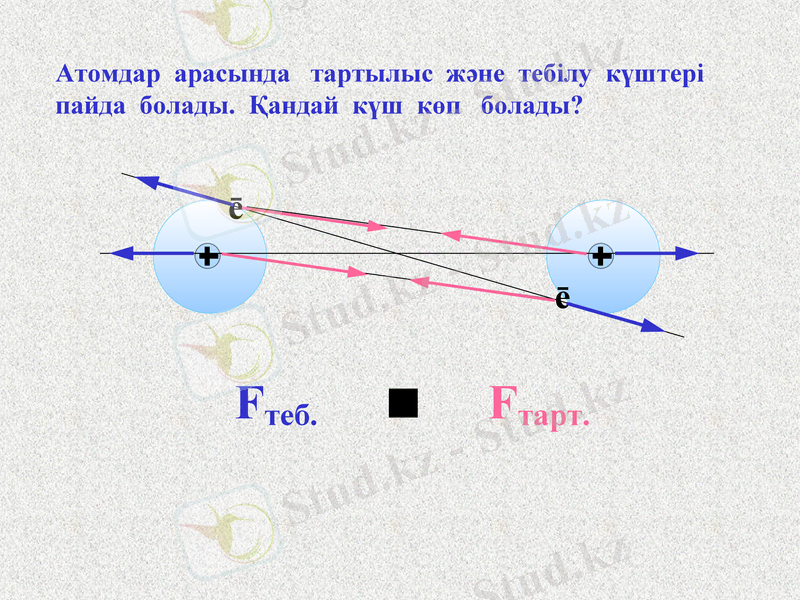
Fтеб.
Fтарт.
ē
ē
Атомдар арасында тартылыс және тебілу күштері пайда болады. Қандай күш көп болады?
Notes: Доставим электроны для облегчения восприятия - щелчок
Обсуждаем, какие силы возникают между атомами
Силы отталкивания - щелчок
Силы притяжения - щелчок
Какие силы больше - щелчок
Достаньте из конверта рисунок, обведите на нём стрелки, показывающие направление сил разным цветом, сделайте подпись. Дома рисунок вклеите в тетрадь.
Переход - щелчок
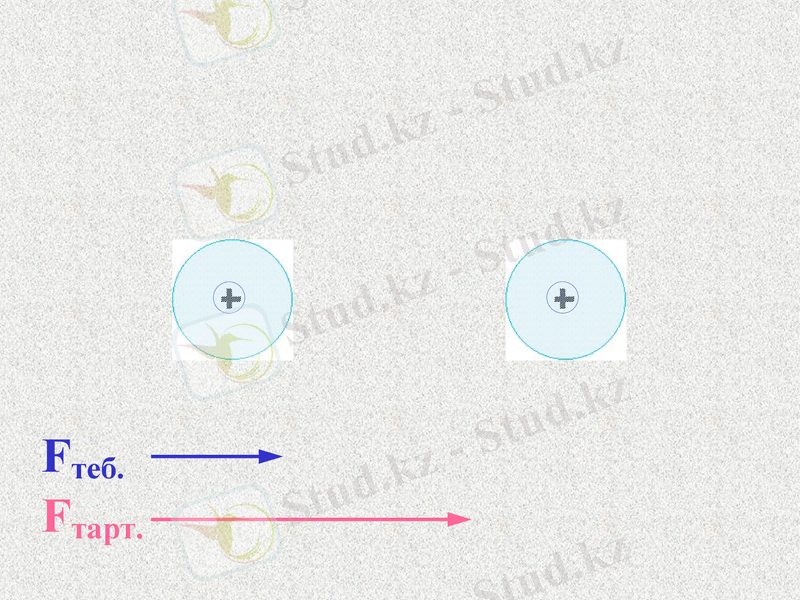
Notes: Здесь представлена предыдущая схема, только немного в другом виде
При таком соотношении сил атомы будут сближаться;
До каких пор?
Посмотрим - щелчок (55-74)
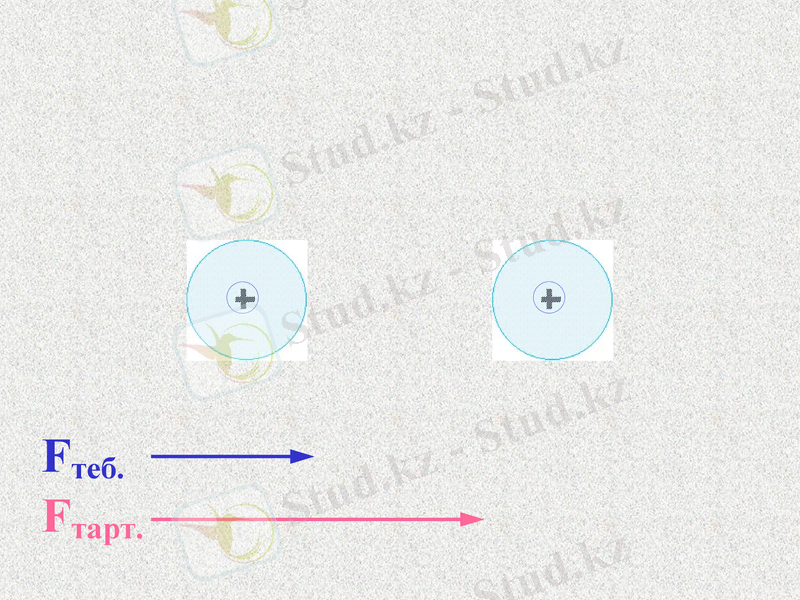
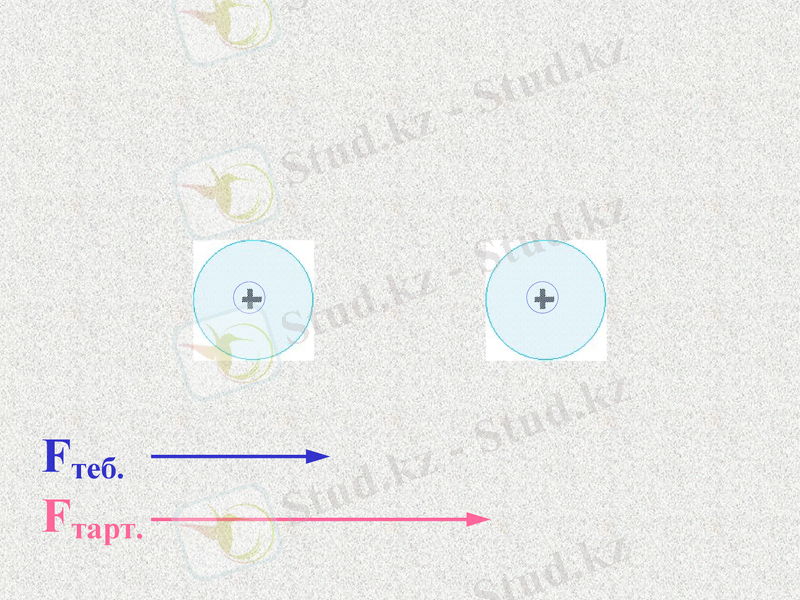
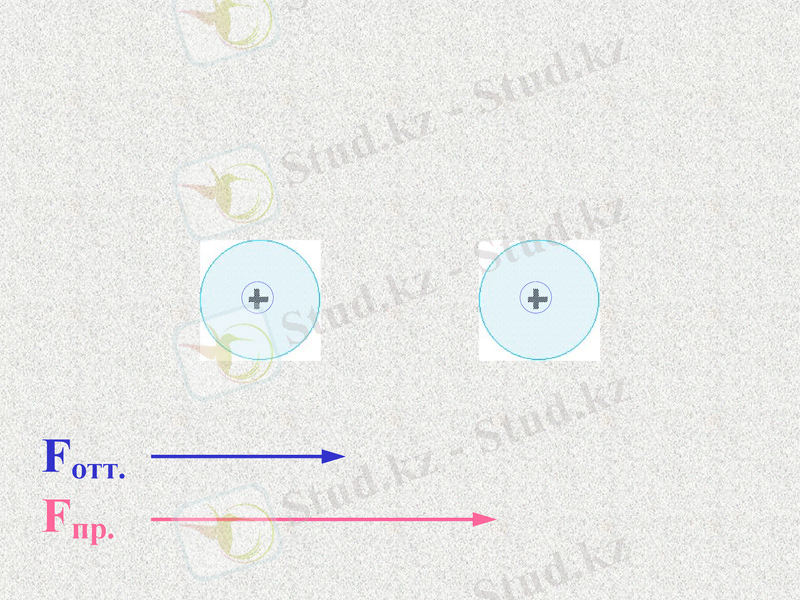
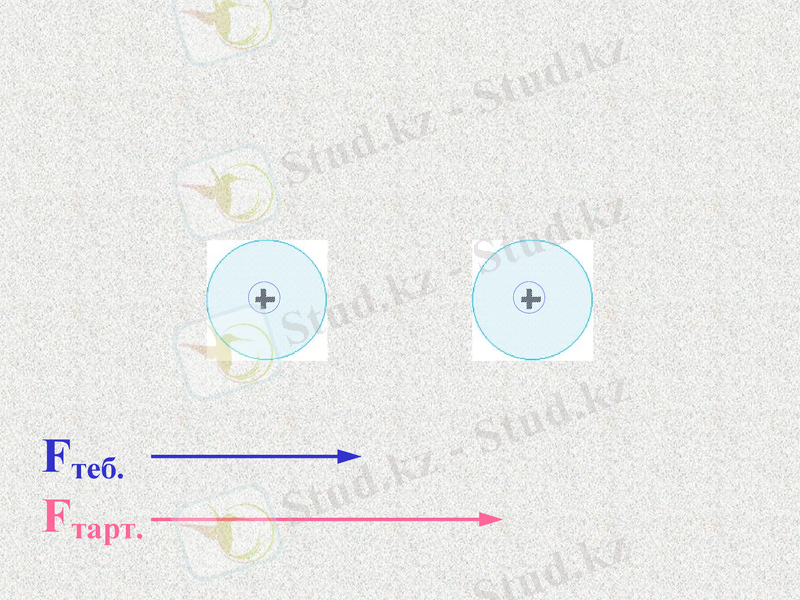
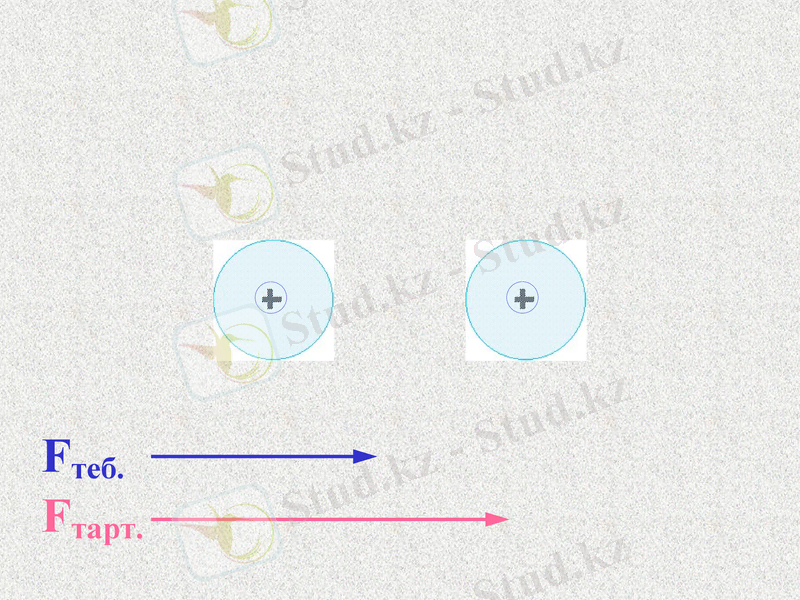
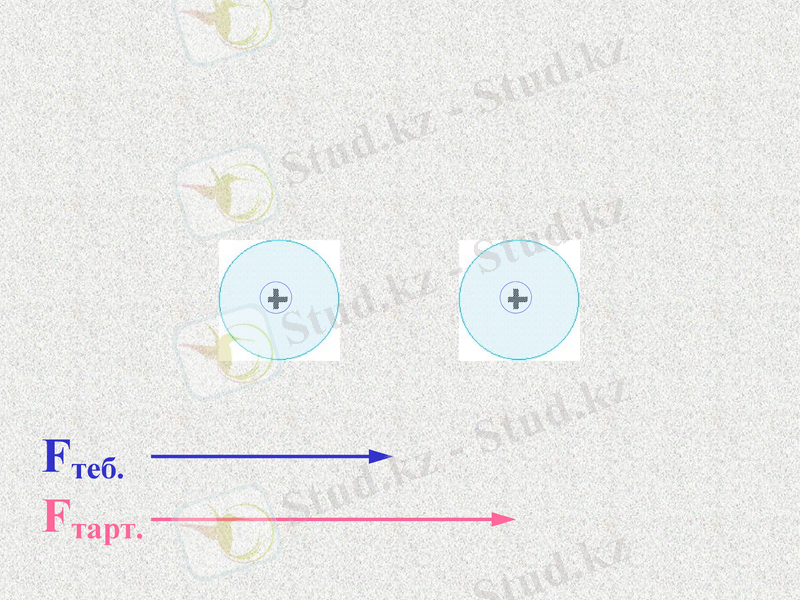
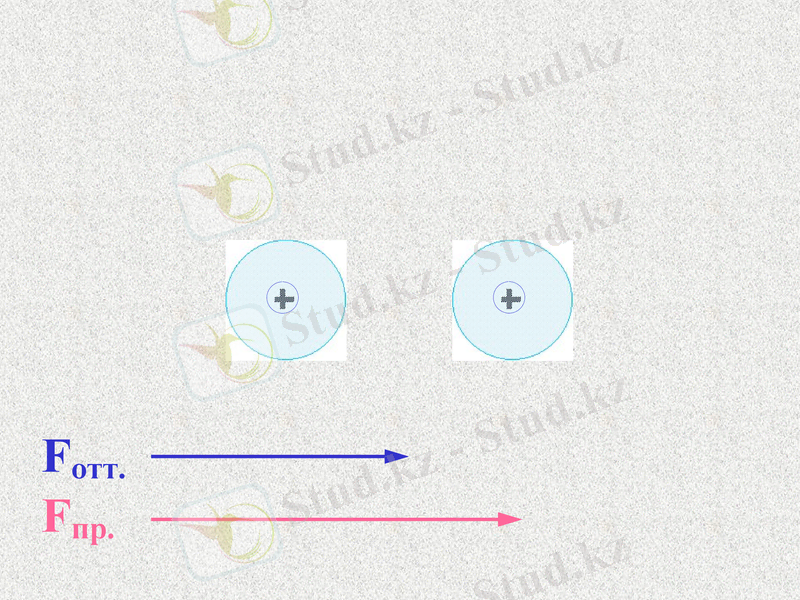
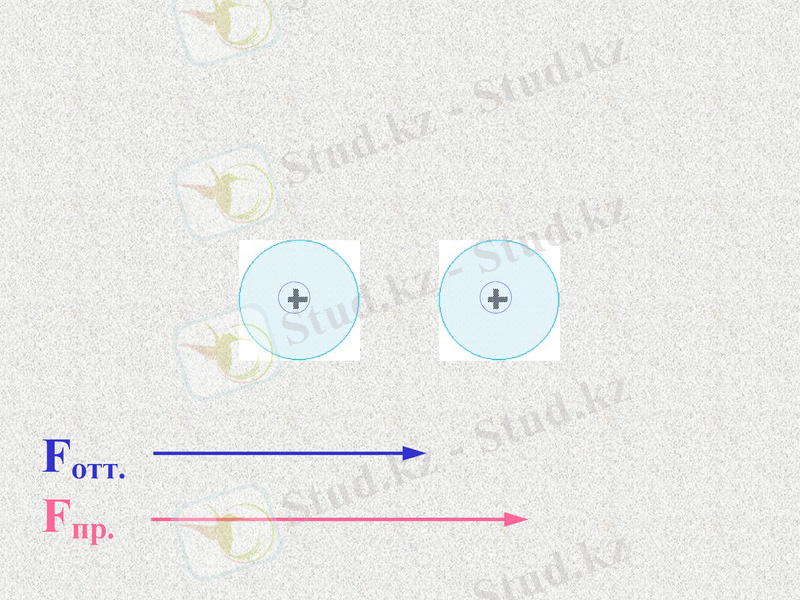
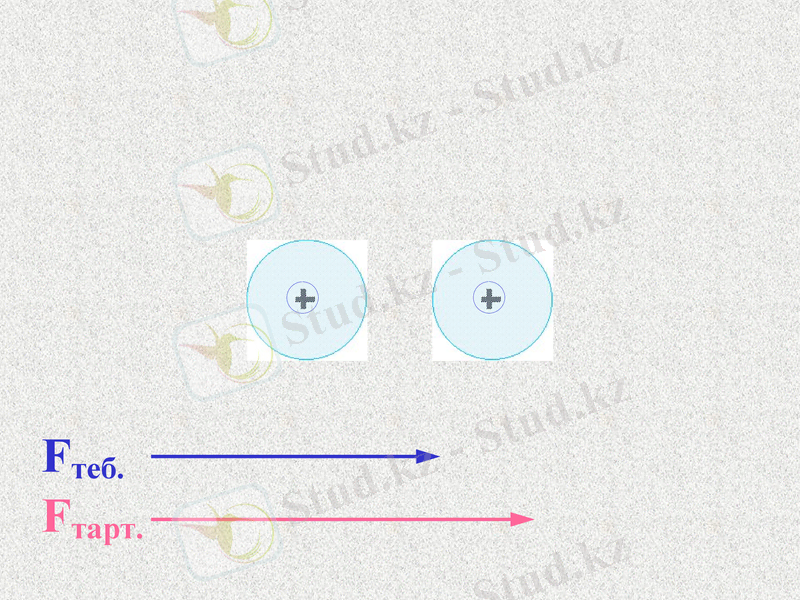
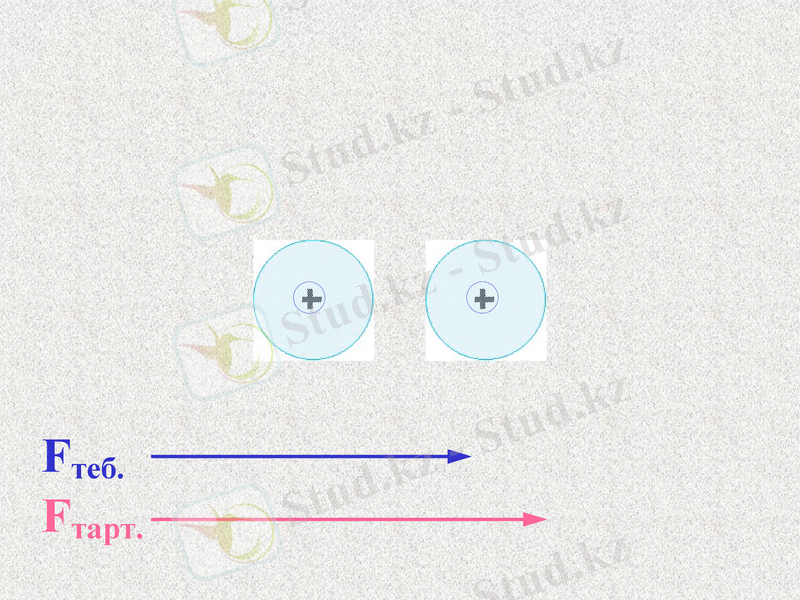
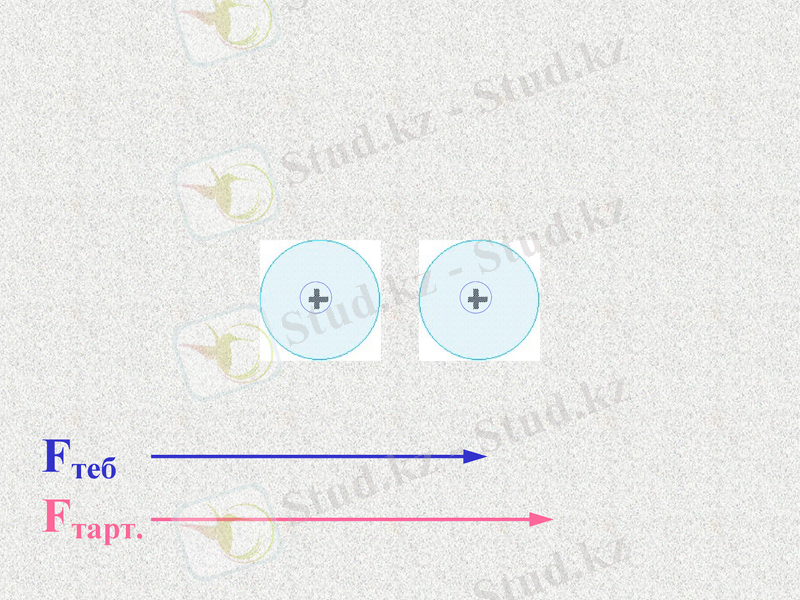
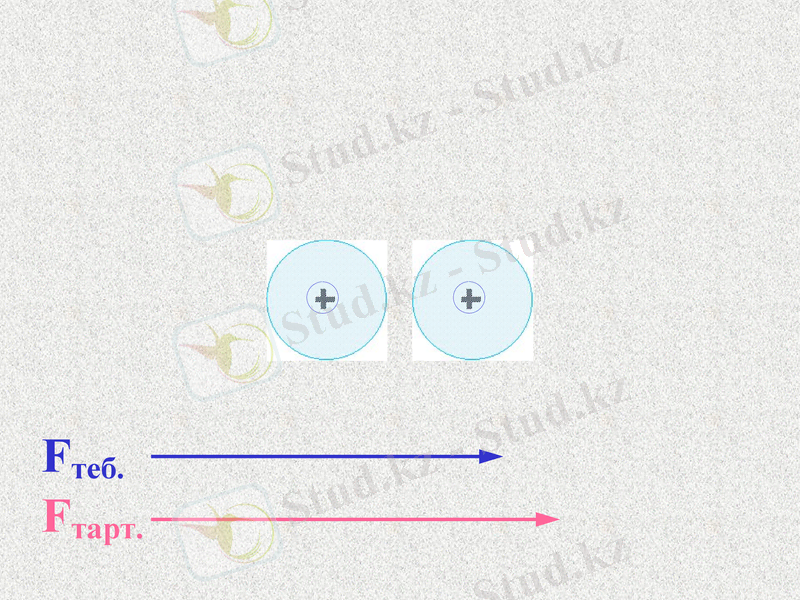
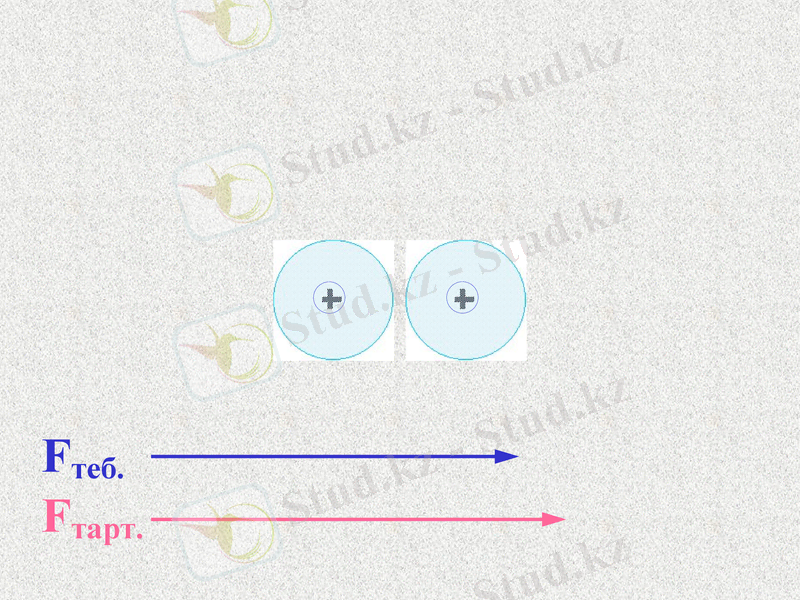
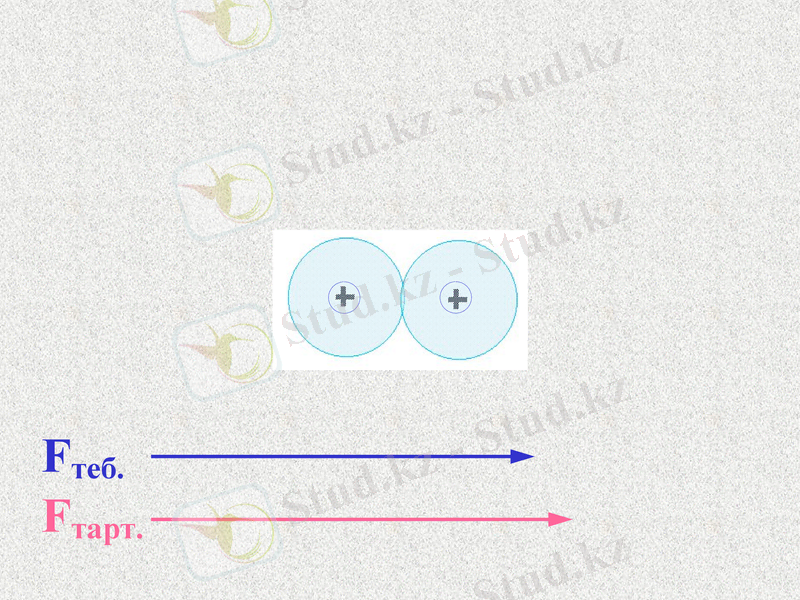
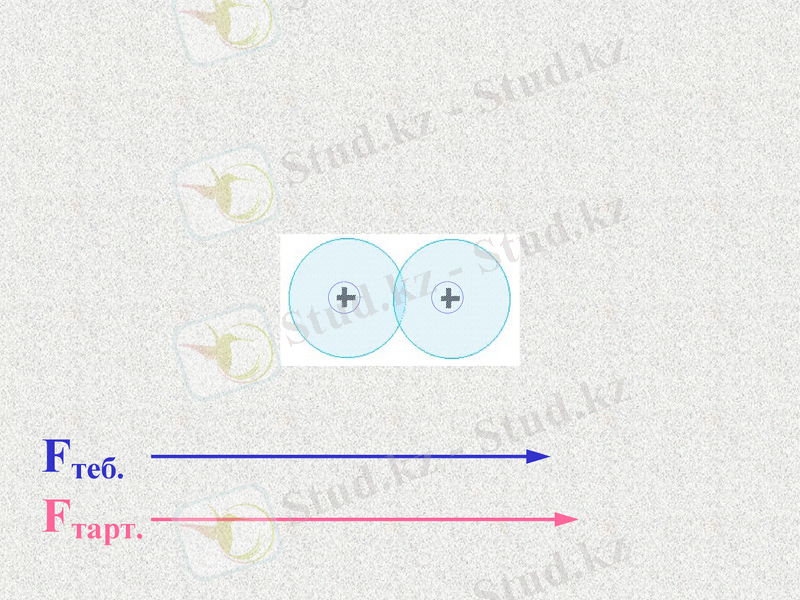
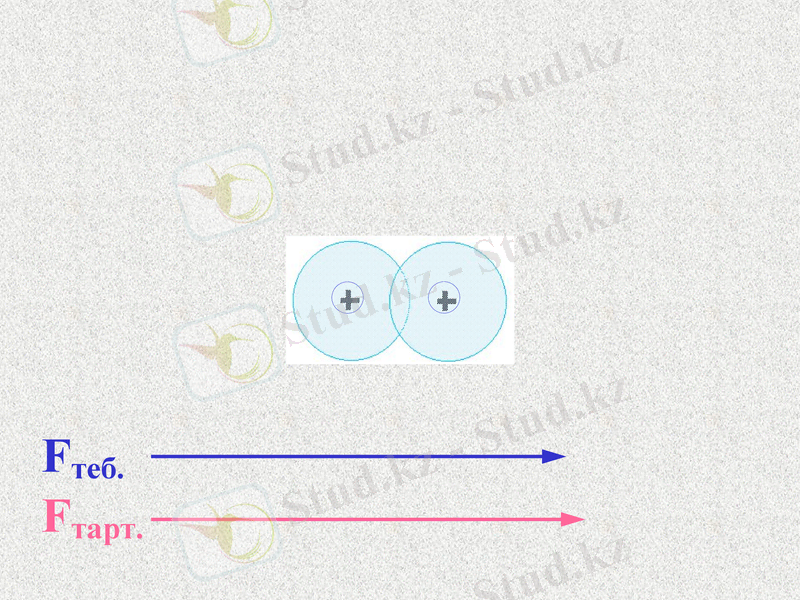
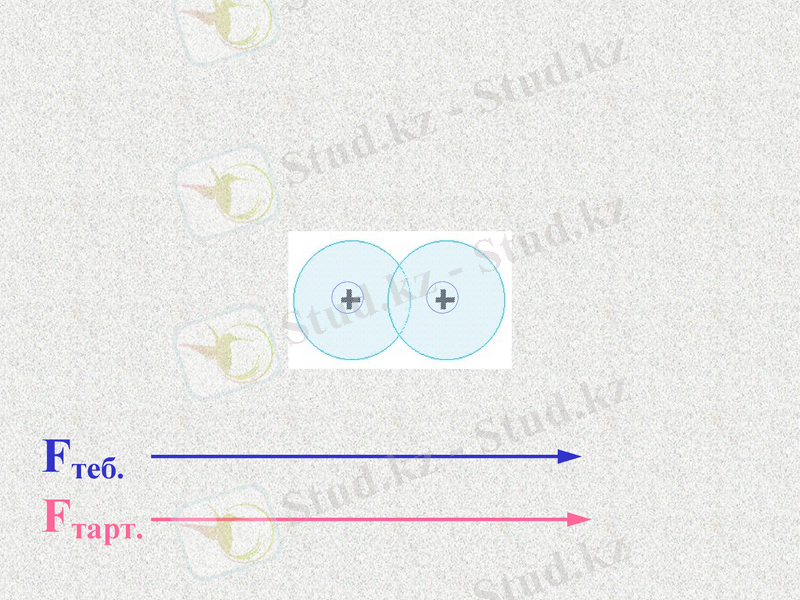
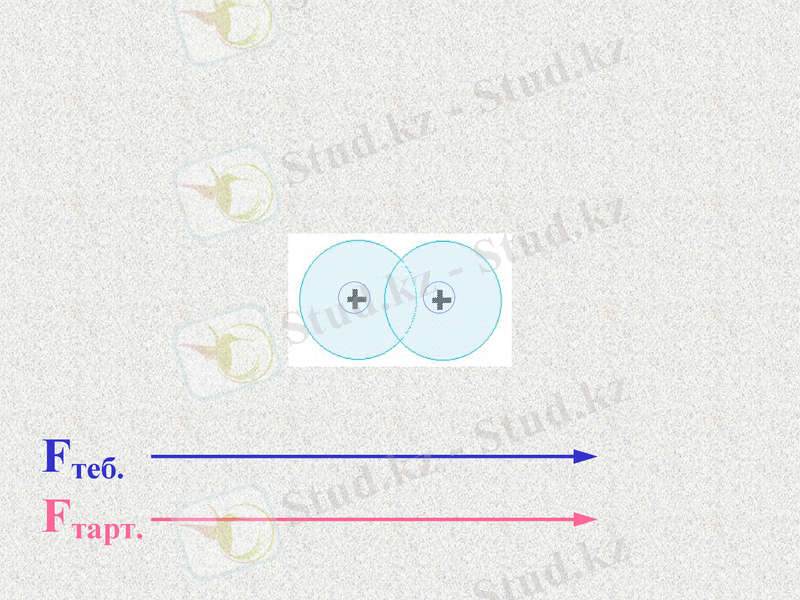
Notes: 74. равенство сил - обсудить. Щ
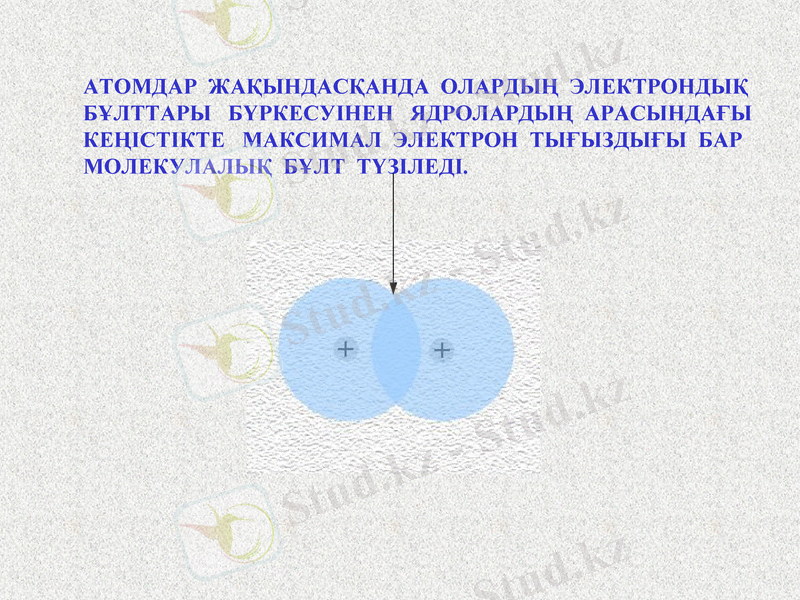
АТОМДАР ЖАҚЫНДАСҚАНДА ОЛАРДЫҢ ЭЛЕКТРОНДЫҚ БҰЛТТАРЫ БҮРКЕСУІНЕН ЯДРОЛАРДЫҢ АРАСЫНДАҒЫ КЕҢІСТІКТЕ МАКСИМАЛ ЭЛЕКТРОН ТЫҒЫЗДЫҒЫ БАР МОЛЕКУЛАЛЫҚ БҰЛТ ТҮЗІЛЕДІ.
Notes: Выполните рисунок в тетради
Н
+
Н
Н
Н
2ē
2ē
Бір ортақ электрон жұбы - бір химиялық байланыс
Молекуланың электрондық формуласы
Молекула түзілуінің электрондық схемасы
Notes: Итак, при взаимодействии двух атомов водорода их электронные облака перекрываются. Давайте расшифруем то, что у нас получилось.
Первый рисунок:
что он обозначает? Атом водорода
его знак? Н Щ
Сколько электронов у атома водорода на последнем слое? 1 Щ
Взаимодействует + Щ
Такой же атом Щ
При этом образуется? соединение из двух атомов водорода Щ
Что находится между атомами? 2 электрона Щ
Первый атом водорода думает, что эти электроны принадлежат ему Щ и у него 2 электрона на слое, Щ. Второй электрон думает, что …. . Щ……Щ
Почему оба атома довольны и система получается устойчивой? ………. .
Итак, образовалась Щ общая электронная пара - это одна химическая связь.
Щ формула, в которой показаны общие электронные пары называется электронной формулой,
Щ составленная нами схема называется электронной схемой образования молекулы
Возьмите из конверта рисунок, обведите электронную формулу и таким же цветом подчеркните название, аналогично со схемой.
В 1907 году русский химик Николай Александрович Морозов предположил, что химическая связь между атомами может получиться за счёт образования электронных пар. Это подтвердил в 1916 году американский физикохимик Гилберт-Ньютон Льюис. Электронные формулы ещё называют формулами Льюиса.
2ē
2ē
+17Cl
Cl2
Cl
+
Cl
Cl
Cl
Cl
Cl
Енді оттегі молекуласындағы байланыстың түзілуін қарастырайық.
Оттек атомының электрондық формуласы 1s22s22p4, валенттілік электрондары 2s22p4,
электртерістілігі 3, 5.
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz