Металдар мен бейметалдардың физика-химиялық қасиеттері және темір қорытпалары



Металдар мен бейметалдар қасиеттері
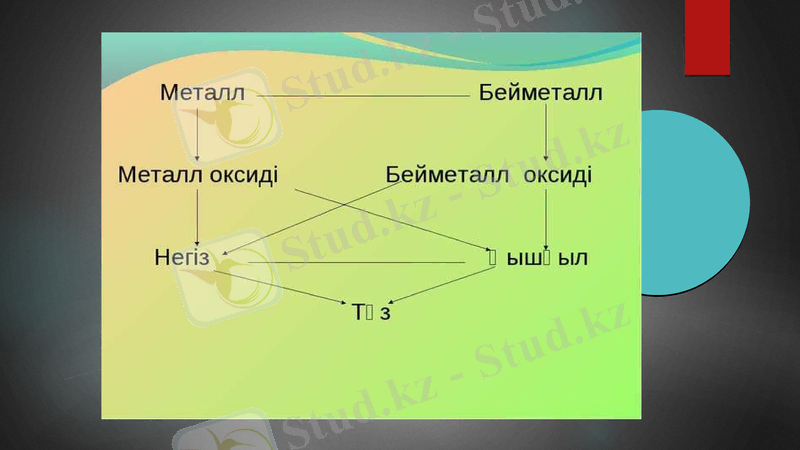

Металдар
Металдар- Электр тоғы мен жылуды жақсы өткізетін, пластикалық қасиеті жоғары, жылтыр заттар. Мұндай қасиеттердің болуы металдардың ішкі құрылымымен байланысты. Металдардың (сынаптан басқа) кристалдық тор көздерінде металл атомдары орналасқан. Олар бір-бірімен металдық байланыспен байланысады. Металдардың иондану энергиясы аз болғандықтан олардың валенттік электрондары оңай бөлініп, бүкіл кристалдың бойында еркін қозғала алады. Сондықтан олардың жиынтығын электрон газы деп те атайды. Су ерітінділеріндегі реакциялар үшін металдың активтілігі оның активті қатардағы орнына байланысты.


Сөзжұмбақ

Темір мен оның құймалары
Металдардың қаттылығы, температураға төзімділігі күнделікті тәжірибеде шешуші рөл атқарады. Егер шыны хроммен кесілсе, ал цезийді адам тырнағымен-ақ кесе алады. Кейбір металдар жұмсақ (күміс, алтын, т. б. ) болғандықтан таза металдардың орнына олардың бір-бірімен құймалары қолданылады. Ең алғаш алынған құймалардың бірі - қола.
Темір мен оның құймалары (шойын, болат) қара металдар, ал қалғандары түсті металдар; алтын, күміс, платина химиялық реактивтерге төзімділігіне байланысты асыл металдар; сумен әрекеттесіп сілті түзетін металдарды сілтілік (Lі, Na, K, Rb, Cs), ал жер қыртысының негізін құрайтындарын сілтілік жер металдар; массалық үлесі 0, 01%-дан аспайтындарын сирек металдар деп атайды. Өнеркәсіпте металдарды негізінен пирометаллургия, гидрометаллургия және электрметаллургия әдістерімен алады. Металдар электр сымдарын, тұрмысқа қажет бұйымдар (қазан, балға, т. б. ) жасауда, т. б. кеңінен қолданылады.

Табиғатта көп кездесетін металдар:
Табиғатта көп кездесетін металдар қатарына жатады: Табиғи металдарAl (8, 1%) Fe (4, 65%) Ca (3, 6%) Na (2, 64%) K (2, 5%) Mg (2, 1%) Tі (0, 57%) Mn (0, 1%) Ba (0, 05%) Sr (0, 03%)

Металдардың физикалық қасиеттері:
Бұл қасиеттерге жылу жəне электрөткізгіштік, металдық жылтыры, иілімділігі, т. б қасиеттері жатады
Электр жəне жылуөткізгіштігі Электр өрісінің əсерінен электрондар бағытты қозғалысқа ие болады, сөйтіп, электр тогы пайда болады. Электрөткізгіштігі ең жоғары металдар күміс пен мыс, одан кейін алтын, алюминий, темір болып келеді. Ең аз электрөткізгіштік сынапқа тəн.
Металдық жылтыры Бұл металдардың өзіне тəн қасиеттерінің бірі-оны адамдар өте жоғары бағалап, кейбір көркемөнер туындыларын жасауға пайдаланады. Металдың бəрі де мөлдір емес, өзіндік жылтыры бар. Олар көбінесе сұр түсті болып келеді.
Иілімділігі (пластикалығы) Металдарды соққанда, ұсақ түйіршіктерге бөлініп шашырап қалмайды, небəрі пішінін өзгертіп тапталады не жанашылады, яғни соғуға төзімді пластикалық қасиетін, иілімділігін көрсетеді.
Балқу температурасы1000° жоғары температурада балқитын металдарды қиын балқитын, ал одан төмен болса, оңай балқитын деп бөлінеді. Ең оңай балқитын металл-сынап оның балқу температурасы 38, 9 градус. Ең қиын балқитын металл-вольфрам, оның балқу температурасы 3390 градус, сондықтан оны элеткр шамынынң сымын дайындау үшін қолданады

Металдардың химиялық қасиеттері:
Металдардың көпшілігі химиялық активті элементтер болғандықтан жай және күрделі заттармен әрекеттеседі
Жай заттармен:
2Mg + 02 = 2MgO + Q жану реакциясы
Fe + S = FeS темір (II) сульфиді
Са + Сl2 = СаСl2 кальций хлориді
Металл гидридтері тұз сияқты қатты заттар. Металл гидридтерінде ғана сутегінің тотығу дәрежесі - 1 болады, себебі металдар электрондарын сутектің атомдык радиусы кіші болғандықтан оңай береді.
Күрделі заттармен:
Сілтілік және сілтілік жер металдар сумен куатты әрекеттесіп, судағы сутекті ығыстырып шығарады.
2Na + 2Н2O = 2NaOH + Н2↑
Металдар қышқылдармен әрекеттеседі. Реакция нәтижесінде түзілетін өнімнің табиғаты металдың белсенділігіне жөне қышқылдардың концентрациясына тәуелді
Zn + H2SO4 (сұйык) = ZnSO4 + Н2
Zn + 2H2SO4(конц. ) = ZnSO4 + SO2↑ + 2H2О

Темір
Темір түсі ақ, жылтыр метал. Темір - Менделеев кестесіндегі атомдық нөмірі 26 болып келетін элемент. Fe ( лат. : Ferrum) деп белгіленеді. тығыздығы ρ=7, 85г/см³, атомдық массасы 55, 85г, атомдық радиусы 1, 54Å. Жерде ең көп таралған металл қатарында. Ересек адамның организмінде 3, 5-4 грамм темір болады. Темірдің ерекшелігі оның аллотропиялық өзгеріске душар болатындығында, қатты күйінде қыздырып және суытып, оны өзгеріске түсіруге болады. Температураға байланысты темір әртүрлі модификацияда болады. Темір қалыпты жағдайда көлемдік центрленген кубтық торды иемденеді. Темірдің төрт аллотропиялық түрі бар: α- Fe, ол қалыпты жағдайда 770˚С дейін тұрақты түрі көлем ішіне центрленген куб торлы, өзінің ферромагниттік қасиеті болады; Β-Fe температура 770˚С жоғары көтерілгенде α- Fe Β-Fe ауады, кристалдық құрылымы өзгермегенмен ферромагниттік қасиеті жойылы, парамагнитті болады; γ- Fe, темірді ары қарай қыздырғанда 906˚С полиморфтық өзгеріске ұшырайды. Кристалы жақ ішіне центрленген куб торына ауады, металл парамагнитті қалпында қала береді; δ-Fe темірді қатты қыздырып 1401˚С болғанда полиморфтық өзгеріс болып, кристалдық торы көлнм ішіне центрленген куб түріне қайта оралады. Жұмсақ болат, немесе соққыланғыш темір - ол құрамында 0, 2% кем көміртегі бар, темір қорытпасы.

Темір - ең ежелгі металл қатарында. Ең алғашқы темірден жасалған заттар біздің заманымыздан бұрын 4 мыңжылдыққа жасалған, ежелгі шумер және ежелгі Египет өркениетінің еншісінде. Темір металы адам баласына осыдан бірнеше мың жыл бұрын-ақ белгілі болған. Алайда оның адамға толық қызмет ете бастағанына жүз жылдан астам уақыт ғана өтті. Бұл металлдардың қажеттілігі соншалық, онсыз күнделікті тіршілігімізді көзге елестететудің өзі мүмкін емес. Темір - бұл машиналар мен станоктар, поездар мен самолеттер, машиналар т. б Адам баласына темірден артық қажетті металды атау мүмкін емес сияқты. Темірді қалағаныңша өндеуге, оны балқытуға, ұзартып созуға, қалыптап құюға, кесуге болады. Қазіргі заманғы техникада неізінен алғанда, әр түрлі заттар, көбінесе көміртегі қосылған қорытпалар түрінде қолданылады. Қорытпада көміртегі көп болған жағдайда темір қатты болады, бірақ өте морт сынғыш келеді. Бұл - кәдімгі шойын. Егер көміртегі аздау болса, металл тіптен қаттырақ, иілгіш, серпінді бірак әлі де, болса морт сынғыш келеді. Бұл - болат. Көміртегіні одан да гөрі азайтса - темір жұмсақ, оңай иілгіш келеді әрі оңайлықпен сына қоймайды. Егер болатқа белгілі бір заттарды аздап қосса, онда қоспалы болат алынады.

Болат
Болат - темірдің көміртек (2%-ке дейін) және басқа элементтермен қорытпасы; темірдің көміртегі және басқа элементтермен қосылып жасалған деформацияланатын қорытпасы. Болат - өндіру технологиясына байланысты, қорытпа құрамында көміртектен басқа марганец, кремний, күкірт, фосфор т. б. қосалқы элементтер болады. Мұндай болатты көміртекті болат деп атайды. Болат сапасын арттыру үшін, қорытпа құрамына хром, никель, молибден, ванадий вольфрам, марганец, кремний т. б. элементтер қосылады. Мұндай қорытпа легирленген болат деп аталады. Шойынды болатқа аударудағы негізгі жұмыс-құрамындағы көміртекті азайту, ол үшін көміртекті жандырып, оксидке айналдырып ұшырады. Бұл жандыру кезінде марганец пен кремний де тотығады. Соңғы кезде болат қорытуға электр пештер қолданатын болды, мүнда температура 2000 градусқа дейін жеткізіледі. Болат - қара металлургия өндірісінің негізі - машина жасау өнеркәсібі мен құрылыста пайдаланылатын негізгі материал. Пайдалану саласына қарай, болатты басты-басты екі топқа бөлуге болады:Құрылыстық болат. Әдетте, прокат күйінде құрылыс конструкцияларының әртүрлі элементтері мен вагон, кеме жасауда қолданылады. Машина жасау болатынан негізінен әр түрлі машина бөлшектері жасалады. Ол үшін термиялық өңдеу мен химиялық-термиялық өңдеуден өтеді. Аспаптық болат әр түрлі кесу, өлшеу, штамп аспаптарын жасауға пайдаланылады. Айырықша-физикалық қасиеттері бар болат кәбінесе электр техникасы, химия, әскери техникаларын жасауда пайдаланылады. Болат - ол темірдің балқымасы, ондағы көміртектің мөлшері 1, 7% кем.

Шойын
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz