Тұздардың гидролизі: түрлері, механизмдері, теңдеулері мен қолданылуы



Тұздар гидролизі Орындаған: Маратов Толеухан Ғылымбек Жасұлан Асылхан Дәурен Топ: Мт-201

Кейбір тұздардың суда диссоциацияланғанда түзілген гидраттанған катиондары немесе аниондарының су молекуласымен сәйкесінше қышқылды немесе сілтілі орта түзе әрекеттесуі тұздардың гидролизі деп аталады.

Гидролиз процесіне құрамында әлсіз қышқыл немесе әлсіз негіздің иондары бар тұздар ғана түседі. Ал күшті қышқылдар мен күшті негіздердің әрекеттесуінен түзілген тұздар (NaCl, KNO3, BaCl2 және т. б. ) гидролизденбейді. Себебі, олардың гидраттанған иондары су молекуласымен әрекеттеспейді және нәтижесінде әлсіз электролит түзілмейді.

Тұздардың табиғатына байланысты үш түрлі
гидролиздену реакциясы болады:
1. Күшті қышқыл мен әлсіз негіздің әрекеттесуінен түзілген тұздардың CuCl2, NH4Cl, Al2(SO4) 3 және т. б. гидролизі. Бұл жағдайда гидролиз реакциясына, яғни тұздың құрамындағы гидраттанған катион мен су молекуласы әрекеттеседі де, нәтижесінде түзілген оксоний ионына байланысты ерітінді қышқылды (рН < 7) болады. Мысалы AlCl3 тұзы суда ерігенде диссоциацияланып, иондарға толық ыдырайды:
Диссоциациялану теңдеуі:
AlCl3 → Al3+ + 3Cl-
HOH → H+ + OH
Al3+ + 3Cl- + HOH → Al(OH) 2+ + H+ + 3Cl-
Гидролиз реакциясының иондық теңдеуі:
Al3+ + 3Cl- + HOH → Al(OH) 2+ + H+ + 3Cl-
Гидролиз реакциясының молекулалық теңдеуі:
AlCl3 + H2O → Al(OH) Cl2 + HCl
Ерітіндіде Al3+ ионы су молекуласынан гидроксид-ионды OH- оңай қосып алып, өте нашар диссоциацияланатын (Al(OH) 3-ке қарағанда) Al(OH) 2+ ионына ауысады. Мұның нәтижесінде судың келесі молекуласы диссоциацияланады. Сонымен, ерітіндіде сутегі иондарының көбеюіне әсер етеді.
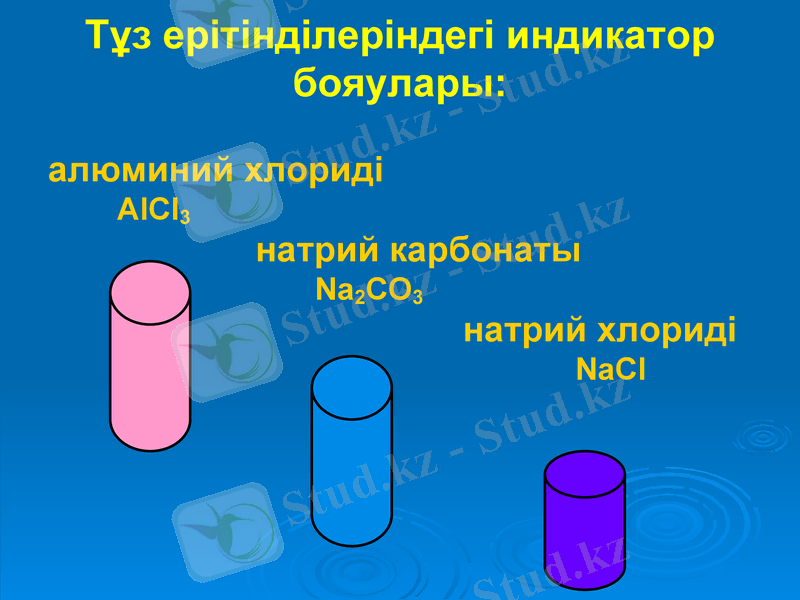
Тұз ерітінділеріндегі индикатор бояулары:
алюминий хлориді
AlCl3
натрий карбонаты
Na2CO3
натрий хлориді
NaCl
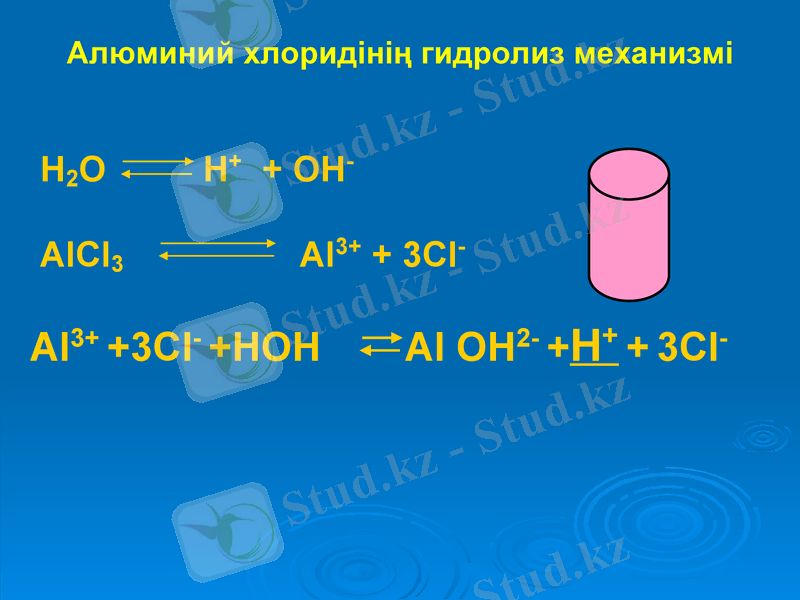
Алюминий хлоридінің гидролиз механизмі
H2O H+ + OH-
AlCl3 Al3+ + 3Cl-
Al3+ +3Cl- +HOH Al OH2- +H+ + 3Cl-
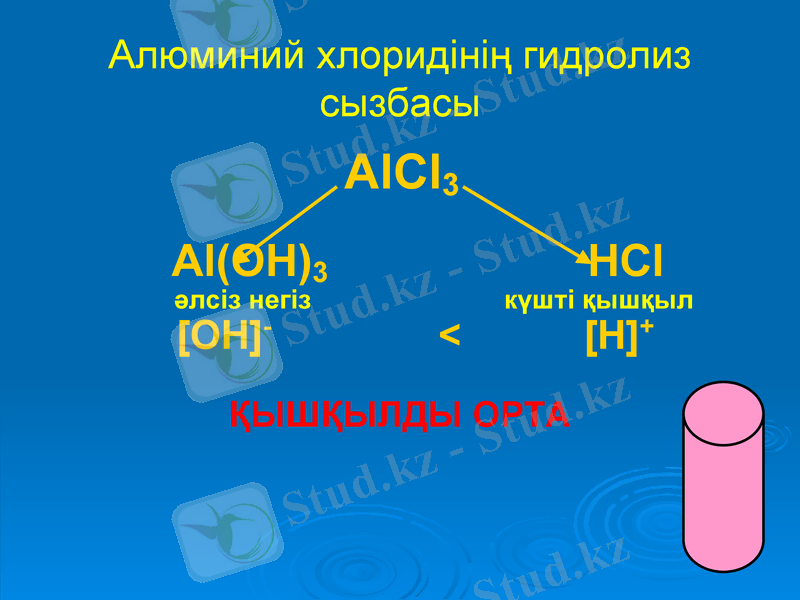
Алюминий хлоридінің гидролиз сызбасы
AlCl3
Al(OH) 3 HCl
әлсіз негіз күшті қышқыл
[OH] - < [H] +
ҚЫШҚЫЛДЫ ОРТА

2. Әлсіз қышқыл мен күшті негіздердің әрекеттесуінен түзілген тұздардың CH3COONa, Na2CO3, KCN, Na2SO3, KNO2 және т. б. гидролизі. Бұл жағдайда гидролиз реакциясына тұздың құрамындағы әлсіз қышқылдың қалдығы болып саналатын гидраттанған анион түседі де, нәтижесінде ерітінді сілтілі (рН > 7) болады.
Диссоциациялану теңдеуі:
Na2CO3 ⇄ 2Na+ + CO32-
H2O ⇄ H+ + OH-
2Na+ + CO32- + HOH ⇄ 2Na+ + HCO3- + OH-
Гидролиз реакциясының иондық теңдеуі:
2Na+ + CO32- + HOH ⇄ 2Na+ + HCO3- + OH-
Гидролиз реакциясының молекулалық теңдеуі:
Na2CO3 + H2O ⇄ NaOH + NaHCO3
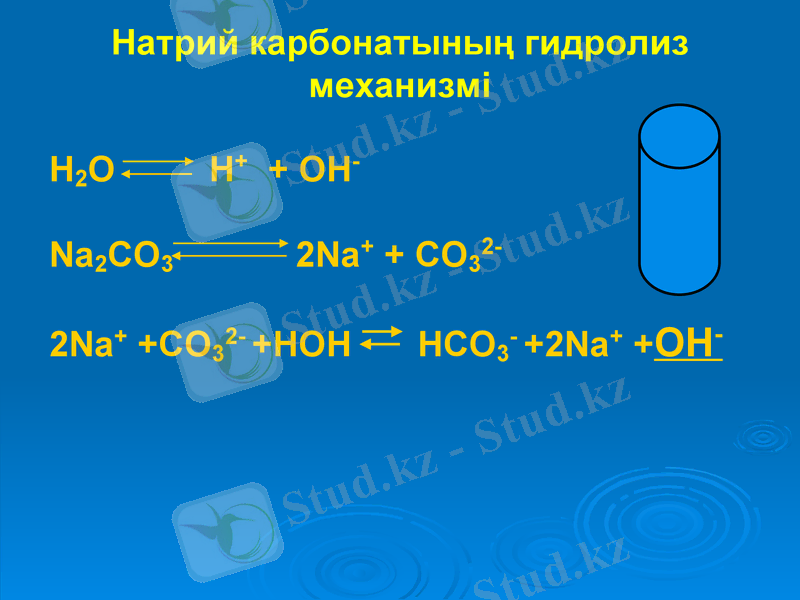
Натрий карбонатының гидролиз механизмі
H2O H+ + OH-
Na2CO3 2Na+ + CO32-
2Na+ +CO32- +HOH HCO3- +2Na+ +OH-
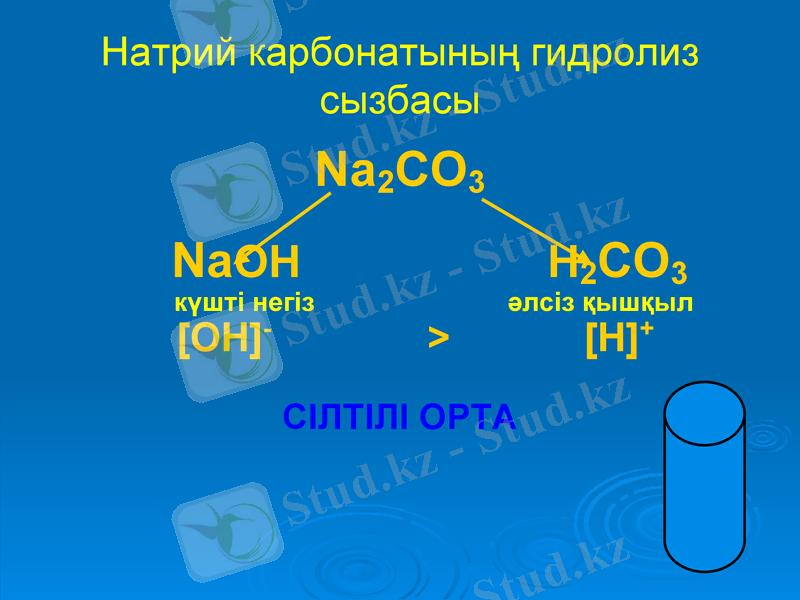
Натрий карбонатының гидролиз сызбасы
Na2CO3
NaOH H2CO3
күшті негіз әлсіз қышқыл
[OH] - > [H] +
СІЛТІЛІ ОРТА
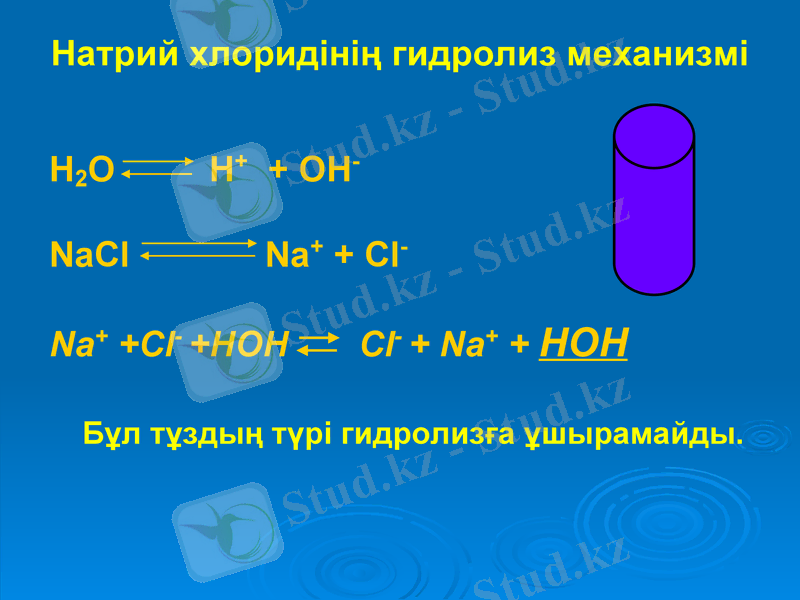
Натрий хлоридінің гидролиз механизмі
H2O H+ + OH-
NaСl Na+ + Cl-
Na+ +Cl- +HOH Cl- + Na+ + HOH
Бұл тұздың түрі гидролизға ұшырамайды.
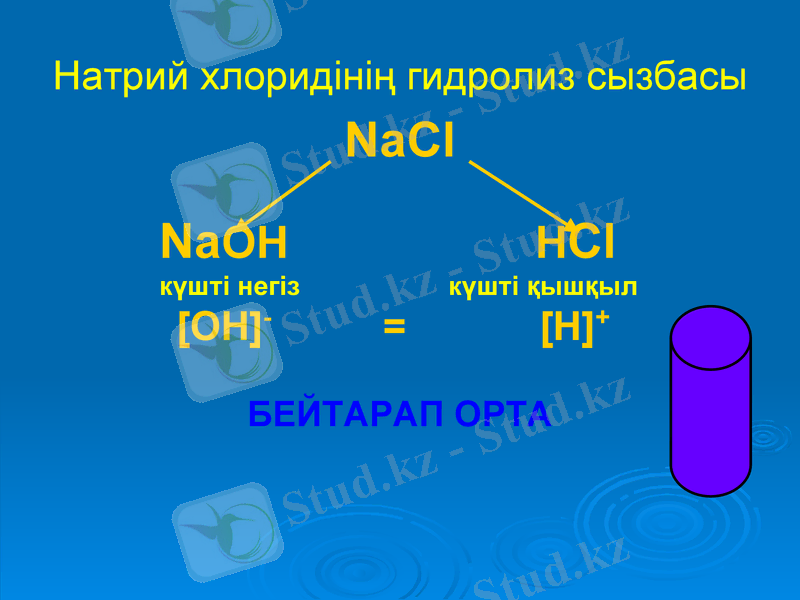
Натрий хлоридінің гидролиз сызбасы
NaCl
NaOH HCl
күшті негіз күшті қышқыл
[OH] - = [H] +
БЕЙТАРАП ОРТА

3. Әлсіз негіз бен әлсіз қышқылдан түзілген тұздар да гидролизге ұшырайды. Бұл жағдайда гидролиздену процесі соңына дейін жүріп, қышқыл мен негіз түзіледі. Мысалы, алюминий сульфиді Al2S3 сумен әрекеттескенде алюминий гидроксиді Al(OH) 3 мен күкіртсутек H2S түзіліп, гидролиздену реакциясы қайтымсыз болады:
Al2S3 + 6H2O = 2Al(OH) 3↓ + 3H2S↑
Олай болса, тұздардың гидролизге ұшырауы, олардың иондарының құрамы мен мен қаисетіне байланысты.

Гидролиздену дәрежесі αг
Гидролиздену дәрежесі αг дегеніміз - бұл ерітіндідегі гидролизденген молекулалар санының жалпы еріген молекулалар санына қатынасына тең шама.
αг - гидролизденген молекулалардың жалпы саны. Бұл санның мөлшері көбінесе оң болады. Мысалы, соданың Na2CO3 0, 1 моль ерітіндісінде 25оС кезінде оның гидролиздену дәрежесі αг = 2, 9% болады. Гидролиздену дәрежесі температураны өсіріп, ерітіндінің концентрациясын кеміткен сайын арта түседі.

Гидролиздену константасы
Гидролиздену константасы:
CH3COO- + H2O ⇄ CH3COOH + OH-;
[CH3COOH] [OH-]
Кд =
[CH3COO-] [H2O]
Мұндағы судың концентрациясы тұрақты, олай болса Кд · [H2O] көбейтіндісі де тұрақты болады. Осы тұрақты шама гидролиздену константасы деп аталады. Бұл жағдайда жоғарыдағы қатынасты төмендегідей күйде жазуға болады:
[CH3COOH] [OH-]
Кг =
[CH3COO-]

Бұл қатынастан, Кг гидролиздену константасы гидролиз реакциясына түскен элементтердің молярлық концентрациялары көбейтіндісінің гидролизденген ионның молярлық концентрациясына қатынасына тең шама екенін анықтаймыз. Осы қатынастың алымын да, бөлімін де [H+] шамаға көбейтсек, онда [H+] ·[OH-] = Kw, ал [CH3COOH] / [CH3COO-] · [H+] = 1/ Кд қатынастарына тең болатындықтан, бастапқы қатынас төмендегідей күйге ауысады:
Kw
Кг =
Кд қыш.
Егер тұз күшті қышқыл мен әлсіз негіздің әрекеттесуінен түзілген болса, онда ол тұздың гидролиздену константасы былай жазылады:
Kw
Кг =
Кд негіз

Әлсіз қышқыл мен әлсіз негіздің әрекеттесуінен түзілген тұздың гидролиздену константасы:
Kw
Кг =
Кд негіз · Кд қыш.
Осы қатынастарға көңіл бөле отырып, тұздың құрамындағы қышқыл немесе негіз неғұрлым әлсіз болса, яғни Кд мәндері неғұрлым аз болса, соғұрлым бұл тұздардың Кг гидролиздену константаларының мәндері жоғары болады, яғни гидролиздену реакциясы терең жүреді.

Тақтаға жазылған теңдеулерді талдау кезінде оқушыларға мынадай жетекші сұрақтар берілді:
Гидролиз кезінде судың диссоциациялану тепе-теңдігі қалай өзгереді?
Неліктен соданың судағы ерітіндісі сілтілік қасиет көрсетеді?
Оқушылардың жауабы тыңдала келе толықтырылып, қорытынды жасалады.
Ерітіндіде карбонат ионы (CO22-) су молекуласынан сутегі (H+) ионын қосып алып, нәтижесінде қиын диссоциацияланатын (H2CO3 -ке қарағанда) гидрокарбонат ионы (HCO3-) түзіледі де, гидроксид ионы (OH-) босап шығады. Мұның өзі судың келесі молекуласының диссоциациялануына әсер етеді, сөйтіп тепе-теңдік H+ + OH- иондарының түзілуіне қарай ауысады. Мұндай ерітінді бос OH- есебінен сілтілік орта көрсетеді. Соңынан гидролиз реакциясының молекулалық теңдеуін талдай келе реакция нәтижесінде екі жаңа зат - NaOH және NaHCO3 түзілетінін, ал натрий гидросиді NaOH оңай диссоциацияланатын күшті электролит екенін түсінеді. Әлсіз қышқылдар мен күшті негіздерден түзілген тұздар гидролизі кезінде қышқыл қалдығының иондары су молекуласынан сутегі H+ иондарын өзіне қосып алады, ал гидроксид ионы OH- ерітіндіге босап шығады. Мұндай ерітінді сілтілік орта көрсетеді деген жалпы қорытынды жасалады.

Енді күшті қышқыл мен әлсіз негізден түзілген тұздар гидролизін қарастырамыз. Мысалы, алюминий хлориді (AlCl3) күшті қышқыл HCl мен әлсіз негіз Al(OH3) -тен түзілген. Алдымен тұз ерітіндісінің индикаторға әсерін демонстрациялық тәжірибемен көрсетеміз. Оқушыларды қатынастыра тақтаға иондық, молекулалық теңдеулерін жазамыз.
Әлсіз негіздер мен күшті қышқылдан түзілген тұздар гидролизі кезінде металл иондары су молекуласынан гидроксид-ионды (OH-) өзіне қосып алады, ал сутегі иондары (H+) ерітіндіде бос күйінде қалады да, қышқылдық ортаның реакциясын көрсетеді. Суда еритін тұзлар ғана гидролизденеді. Бұл кезде:
а) металдың әрбір ионымен (әлсіз негіздер тұзы болса) немесе қышқыл қалдығы ионымен (әлсіз қышқылдар тұзы болса) судың бір молекуласы ғана әрекеттеседі;
ә) гидролиз реакциясы - қайтымды реакция екені туралы қорытынды жасалады.
Жаңа білім тұздар гидролизі бойынша тапсырмалар беру арқылы бекітілді.

Тапсырмалар оқушылардың біліміне қарай үш деңгейде берілді. Сары түсті карточка білімі орташа оқушыларға; жасыл түсті білімі жақсы оқушыларға; қызыл түсті білімі өте жоғары оқушыларға үлестірілді.
І топ (сары түс) .
Мына тұздарды түзетін негіздер мен қышқылдардың формулаларын жазып, тұздарды алу реакцияларының теңдеулерін құрыңыздар.
а) мыс сульфаты (ІІ) ;
ә) калий сульфиді;
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz