Полярографиялық және амперметрлік талдау әдістері: негіздері, әдістері және қолданылуы



Полярографиялық және амперметрлік талдау әдістері

Жоспар
1 Полярография
2 Полярографиялық талдау әдісі
3 Илькович теңдеуі
4 Амперметрлік титрлеу әдісі
5 Бір индекаторлық электроды бар амперметрлік титрлеу әдісі
6 Екі индекаторлық электроды бар амперметрлік титрлеу әдіс
7 Қолданылуы
8 Глоссарий
Вольтамперометрия
Ампереметр
Полярография

Полярографиялық талдау әдісі - электрохимиялық талдау әдісінің бірі болып табылады. Ол ұяшықтағы зерттелетін ерітіндінің электролизі кезінде алынатын вольтамперлі қисықтарды анықтауға негізделген. Бұл әдісті 1922ж чех ғалымы Я. Гейровский ерітіндідегі ток күшінің кернеуге тәуелділігін зерттей отырып, ұсынды. Оны одан әрі қарай дамытқан А. М. Фрумкин.
Полярография (фр. Polarographie) - ток пен заттың концентрациясының өзара тәуелділігінен туатын электр тогын анықтауға негізделген әдіс болып табылады.
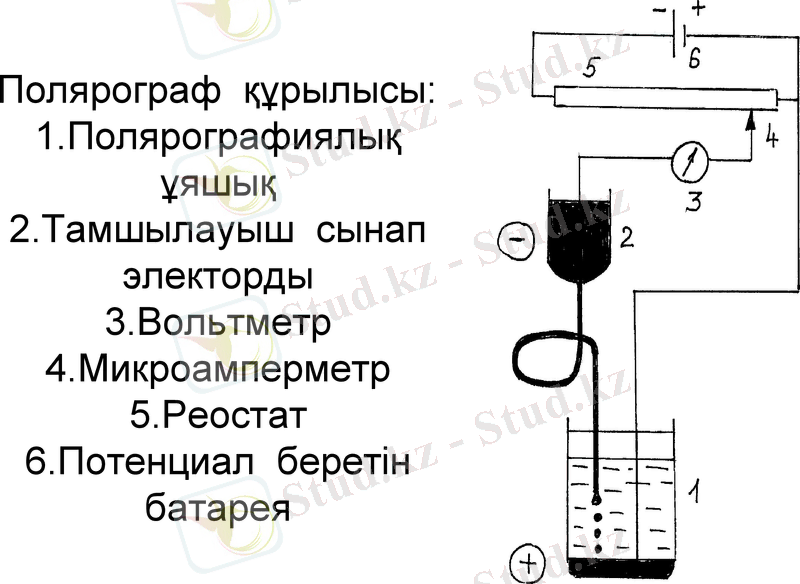
Полярограф құрылысы:
1. Полярографиялық ұяшық
2. Тамшылауыш сынап электорды
3. Вольтметр
4. Микроамперметр
5. Реостат
6. Потенциал беретін батарея

Полярографияда да 2 электрод қолданылады: бір электродтың бет өлшемі өте кішкене (микроэлектрод), екіншісінікі - үлкен болады. Анықталатын зат бір электродтың бетінде не тотығады, не тотықсызданады.
Полярографиялық тәсілдің басты ерекшелігі - катод ретінде сұйық тамшылауыш сынапты пайдалану ( заттарды анықтауда) . Тамшылауыш сынап электроды дегеніміз диаметрі өте жіңішке түтіктен тамшылап сынап ағып тұратын құрылғы. Тамшының диаметрі 0, 4 - 0, 7 мм, ал бетінің ауданы 2- 6 мм. кв. Сынап электродында тамшы үзілген сайын оның беті жаңарып, яғни қасиеттері бірдей иондардың разрядталуына жағдай жасалады. Сонымен қатар, тамшы бетінің ауданының мардымсыз болуы электрод яғни, катодтың поляризациялануын анодқа қарағанда бірнеше есе арттырады.
Ал, қосымша электрод (анод) қызметін катод бетінің ауданына қарағанда аудан беті жүз еседей үлкен, арнаулы ыдыстағы сынап (каломель, хлоркүміс) атқарады (электрототығатын заттарды анықтауда) және бұл іс жүзінде поляризацияға ұшырамайды. Полярографиялық ыдыс арқылы өтетін ток күші өте аз және бұл ыдыстың кедергісі мардымсыз болғандықтан мұны жоюға кететін кернеу шамасы да өте аз болады

Сонымен ток күшінің өзгеруіне байланысты ыдыстағы кернеудің артуы немесе кемуі тек катодтық потенциалдың өзгеруіне байланысты яғни, φ+=const, φ-=U. Демек, электродтарға берілетін кернеу толығымен катод потенциалын өзгертуге жұмсалады Электролиттік ұяшықтағы электродқа түсірген кернеу катод пен анодтагы поляризациялануды тудырып, токтың электролит арқылы өтуіне жүмсалады:
Е = Еа - Ек + I R.
мұндағы Еа мен Ек - анод пен катодтың потенциалдары, R - электролиттік ұяшықтың кедергісі, I - одан өткен ток күші. Егер ерітіндіде бейтарапты электролит болса, онда кедергі шамасы өте кіші болып, оның ток күшіне кебейтіндісін ескермеуге болады

Полярографиялық әдіс өте сезімтал болып келеді яғни зерттелетін заттың өте аз мөлшерін (10-3 - 10-11) анықтауға мүмкіндік береді. Сондай-ақ полярографиялық әдіспен қосылыстарды бір-бірінен бөлмей-ақ, бір мезгілде бірнеше заттарды анықтауға болады. Анықтауға кететін уақыт - біренше (10) минут.
Қондырғының жұмыс істеу байыбын айтпас бұрын, оның құрылысмен танысайық. Полярографиялық талдау арнайы полярографтарда орындалады.
Полярографиялық ұяшық шыны ыдыстан тұрады, оған анықталатын зат ерітілген электролит (фон ерітіндісі) құйылады және осы ерітіндіге тамшылауыш сынап электроды резина капилляр арқылы тамшылайды.
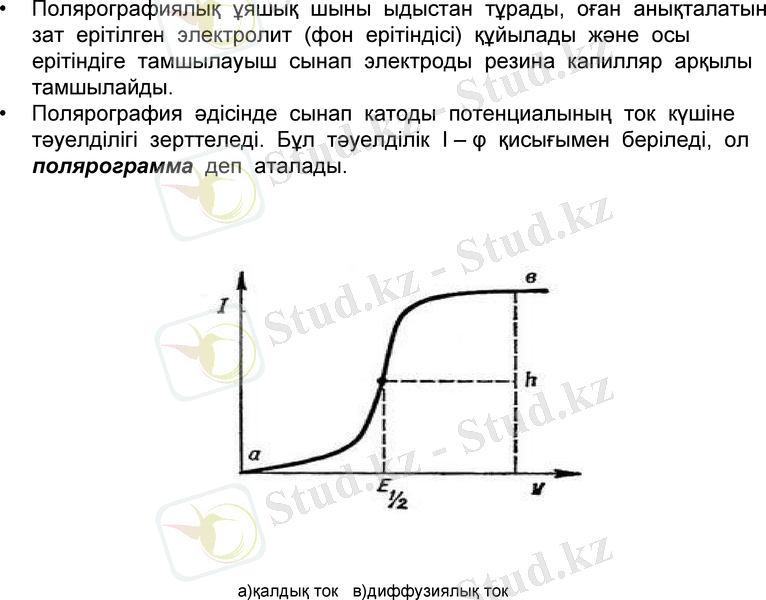
Полярография әдісінде сынап катоды потенциалының ток күшіне тәуелділігі зерттеледі. Бұл тәуелділік I - φ қисығымен беріледі, ол полярограмма деп аталады.
а) қалдық ток в) диффузиялық ток

Толқынның ортасына сәйкес келетін потенциалды (Е1/2) - жартыай толқын потенциалы деп атайды, ол анықталатын зат табиғатына байланысты, сондықтан сапалық анализде қолданылады, ал толқын биіктігі оның концентрациясына тәуелді. Сондықтан полярография аналитикалық химияда сапалық және сандық анализде қолданылады. Полярография әдісінде сандық анализ жасау үшін Илькович теңдеуі қолданылады.
D-диффузиялық коэффициент, m - капиллярдан 1 секундта ағатын сынап массасы, г;
τ тамшы периоды; С0 - концентрациясы; m2/3 τ1/6 - капилляр сипаттамасы; m, τ - капилляр диаметріне байланысты: Id = kC0 Катодта жүретін процесс: Men+ + ne Me (сынапта еру, амальгама) .
Анодта: Hg - 2e = Hg2+ түзілген сынап ионы ерітіндідегі CI--мен Hg2CI2 түзеді. Егер ерітіндіде бірнеше элемент катиондары болса, полярограммада сонша толқын болуы мүмкін
Imax = Id =605nC0D1/2m2/3τ1/6

Полярограммаларды түсіру үшін, яғни шекті диффузиялық токқа электр өрісіндегі иондардың көшіп- қону әсерін жою үшін зерттелетін ерітіндіге бейтарап электролит енгізеді. Бейтарап электролит иондары электрод бетінде тотығу- тотықсыздану өзгерісіне ұшырамайды және бұлар полярографиялық фон деп аталады. Полярографиялық фон ерітіндісі ретінде сілтілік метал тұздарының (KCL, KNO3, K2SO4) ерітіндісін алуға болады. Полярографиялық фон ерітінділерінің концентрациясы анықталатын затқа қарағанда 50-100 еседей артық болуы шарт. Осы полярографиялық фон ерітіндісі әсерінен жүйе кедергісі кеміп иондардың көшуі баяулайды. Электролизге ұшырайтын зат иондарының тасымалдануы диффузия әсерінен жүзеге асады.
Полярограмма қисығын тұрғызбас бұрын зерттелетін зат құрамындағы оттекті жою үшін, оған азот немесе басқа да инертті газдарды үрлеу қажет.
Зерттелетін затты ұяшыққа орналастырады. Полярографиялық ұяшықтың температурасы 0, 50С болуы қажет. Ондағы оттегіні жою үшін оған 10-15 минут бойы азот немесе сутек жібереді. Содан соң тамшылауыш сынап электроды ерітіндіге тама бастайды. Сынап тамшысының түсу жылдамдығын қадағалап, белгілі потенциал аймағында полярограмманы түсіре бастайды. Сосын, дәл осындай тәртіппен стандартты үлгінің полярограммасын түсіреді.
Егер Сыртқы кернеуді біртіндеп өсіретін болсақ, онда барлық ток күші электродтың зарядталуына жұмсалады және тізбектегі ток шамасы аз мөлшерде болады яғни, ол электрохимиялық реакцияның жоқ екендігін көрсетеді. Бұл қалдық ток деп аталынады. Кернеуді одан әрі ұлғайтқанда ерітіндіде тотықсыздану жүре бастайды да токтың мәні өседі. Бұл токты Фарадей тогы деп атайды. Әрі қарай кернеуді жоғарылатқанда тотықсызданатын иондардың концентрациясы катод беткейінде нөлге дейін түседі ал, диффузия жылдамдығы катодқа дейінгі аймақта максимальді болады және ток күші өзгерісі байқалмайды. Бұл шекті ток деп аталады. Бұдан соң электродқа қарай ерітіндіден иондардың диффузиялануы басталады. Бұл кездегі токты диффузия тогы деп атайды.

Амперметрлік титрлеу
Амперметрлік титрлеу - вольтамперметрия әдістерінін бір түрі. Мұнда титрлеудін соңғы нүктесін табу титрлеу барысындағы диффузиялық шекті ток шамасының өзгерісін анықтауға негізделген. Я. Гейровский 1927 жылы диффузиялық шекті ток (ДШТ) пен деполяризатор концентрациясының арасындағы тура пропорционал тәуелділікті тапты. Ол алғашында титранттың әрбір мөлшерін қосқаннан кейінгі полярограмманы реттілікпен алып, зерттейді. Майер (1936) ДШ токқа сәйкес болатын тұракты потенциалды тамшылатқыш электродқа бергенде, гальванометрдегі ауытқу деполяризатор концентрациясына тура пропорционал екендігін көрсетті. Соңғы кезде амперметрлік титрлеу аппаратурасы едәуір жеңілдетілді. Қазір амперметрлік титрлеуде полярограмманың қажеті жоқ, талдау қатты электродты пайдалану арқылы жүргізілед
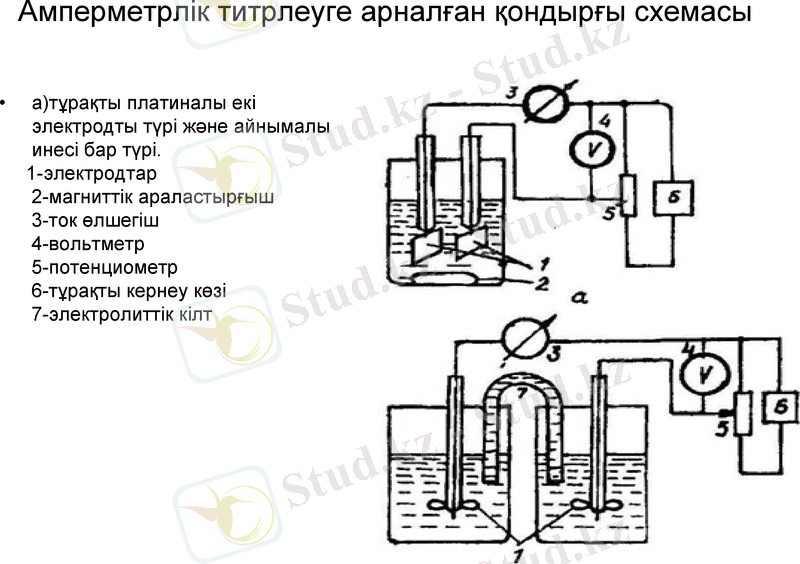
Амперметрлік титрлеуге арналған қондырғы схемасы
а) тұрақты платиналы екі электродты түрі және айнымалы инесі бар түрі.
1-электродтар
2-магниттік араластырғыш
3-ток өлшегіш
4-вольтметр
5-потенциометр
6-тұрақты кернеу көзі
7-электролиттік кілт
Ампермертлік титрлеу әдісі
Бір индикаторлық электроды бар
амперметрлік титрлеу әдісі
Екі индикаторлық электроды бар
амперметрлік титрлеу әдісі
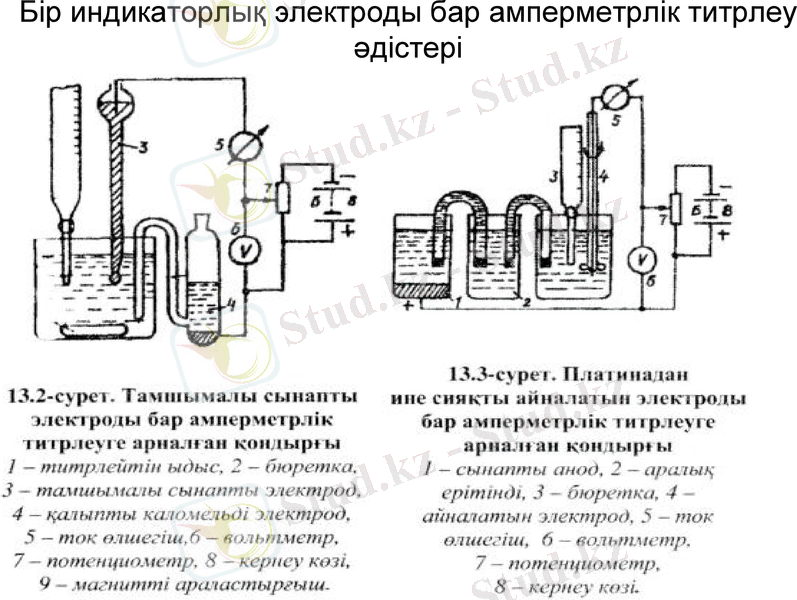
Бір индикаторлық электроды бар амперметрлік титрлеу әдістері

Мұндай қондырғының схемасы 13. 2. және ІЗ. З. -суреттерде көрсетілген. Бұл - кәдімгі тұрақты токтың полярографы. Мұның құрамында индикаторлық электрод, салыстыру электроды, индикаторлық электродтың потенциалын реттейтін реахорды бар ток көзі, кернеуді өлшейтін милливольтметр және титрлеу барысында ток шамасын өлшеуге арналған гальванометр бар. Индикаторлық электрод ретінде не тамшыланатын сынапты (13. 2-сурет), не айналатын платина электродын (13. 3-сурет) пайдаланады. Салыстыру электроды ретінде: мысалы, каломельді электрод (13. 2-сурет) немесе ыдыс түбіндегі сынап (13. 3-сурет) пайдаланылады. Титрлеу кезінде жүретін химиялық реакция типіне және электрлік активті заттың табиғаты мен қолданатын орнына қарай (индикаторлық электродтың потенциалын таңдап алғанда) таңдалатын зат, титрант, реакция өнімі немесе индикатор, амперметрлік титрлеу қисықтарының пішіні - бәрі де өзгереді. Жалпы түрдегі химиялық реакция теңдеуін мына түрде қарастырайық:

A + В ->Пөнім (П - реакция өнімі) (13. 1. )
Erep А электрлік активті зат болса. яғни ол индикаторлық электродта тотығу не тотықсыздану құбылысына ұшыраса, ондайда титрлеу қисықтарының түрі 13. 4, а-суреттегідей болып, келесі электрохимиялық реакция жүреді:
A - ё -> С, (13. 2. )
ал А заты тотықсызданса
A - е ->D, (13. 3. )
мұндайдатитрлеу қисықтарының түрі 13. 4, б-суреттегідей болады. Шекті токтың шамасы мына теңдеу бойынша өрнектеледі;
iА = ± к [A]
мұндағы к - электрохимиялық реакция тұрактылығы. Эквиваленттік нүктесі - (э. н. ) титрлеу қисыктарының бастапқы және соңғы нүктелеріне сәйкес жүргізілген екі түзудің қиылысуы ретінде анықталынады. Бұл түзудің бірі э. н. -гe дейінгі, екіншісі одан кейінгі титрлеуді сипаттайды және олар үзікті сызықпен көрсетілген. Мұндай э. н. дәлдігі қиылысатын екі түзу немесе олардың түзу бөлігінен жүргізілген жанама арасындагы бұрышқа (13. 4-сурет) тәуелді. Әдетте, тұнбаның нашар еритіндігіне, қосылыстың тұрақсыздығына қарай титрлеу қисықтарының арасында айқын бұрыш байқалмайды, сондықтан мұндайда сызбалық әдісті пайдаланады. Жоғарыдағы (13. 3. ) реакцияға мысал ретінде мынаны қарастырамыз:
SO42- + Pb2+ PbS04 ↓ (13. 4)
Мұндағы электрлік белсенді зат қорғасын ионы, яғни жоғарыдағы тотығумен қатар электродта қорғасын иондарының тотықсыздану реакциясы да жүреді:
Pb2+ + 2e -> Pb (13. 5. )
Бұл реакция индикаторлық болып табылады, өйткені ДШ ток талданатын ерігіндіде кездесетін корғасын иондарының концентрациясына тәуелді. Ұяшық өтетін ток шамасының аз болуы салдарынан, титрлеу мерзімінің өте қысқа болуынан, индикаторлық реакцияға жұмсалатын иондармен анықталатын кателік тым аз, тіпті оны ескермеуге де болады.
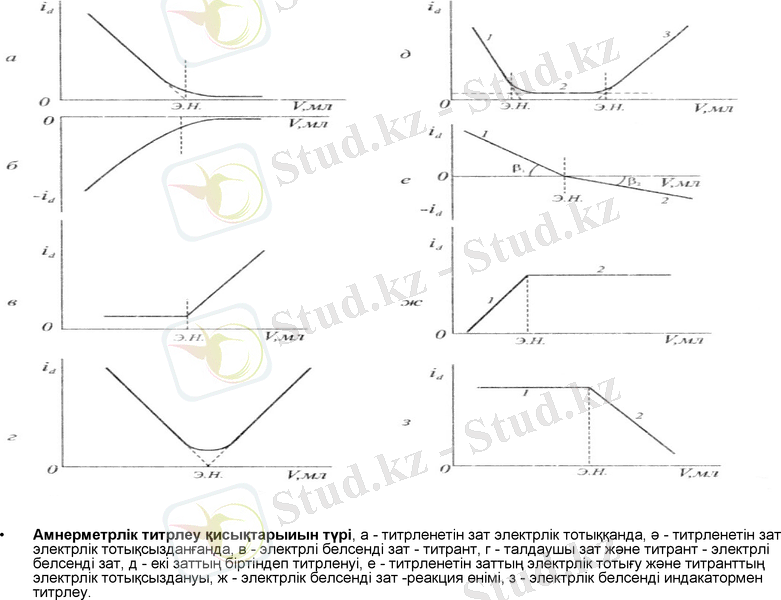
Амнерметрлік титрлеу қисықтарыиын түрі, a - титрленетін зат электрлік тотыққанда, ә - титрленетін зат электрлік тотықсызданғанда, в - электрлі белсенді зат - титрант, г - талдаушы зат және титрант - электрлі белсенді зат, д - екі заттың біртіндеп титрленуі, е - титрленетін заттың электрлік тотығу және титранттың электрлік тотықсыздануы, ж - электрлік белсенді зат -реакция өнімі, з - электрлік белсенді индакатормен титрлеу.

Екі индикаторлық электродпен амперметрлік титрлеу әдістері.
Бұл әдісті алғаш Саломон (1897) ток тоқтап қалғанға дейін күміс электродын пайдаланып, титрлеу арқылы күміс және басқа да металдарды сандық тұрғыдан анықтау үшін қолданады.
Бертін келе Нернст пен Мерриам (1905) ине сияқты палладий электродтарын пайдаланып, қышқылдық-негізді титрлеуді жүргізді, атап айтқанда, калий нитратының ерітіндісіндегі қышқылдың шамалы мөлшерін сілтімен титрледі.
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz