Азоттың қосылыстары және аммиак: сабақ жоспары



Қостанай облысы Амангелді ауданы Ә. Боранбаев атындағы жалпы білім беретін орта мектебінің химия пәнінің мұғалімі Ахметова Таттигуль

Химия
9сынып
24. 11. 2014 жыл

Үй тапсырмасын сұрау “Күкірт” тобына: 1. Күкірт қышқылы туралы не білесіздер? 2. Күкірт қышқылының формуласы 3. Күкірт қышқылының қолданылуы. «Азот» тобына: 1. Күкірт қышқылының құрылымдық формуласы 2. Күкірт қышқылының физикалық қасиеті 3. Су мен күкірт қышқылын қалай араластырады

Азоттың қосылыстары. Аммиак.

Мақсаты:
1) Білімділік. Азоттың оттекті қосылыстарына сипаттама беру, б
білім негіздерін қалыптастыру. Аммиак
молекуласының электрондық және кеңістіктік
құрлысымен танысу, соған орай аммиакқа тән
қасиеттерін түсініп білу.
2) Дамытушылық: Оқушылардың шығармашылық қабілетінің
шыңдалуына мүмкіндік беру және оны
дамыту.
3) Тәрбиелік: Оқушыларды бірлікке, жолдастыққа, еңбекті
сүюге тәрбиелеу.
Сабақтың көрнекілігі: Интерактивті тақта,
Сабақтың түрі: Аралас сабақ
Сабақтың барысы:
І. Ұйымдастыру бөлімі: амандасу, түгендеу

.
Жоспар.
І. Оксидтердің түрлері.
2. Құрылымдық формуласы.
3. Физикалық қасиеттері.
4. Алынуы.
5. Химиялық қасиеттері.
6. Қолданылуы.
7. Аммиак
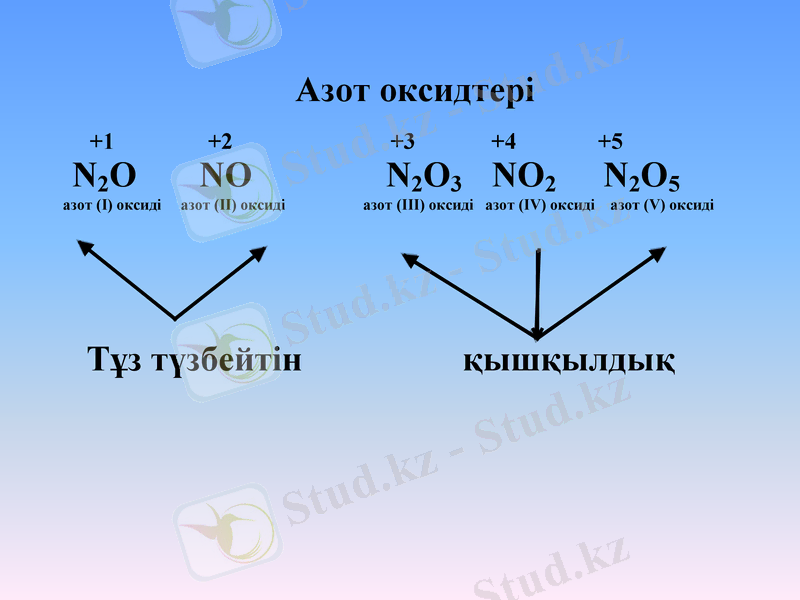
Азот оксидтері
+1 +2 +3 +4 +5
N2O NO N2O3 NO2 N2O5
азот (І) оксиді азот (ІІ) оксиді азот (ІІІ) оксиді азот (ІV) оксиді азот (V) оксиді
Тұз түзбейтін қышқылдық

NO
физикалық
қасиеттері
түссіз
Қиын
сығылады
-151, 8
сығылады
-163, 7
қатаяды
Суда
нашар
ериді
Ауада
тотығады
газ

NO Алынуы:
Tабиғатта найзағай отында мына реакция жүреді:

NO Азот (ІІ) оксиді
Алыну жолдары:
1. Табиғатта, найзағай ойнағанда
t
N2 + O2 = 2NO↑ - Q
2. Өндірісте кt
4NH3 + 5O2 = 4NO↑ + 6H2O
3. Лабораторияда
3Cu + 8HNO3 = 3Cu(NO3) 2 + 2NO↑ + 4H2O
(сұйытылған)

Азот(II) оксидінің химиялық қасиеті:
Тотығуы:
2NO + O2 = 2NO2
N+2 -2e → N+4 2 тотықсыздандырғыш
4
O20 +4e →2O-2 1 тотықтырғыш
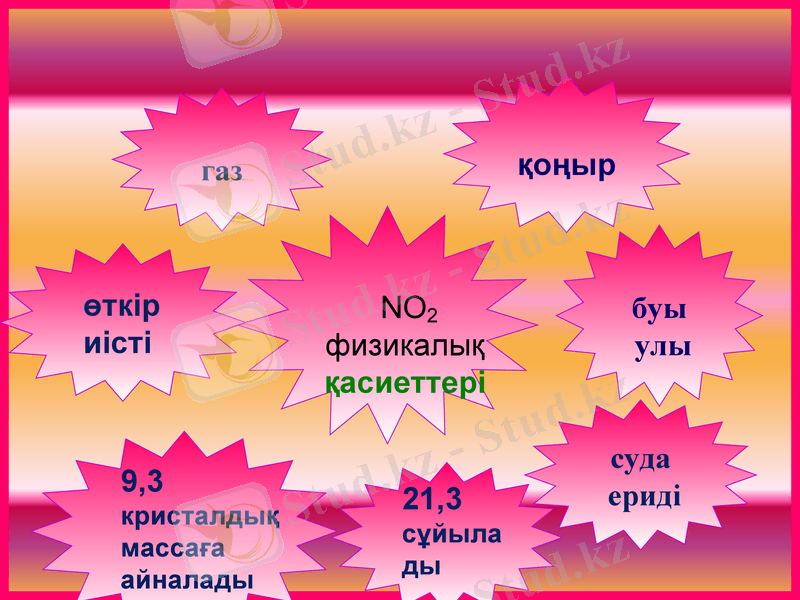
NO2
физикалық
қасиеттері
қоңыр
буы
улы
газ
21, 3
сұйылады
9, 3 кристалдық
массаға
айналады
өткір иісті
суда
ериді

NO2 Азот (IV) оксиді
Физикалық қасиеті: қоңыр түсті, өткір иісті, улы газ, суда ериді
Tқайнау = 21°C,
Тбалқу= -11, 2°C.
Алыну жолдары:
1) 2NO + O2 = NO2
2) Cu + 4HNO3 = Cu(NO3) 2 + 2NO2 + 2H2O
(конц. ) .

Химиялық қасиеттері:
Суда еруі
4NO2 +2H2O + O2 = 4HNO3 + Q
N+4 -1e →N+5 4
4
O20 +4e →2O -2 1
немесе 2NO2 +H2O = HNO3 + HNO2
азот қыш. азотты қыш.

HNO3 + HCl 1:3 патша арағы деп аталады. Барлық нәрселерді Аu және pt-ны да ерітеді. Күшті тотықтырушы қасиетке ие.
Аu + HNO3 +3HCl =AuCl3 +NO +2H2O

“Бұл иісін бір иіскесең өмір бойы ұмытылмастай есіңде қалатын газ. Құтыны ашсаң болды өткір иісі бірден бөлменің ішін алып кетеді. Оның атауы мүсәтірдің ескі атауы “sal ammoniac” сөзінен шыққан. Оны Амон құдайына табынатын жерге жақын Ливиядан өндірген. ”
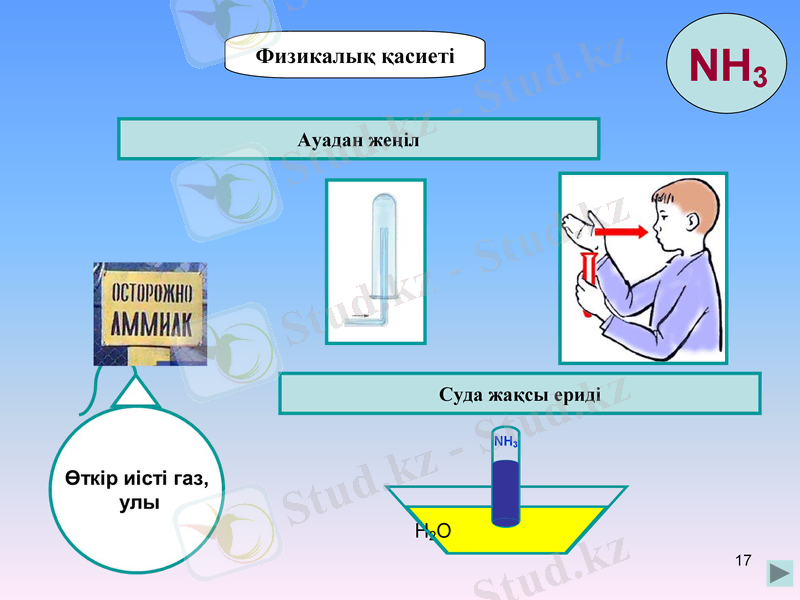
NH3
*
Физикалық қасиеті
Ауадан жеңіл
Суда жақсы ериді
H2O
NH3
*
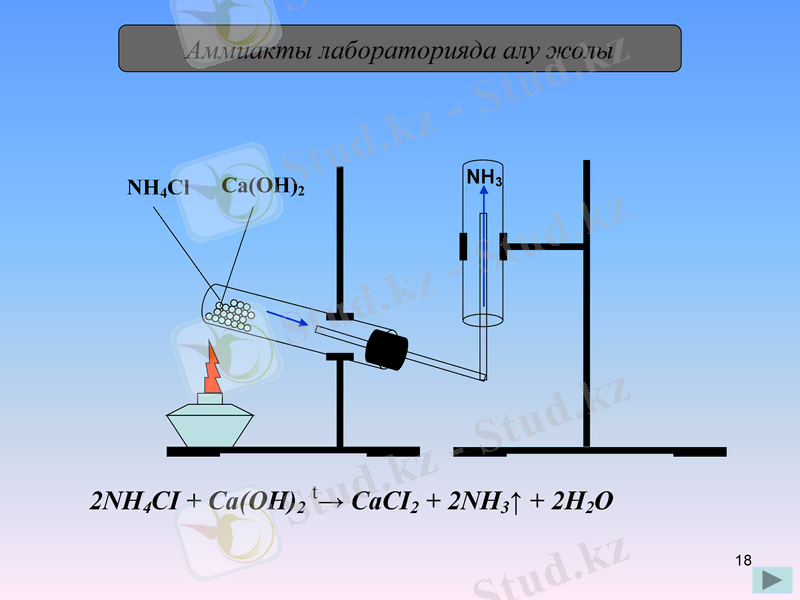
Аммиакты лабораторияда алу жолы
NH4Cl
Ca(OH) 2
NH3
2NH4СІ + Са(ОН) 2 t→ СаСІ2 + 2NH3↑ + 2Н2О
*
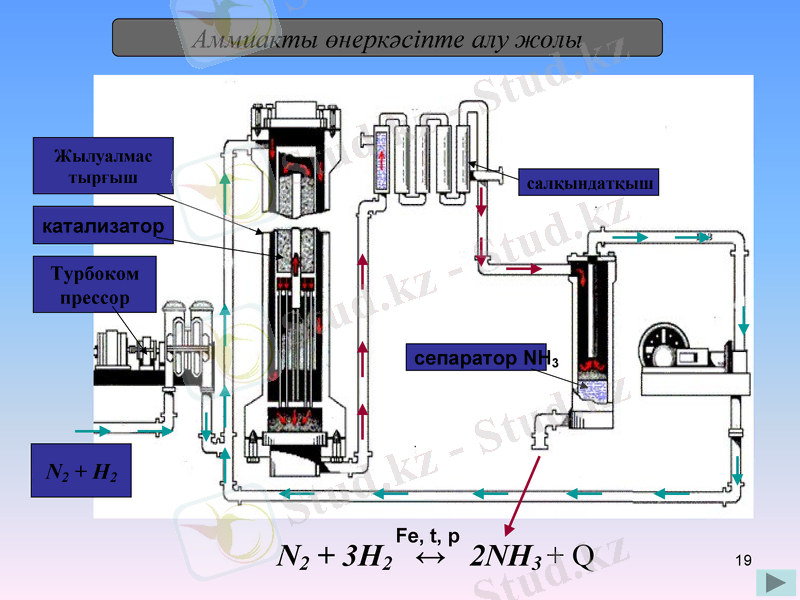
Аммиакты өнеркәсіпте алу жолы
N2 + H2
Турбоком
прессор
катализатор
Жылуалмас
тырғыш
салқындатқыш
сепаратор NH3

*
Аммиактың қолданылуы

NH3
Азот-Бейметалл пойызы

Тест жұмысы.
Азот атомында қанша s және p электроны бар?
а) 6s және 9p в) 4s және 3p с) 6s және 10p д) 4s және 4p
2. Нитридтердің құрамында азот неше валентті?
а) 1 в) 4 с) 3 д) 5
3. Азоттың ауадағы көлемдік үлесі қанша?
а) 21% в) 78% с) 75, 6% д) 77%
4. Азот 8 электрон қосып алатын сызбанұсқа?
а) N-3 → N+5 в) N+2 → N+5 с) N+5 → N+2 д) N+5 → N-3
5. Азот мына жай заттардың қайсысымен әрекеттеседі?
а) Cl2, Au в) Al, C, P с) F2, Ag, Au д) O2, H2, Mg
6. Азот қайсы қосылыстарында +5 және -3 тотығу дәрежесін көрсетеді?
а) NO2, PH в) NO2, NH3 с) N2O5, NH3 д) N2O5, PH3
7. Азоттың жоғарғы тотығу дәрежесі?
а) +5 в) +3 с) -3 д) 4

Үйге тапсырма
§ 17 Табиғаттағы азот айналымы.
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz