Электрохимия және электролиттер: электродтық процестер, өткізгіштік пен Дебай-Гюккель теориясы







Электрохимия электролиттер жөніндегі ілімді және электродтық процесстердің термодинамикасы мен кинетикасын қамтиды. Электрохимия екі ілімнен тұрады. Электродтық процесстер, электролит, электрод, гетерогенді фазалық шекарасындағы өтетін құбылыстар. Электрохимия өте жоғары сапалы таза заттар алу үшін, күрделі жаңа заттарды синтездеу үшін және қайсыбір бұйым бетін дәнекерлеу үшін қолданылады. Электрохимиялық процесстерді реагентсіз процесстер деп атайды.
Электролиттер дегеніміз - ерітіндіде қолданатын заттар. Ол электрохимиялық жүйеде ”ішкі тізбекте” электродтар арасындағы электр ағынын өтуін қамтамсыз етеді. Электролиттегі электр ағынның өзіндік ерекшеліктері болады.

Егер бірінші текті өткізгіште, яғни ол металл пластинка (электрод) электр ағынның теріс зарядталған бөлшегін электрондардың бағыттарының қозғалысымен сипатталады.
Екінші текті өткізгіште электролит ерітіндіде электр ағымы иондардың бағытының қозғалысымен анықталады. Бұл ағынға қарама - қарсы бағытталған теріс және оң зарядты иондар қатысады. Кез - келген электрохимиялық жүйеде сыртқы және ішкі тізбек болады. Электрохимиялық ток өткізу үшін сыртқы ток көзі қажет.
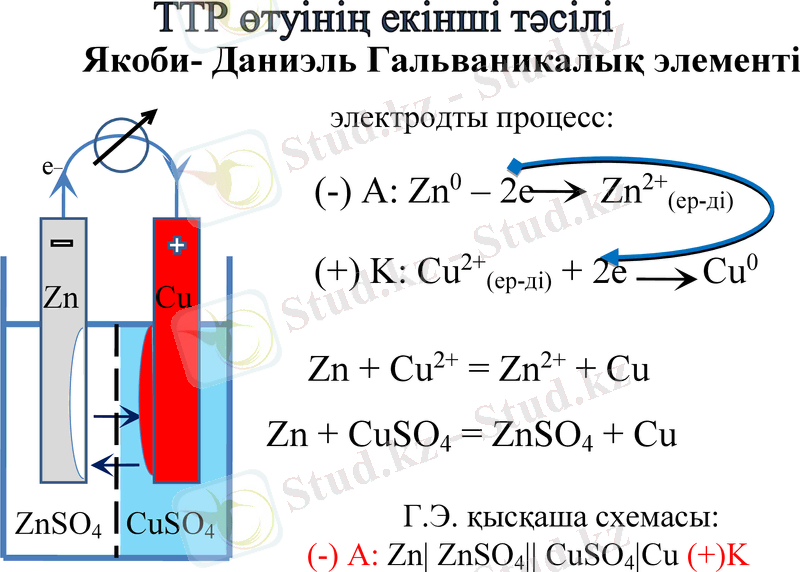
Якоби- Даниэль Гальваникалық элементі
Zn
Cu
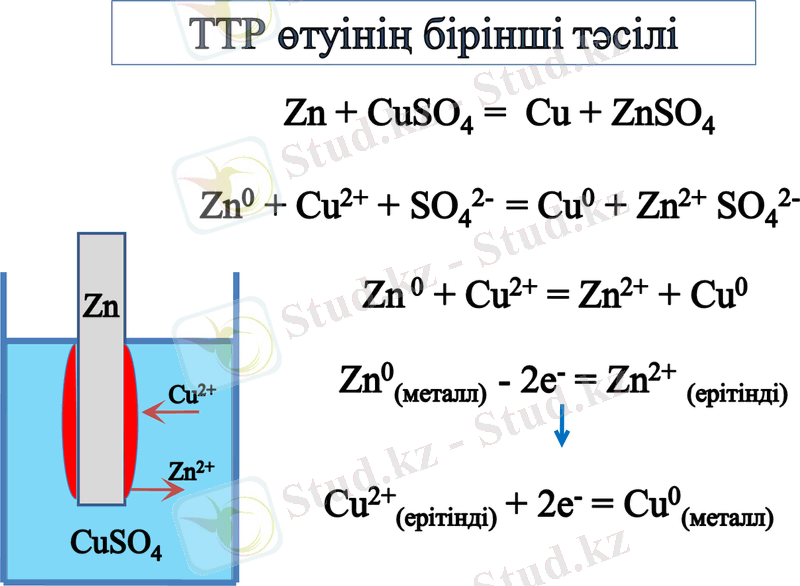
Zn + CuSO4 = ZnSO4 + Cu
электродты процесс:
Г. Э. қысқаша схемасы:
(-) А: Zn ZnSO4 CuSO4Cu (+) K
Zn + Cu2+ = Zn2+ + Cu
e_

Электрохимиялық реакция сыртқы, ішкі тізбектің шекарасындығы тетікшелер электродтар деп аталады. Біреуі электрон ауыстырады, біреуі ион алмастырады. Электрохимиялық реакциялар тотығу - тотықсыздану реакциясына негізделіп жүреді. Ол бірінші және екінші текті өткізгіштің шекарасында электродтар бетінде өтеді
Осы шекара арқылы ауысқан ток мөлшерімен электродатр бетінде бөлінген заттың массаларының арасындағы байланысты Фарадей заңымен анықтаймыз.


Эквиваленттік электрөткізгіштік (λV) деп әрқайсысы 1 см2 электродтардың арақашықтығы 1 см болғанда, сол аралықтағы көлемі (V см3) ерітіндінің электрөткізгіштігін айтады.
λV =æ•1000•V = æ 1000/C
Эквиваленттік электрөткізгіштің сұйылтуға байланысты өзгеруі:

Тасымалдау санын тәжірибе жүзінде электролизёрда анықтайды.
Электролизёрда:
Кулонометрде:

Дебай-Гюккельдің бес шарты:
Ерітіндідегі иондар математикалық нүктелер, олардың радиустары мен диаметрлері ескерілмейді.
Ерітіндідегі иондар тек электростатикалық Кулон заңына бағынатын бөлшектер болуы керек.
Еріткіш пен ерітіндінің диэлектрлік өтімділігі бірдей байланысқан дейді.
Иондардың тартылуы мен реттелуі Больцман статистикасына бағынсын.
Кулон заңына бағынатын ион мен оның атмосферасы электростатикалық әсерлесу деп қабылдансын.

Өзін шектеу заңы, активтік коэффициентін анықтаған:
А - еріткіш табиғатына сәйкес коэффициент;
I - иондық күш
- аналитикада

Хюккель Эрих Арманд Артур Йозеф
ДЕБАЙ (Debye), Петер Джозеф Уильям

- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz