Атомдық және молекулалық массалар, эквиваленттік қатынастар және зат құрамын есептеу әдістері



Атомдық және молекулалық массаларды анықтау тәсілдері. Заттық мольдік массасы. Эквивалентті және эквивалент арасындағы қатынас. Газдардың заттық мольдік массаларын анықтау
2 блок.

“Атом” грекше “бөлінбейтін” деген сөз. Атом - заттың химиялық жолмен бөлінбейтін ең ұсақ бөлшегі. Молекула - жай немесе күрделі заттардың құрамы мен химиялық қасиеттерін сақтайтын ең ұсақ бөлшегі.
“Барлық денелер өте ұсақ көзге көрінбейтін әрі бөлінбейтін, мәнгі қозғалыста болатын бөлшектер - атомдардан тұрады”- деген болжам айтты( 25000 жыл бұрын) Грек философы Демокрит.
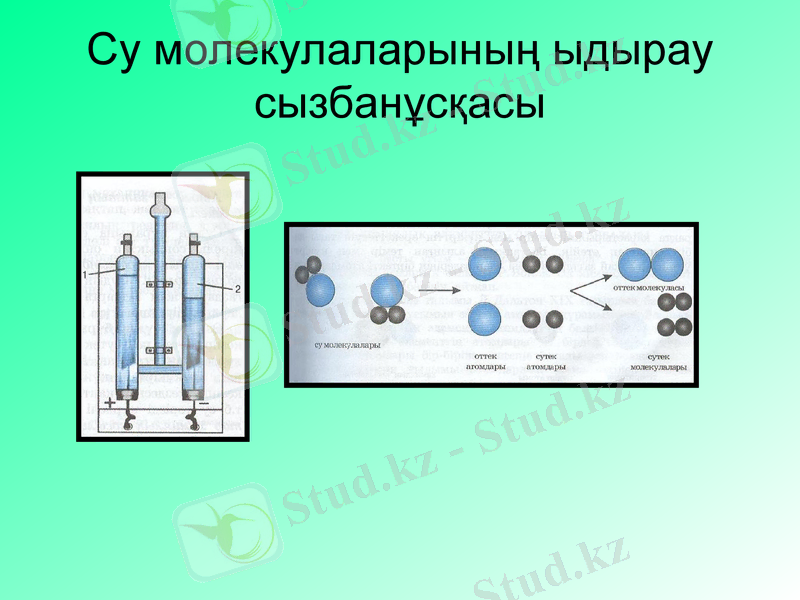
Су молекулаларының ыдырау сызбанұсқасы
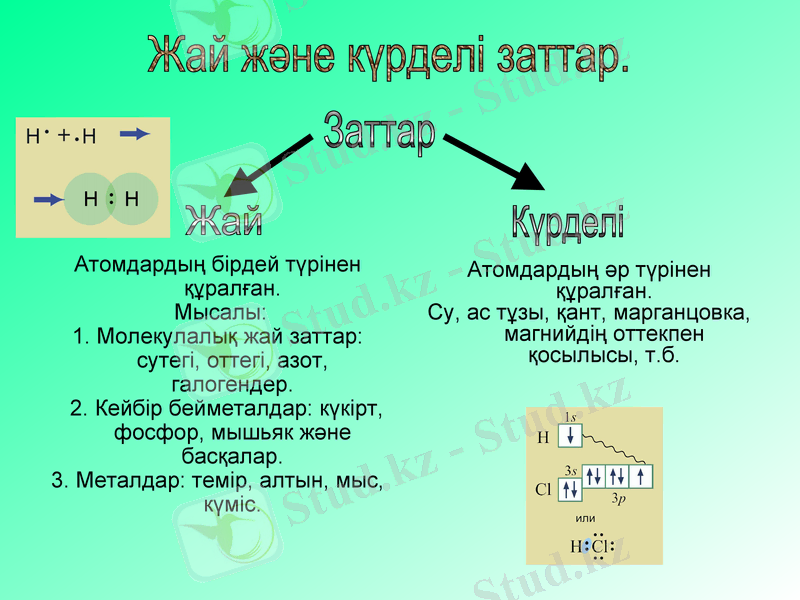
Атомдардың бірдей түрінен құралған.
Мысалы:
1. Молекулалық жай заттар: сутегі, оттегі, азот, галогендер.
2. Кейбір бейметалдар: күкірт, фосфор, мышьяк және басқалар.
3. Металдар: темір, алтын, мыс, күміс.
Атомдардың әр түрінен құралған.
Су, ас тұзы, қант, марганцовка, магнийдің оттекпен қосылысы, т. б.
Заттар
Жай
Күрделі
Жай және күрделі заттар.

Химиялық элементтер
Химиялық элемент- атомдардың белгілі бір түрі. Химиялық элемент ұғымын алғаш енгізген ағылшын ғалымы Р. Бойль.
ХІХ ғасырдың басында ағылшын ғалымы Д. Дальтон химиялық элементті атомдардың белгілі бір түрі деп санайды. Ол кезде тек қана 31 элемент белгілі болған. Кейінірек орыстың ұлы ғалымы Д. И. Менделеев химиялық элементтердің периодтық заңын ашқан кезде, олардың саны 63 -ке жетті. Бүгінде белгілі болып отырған - 110.
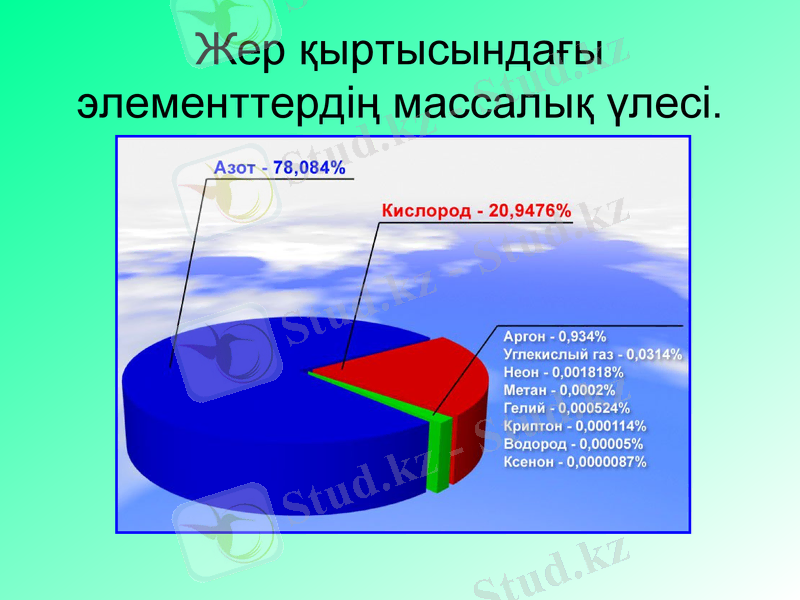
Жер қыртысындағы элементтердің массалық үлесі.
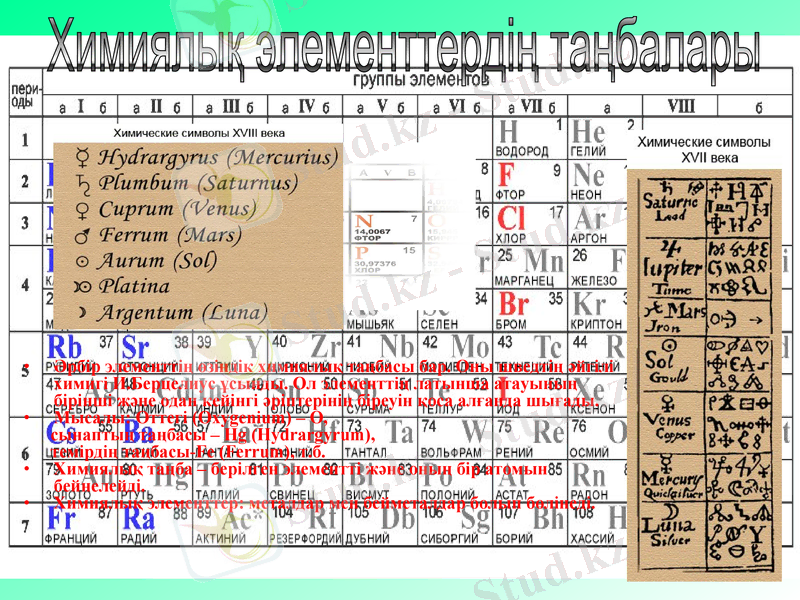
Әрбір элементтің өзіндік химиялық таңбасы бар. Оны шведтің әйгілі химигі И. Берцелиус ұсынды. Ол элементтің латынша атауының бірінші және одан кейінгі әріптерінің біреуін қоса алғанда шығады.
Мысалы: Оттегі (Оxygenium) - О,
сынаптың таңбасы - Hg (Hydrargyrum),
темірдің таңбасы-Fe (Ferrum), т. б.
Химиялық таңба - берілген элементті және оның бір атомын бейнелейді.
Химиялық элементтер: металдар мен бейметалдар болып бөлінеді.
Химиялық элементтердің таңбалары

Атомдық масса
Атомдар микробөлшектерге жатқанымен олардың әрбірінің өзіндік массасы бар.
Атомдардың массасы өте аз шама, макродүниедегі массаның өлшемі-граммен не кг өлшеуге болмайды. Ең жеңіл сутек элементі атомының массасы m(Н) ═0, 000 000 000 000 000 000 000 000 001663 кг-ға тең, 1, 67∙10 -24 г.
Табиғатта кездесетін ең ауыр элемент уран атомының массасы m(u) ═3, 95∙10 -22 г.
Атомдық массаны осылай өрнектеу қолайсыз болғандықтан арнайы өлшем бірлігі- (м. а. б. ) алынды.
Массаның атомдық бірлігіне көміртек атомы m(С) массасының 1/12 бөлігі алынады.
m(Н) ═1, 99∙10-26 кг ═1, 99∙10 23 г

Cалыстырмалы атомдық масса.
Химиялық элементтің салыстырмалы атомдық массасы деп берілген элементтің атомдық массасының көміртек атомы массасының ½ бөлігіне қатынасын айтады.
Салыстырмалы атомдық масса Аr деп белгіленеді. («r» индексі ағылшынның «rеlative» -қазақша “салыстырмалы”.
Мысалы:
Оттек атомының массасы 2, 66∙10-27кг немесе 16 м. а. б -ге тең, ол салыстырмалы атомдық массасы 16.
M(0) =2. 66∙10-27 кг=16м. а. б, Ar(o) =16.

Қорытындылау
1. Заттың құрамы мен қасиет сақтайтын кіші бөлшек-молекула.
2. Химиялық жолмен бөлінбейтін ең ұсақ бөлшек-атом.
3. Атомдардың белгілі бір түрі-химиялық элемент.
4. Салыстырмалы атомдық масса- берілген элементтің атомдық массасының 1/12 бөлігіне қатынасын айтады.

Салыстырмалық молекулалық масса
Заттың химиялық формуласы арқылы оның салыстырмалы молекулалық массасын есептеп шығарады. Ол үшін заттың құрамына кіретін элементтердің салыстырмалы атомдық массалалары пайдаланылады.
Заттың салыстырмалы молекулалық массасы, оның молекулалық массасының көміртек атомы массасының 1/12 бөлігіне қатысын көрсетеді.
Салыстырмалы молекулалық масса Мr (Н2О) ═(2∙1) +16═18
Мr (Н2SО4) ═(2∙1) +32+(4∙16) ═98

Зат құрамының тұрақтылық заңы
ХІХ ғасырдың басында француз ғалымы Ж. Пруст құрам тұрақтылық заңын ұсынды. Әрбір күрделі заттың алыну тәсіліне қарамастан құрамы тұрақты болады.
Неліктен заттардың құрамы тұрақты болады? Оттегі атомында екі жұптаспаған электроны бар, сондықтан оттек тек қана екі сутегімен байланыс түзе алады.
Су қандай жолмен алынбасын, құрамы тұрақты болады. Бір оттегі атомымен және екі сутегінен құралған.

Құрамы өзгермелі заттар.
Қазіргі химия ғылымының дамуы құрамы өзгермелі заттардың да болатындығын көрсетті.
Клод Лун Бертолле зат құрам тұрақтылығы заңы әмбебап емес деген болжам айтты.
100 жыл өткен соң орыс химигі Н. С. Курнаков құрамы өзгермелі қосылыстар бар екенін дәлелдеді.

- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz