Дюлонг-Пти ережесі мен газдарының парциалдық қысымы: термодинамика негіздері, идеал газ заңдары және есептік тапсырмалар



Химия пәнінен интерактивті online сабағы

Дюлонг - Пти ережесі
Газдардың парциал қысымы

Сабақтың мақсаты
білімділік: физикадан белгілі термодинамикалық параметрлер температура, қысым, көлем, меншікті жылу сыйымдылық ұғымдарын оқушыларға тереңдете түсіндіру, дененің жылу сыйымдылығы мен масса арасындағы тәуелділікті анықтау;
дамытушылық: өз беттерінше жұмыс істеуге, негізгі ойды қорытындылап, салыстыра білуді дамытуға дағдыландыру.
тәрбиелілік: өз бетімен еңбектену іскерліктерін арттыра отырып оқушылардың танымдық белсенділіктерімен ой өрісін дамытып, шығармашылыққа, іздемпаздыққа, тиянақтылыққа, ізгілікке тәрбиелеу.

Термодинамика - термодинамикалық тепе -теңдік күйдегі макроскопиялық жүйелердің жалпы қасиеттерін және бір күйден екінші бір күйге өту процесін зерттейді. Термодинамика тәжірибе нәтижесінде тағайындалған заңдарға сүйенеді.
Физика мен химияда термодинамикалық әдіс қолданылмайтын аймақ жоқ деуге болады. Молекулалық -кинетикалық теория мен термодинамика зерттеу әдістерімен ерекшелене отырып, бірін - бірі өзара толықтырып отырады.
Термодинамика

Термодинамикалық жүйе - өзара әсерлесуші, әрі өзара ғана емес басқа денелермен де (сыртқы ортамен) әсерлесуші және энергия алмасушы макроскопиялық денелердің жиынтығы.
Термодинамикалық әдістің негізі - термодинамикалық жүйенің күйін анықтау болып табылады. Жүйенің күйі термодинамикалық параметрлермен (күй параметрлері) беріледі. Термодинамикалық параметрлер (күй параметрлері) деп термодинамикалық жүйенің қасиеттерін сипаттайтын физикалық шамалардың жиынтығын айтады. Күй параметрлері ретінде температура, қысым және меншікті көлем қарастырылады.
Термодинамика

.
Идеал газдың күйін сипаттайтын заңдар
Бойль - Мариот заңы
Гей-Люссак заңы
Шарль заңы

Изотермиялық процесс
Изопроцестердің ішінен бірінші болып осы изотермиялық процесс зерттелді.
Ағылшын физигі Р. Бойль 1662 ж.
және оған тәуелсіз француз физигі Э. Мариотт тәжірибе жүзінде тұрақты температура кезінде газдың берілген массасы үшін оның
қысымының газ алып тұрған көлемге көбейтіндісі тұрақты шамаға тең болатынын тағайындады.
Бұл заң Бойль Мариотт заңы деп аталады.
pV=const
p 1V1 =p2V2
T = const, m = const.

Изотермиялық процесс
Тұрақты температурада заттың қасиетін сипаттайтын p және V шамаларының арасындағы тәуелділікті көрсететін қисық изотерма деп аталады.
Изотермалар гипербола болып
табылады, процесс кезінде
температура жоғары болса, графикте гиперболалар
да жоғары орналасады.

Изохоралық процесс
Бұл процесті француз физигі Ж. Шарль зерттеген. 1787 жылы
ол тәжірибе жүзінде тұрақты
көлемде берілген газ массасының
қысымы оның температурасына тура пропорционал болатынын тағайындады. Бұл заң Шарль заңы. Шарль өзінің заңын Гей Люссактан ерте ашты, бірақ кеш жариялады.

Француз физигі Гей Люссак 1802 жылы тәжірибе жүзінде тұрақты қысымда газдың берілген массасы көлемінің температураға сызықты тәуелді болатынын тағайындады, яғни
Изобаралық процесс

1801 ж. Дальтон заңы газ қоспасының қысымын және жеке компоненттердің жалпы қысымға беретін нақты «үлесін» анықтады.
Өмірде біз таза газды емес, газ қоспасын кездестіреміз. Мысалы, ауа азоттан, оттектен, көмірқышқыл газынан және басқа да көптеген газ қоспасынан тұрады.
Дальтон осындай газ қоспасының қысымын анықтауды мақсат етті.
Бұл үшін парциал (үлестік) қысым деген жаңа ұғымды енгізді.
Парциалдық қысым
1766-1844 жж
ағылшын физигі
және химигі
Джон ДАЛЬТОН (Dalton),

Парциал қысым деп газ қоспасының әрбір газы осы көлемді жалғыз өзі алатын кездегі қысымды атайды.
Дальтон газ қоспасының қысымы осы газ қоспаcына кіретін барлық газдардың парциал (үлестік) қысымдарының қосындысына тең болатынын тағайындады, яғни
p = p1 + p2 + ……. + pn.
P = PN2 + PO2 + PAr
P = 0, 78 атм + 0, 21атм+ 0, 01атм = 1атм

Газ қоспасында әрбір газдың парциал қысымы берілген қоспа құрамындағы молекула санына пропорционал болады. Осыған байланысты газ қоспасының парциал қысымы олардың концентрациясының өлшемі болып табылады.

Газ тәрізді заттар қатынасында жүретін
Қайтымды реакцияларда концентрация
мен қысым арасында байланыс болады.
Газ қоспасының жалпы қысымы әрбір
жеке газдың парциал қысымының
жиынтық қосындысы болып табылады.
Парциал қысым ұғымы арқылы газ
қоспасының құрамына еніп отырған газдың қысымы, оның осы берілген температурада
алатын көлемі газ қоспасының алатын көлеміне тең екендігі анықталды.

Газ қоспалары мен парциал қысым
Көптеген газ тәрізді заттар таза түрінде емес, қоспа түрінде болады.
Мысалы, құрғақ ауа құрамында азот, оттек, аргон, көміртек диоксиді, және т. б. қоспалар кездеседі. Идеал газда молекулалар бір - бірімен қарым- қатынасқа түспегендіктен, идеал газ қоспасындағы компоненттер басқаларына тәуелді болады.

Газ қоспалары мен парциал қысым
Мысалы, ауадағы азот молекуласы белгілі бір қысымда - 78%, жалпы қысымда - басқа газ қоспаларының болуына тәуелді болады. Соған ұқсас ауадағы оттегі молекуласы белгілі бір қысымда - 21% жалпы қысымда басқа газ қоспаларының болуына тәуелді болады. Газ қоспасындағы кез келген жеке компоненттің қысымын сол қысымның парциалдық қысымы деп аталып және ол әр газ компонентінен тәуелсіз әрекет етеді де, осы арқылы идеал газ заңдары анықталады.


1 мысал
Теңіз астына сүңгігіш аквалангист (298 К) температурада 12, 5 л гелиокс қоспасымен тыныс алады. Гелиокс қоспасының құрамында 24, 2 г гелий және 4, 32 г оттегі бар.
Қоспа құрамындағы әр компоненттің зат мөлшерін және парциалдық қысымын, жалпы қысымды табыңыз.

Бер:
mHe = 24, 2 г
mO2 = 4, 32г
V= 12, 5л
T= 298 K
т/к: Хне, Xo2 -?
PHe, P o2, Pж-?
mHe→nHe mO2→nO2

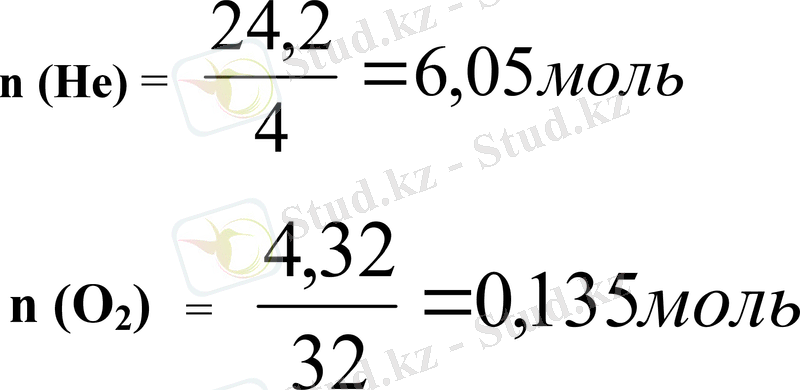
n (He) =
n (O2)
=
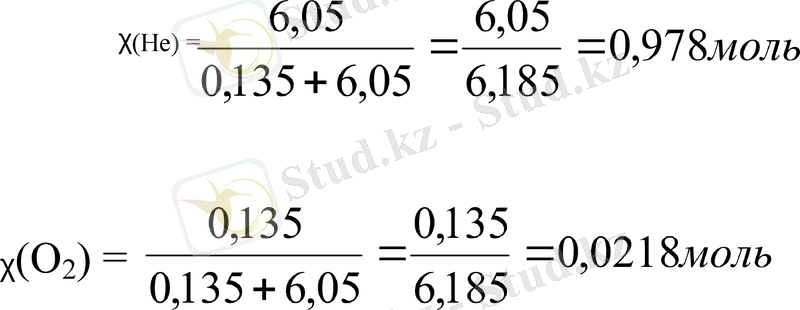
ᵪ(He) =
ᵪ(O2) =

Pжалпы =
P He = nHe * Pжалпы = 0, 97817 * 12, 099 атм = 11, 8 атм
РО2 = n O2 * Pжалпы = 0, 021877 * 12, 099атм = 0, 264 атм

Парижде медицинадан дәріс алып, сонан соң Клод Бертолленің Политехникалық мектебінің лабораториясында химик болып жұмыс атқарды.
1811 жылы - Париждің Ветеринар мектебінде химия профессоры болды,
1820 жылы - Политехникалық мектептің физика профессоры болды.
Пьер Луи Дюлонг
1785 - 1838 жж.
француз химигі
және физигі
Пьер Луи Дюлонг Францияның Руан қаласында туылды.

Негізгі ғылыми зерттеу жұмыстары:
Жалпы химия және бейорганикалық химия саласына арналды. 1811 жылы жеңіл жарылғыш заттармен жұмыс жүргізе отырып, ол ең бірінші рет азот хлоридін алды, сол тәжірибеде ол көзі мен үш саусағынан айрылды. Қымыздық қышқылының қасиеттерін зерттеді, фосфорлылау қышқылды ең бірінші рет анықтады. 1830 жылы Бойль-Мариот заңын эксперимент жүзінде тексеру үшін 27 атм қысымда су калориметрін құрастырды.

Алексис Терез Пти Францияда Везуле қаласында туылды.
1809 жылы Парижде политехникалық мектепті бітіріп, 1810 ж Париж лицейінде оқытушы болды. 1815 жылдан Политехникалық мектептің
профессоры қызметін атқарды.
Ғылыми еңбектерін жылу және молекулалық физикаға арнады.

Негізгі ғылыми зерттеу жұмыстары:
П. Дюлонгпен біріге отыра бос денені суытқан уақыттағы өзгерістерді зерттеді, (1818) қыздырылған денелердің суыну жылдамдығының формуласын ашты және тәжірибелерге қажет катетометр құралын ойлап тапты. Газдардың жылу өткізгіштік әдісін зерттеді және қатты денелердің меншікті жылу сыйымдылығын, жылулық ұлғаюдың коэффициенттерін анықтау әдiстерiн ұсынды.
Катетометр - вертикаль бағытта
орналасқан екі нүктенің арасындағы арақышықтықты дәл өлшеу үшін қолданылады.

Дюлонг- Пти ережесі
Дюлонгтің ең басты ғылыми жетістігі 1819 жылы Пти екеуінің бірігіп анықтаған қатты дененің жылу сыйымдылық заңдылығы болып табылады. Осы заңдылыққа сәйкес қатты жай заттардың меншікті жылу сыйымдылығының туындысы түзілетін элементтердің атомдық массаларының сай келіп (жаңа өлшем бойынша орта есеппен 26 Дж·г−1·К−1) тең. Қазіргі уақытта бұл заңдылық Дюлонг - Пти заңдылығы атпен белгілі болып ауыр элементтердің атомдық массаларының мәніне жақын болды.

Бөлме температурасында қатты заттардың молярлық жылу сыйымдылығы 3R жақын болады.
R- универсал газ тұрақтысы
Қатты заттың кристалл торлары атомдардан тұрады, оның әрқайсысы үш бағытта гармониялық тербілісте болады, тордың құрылысын береді, бір - бірінен қатысынсыз әртүрлі бағытта тербеледі.
Дюлонг- Пти ережесі
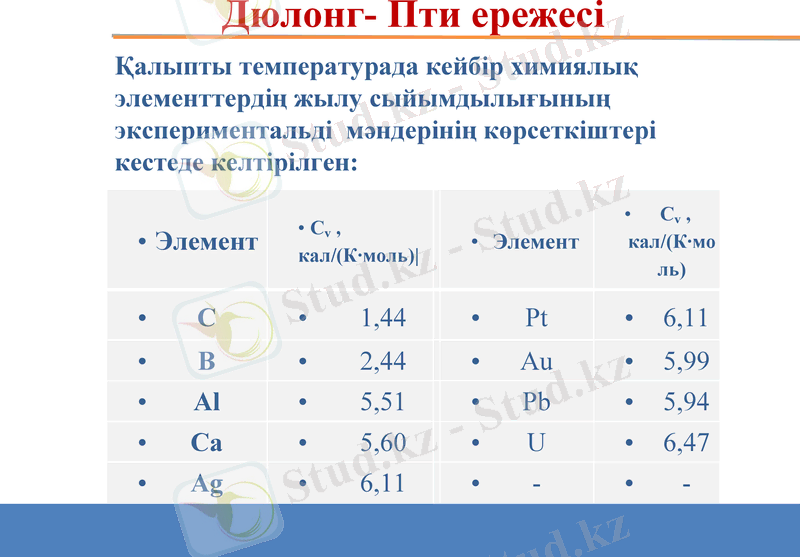
Қалыпты температурада кейбір химиялық элементтердің жылу сыйымдылығының экспериментальді мәндерінің көрсеткіштері кестеде келтірілген:
Элемент
Cv, кал/(К·моль)
Элемент
Cv, кал/(К·моль)
C
1, 44
Pt
6, 11
B
2, 44
Au
5, 99
Al
5, 51
Pb
5, 94
Ca
5, 60
U
6, 47
Ag
6, 11
-
-
Дюлонг- Пти ережесі

Қатты элементар бөлшектердің атомдық массасының туындысының меншікті жылу сыйымдылыққа қатынасы тұрақты өлшем болып табылады. Бұл заңдылық 13 қатты элементар денелер үшін расталды. Бірақ ол барлық химиктердің назарын аударды. Я. Берцелиус теориялық химияның жетістігі деп санап, осы заңдылық негізінде өзінің атомдық массалар кестесіне түзетулер енгізді. Сондықтан Дюлонг пен Пти ережесі химиялық атомистикада ең маңызды заңдылық болып қалды.
Дюлонг- Пти ережесі

П. Дюлонг және А. Пти (1819 ) ережесі бойынша элементтердің атомдық массаларын анықтау (молярлы массасын анықтау) .
Металдардың жылу сыйымдылықтарын зерттеу мақсатында Дюлонг және Пти төмендегідей ереже тұжырымдады:
Қатты күйіндегі жай заттардың меншікті жылу сыйымдылықтарының атомдық массаға (молярлы масса) көбейтіндісі тұрақты 26, 0 кДж/ (моль*К) шамасына тең.
Дюлонг- Пти ережесі

Көп заттардың меншікті жылу сыйымдылықтары тәжірибе жүзінде анықталады. Мұнан соң, сол заттың меншікті жылу сыйымдылығын 26, 0 санына бөлу арқылы жуықтап молярлы массасын есептейді. Молярлы массаны сол заттың эквивалентінің молярлы массасына бөлу арқылы валенттілікті анықтайды. Шыққан сан бөлшек сан болса дөңгелектеу ережесіне сәйкес оны бүтінге айналдырады, өйткені валенттілік бүтін санмен анықталады.
Дюлонг- Пти ережесі


Еске түсіре кететін жай, жекеленген атом, молекулалармен
өлшеулер жүргізу мүмкін болмағандықтан біз тәжірибе жүзінде ылғи макроскопиялық деңгейде, яғни заттың белгілі бір мөлшерімен жұмыс істейміз. Осы себепті ылғи
да молярлы шамалар анықталады.
Ал, өлшем бірлігін ескермегенде салыстырмалы атом,
молекула массалары сан мәні жөнінен сол заттың молярлы атом, молекула массаларына тең.
Дюлонг- Пти ережесі

Мысал
Вольфрамның меншікті жылу сыйымдылығы 0, 1465 Дж/г ●К, ал эквивалентінің молярлы массасы 30, 640 г/моль. Вольфрамның салыстырмалы атомдық массасын анықтаңыз.

Мысал
Шешуі:
Дюлонг - Пти ережесін пайдаланып вольфрамның молярлы массасын анықталық:

Ал валенттілік саны бүтін болатындығын ескере отырып Z = 6 деп аламыз да вольфрамның молярлы массасына түзету енгіземіз, яғни M(W) = 6 * 30, 64 = 183, 85 г/моль.

Мысал Жылу сыйымдылығы 13, 2 кал/ град тең калориметрдің ішіне 400 г 0, 3% -ті сутектің асқын тотығының ерітіндісін құйып, оның үстіне аз ғана мөлшерде MnO2 қосты. Реакция аяқталған кезде температура 1, 97 0С көтерілді. Егер ерітіндінің меншікті меншікті жылу сыйымдылығы С= 1 кал/г* град) тең болса, онда сутектің асқын тотығының 1 молі айрылған кезде бөлінетін жылу мөлшерін есепте.


2. Реакция нәтижесінде бөлінген жылу мөлшері келесі
формуламен анықталады.
Q1= mc *∆t + C∆t = (mc + C) * ∆t
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz