Осмос пен онкотикалық қысым, изотоникалық коэффициент; қышқыл-негіз теориясы және қанның протолиттік буферлік жүйелері



СӨЖ
Тақырыбы: Осмос және онкотикалық қысым. Изотоникалық коэффициент. Қышқылдық және негіздік теориясы. Протолиттік тепе-теңдік. Қанның буферлік жүйесі

Жоспары
Осмос және осмостық қысым
Қышқылдық және негіздік теориясы
III. Қорытынды
Пайдаланған әдебиеттер
2. 2 Изотоникалық коэффициент. Гипо, гипер және изтоникалық ерітінділер

Ерітінді
Аса қанық ерітінді - концентрациясы каныққан ерітіндінің
концентрациясынан жоғары болатын, термодинамикалық
тұрақсыз ерітінді.
Қаныққан ерітінді -еритін зат тұнбасымен динамикалық
тепе-теңдік күйде болатын, заттың еру жылдамдығы мен
кристалдану жылдамдығы тең болатын ерітінді.
Қанықпаған ерітінді - концентрациясы каныққан
ерітіндінің концентрациясынан төмен болатын,
берілген жағдайлар өзгеріссіз болғанда еріген
заттың қосымша мөлшерін еріте алатын ерітінді.
Ерітінді - екі немесе одан да көп компоненттерден
(жеке заттардан) тұратын гомогенді жүйе.

4
ерітіндінің қату температурасының таза еріткіштің қату температурасына қарағанда салыстымалы төмендеуі
ерітіндінің бетіндегі еріткіштің қаныққан бу қысымының таза еріткіштің бетіндегі қаныққан бу қысымына қарағанда салыстырмалы төмендеуі
ұшпайтын заттардың ерітінділерінің қайнау температурасының таза еріткіштің қайнау температурасына қарағанда салыстымалы жоғарылауы
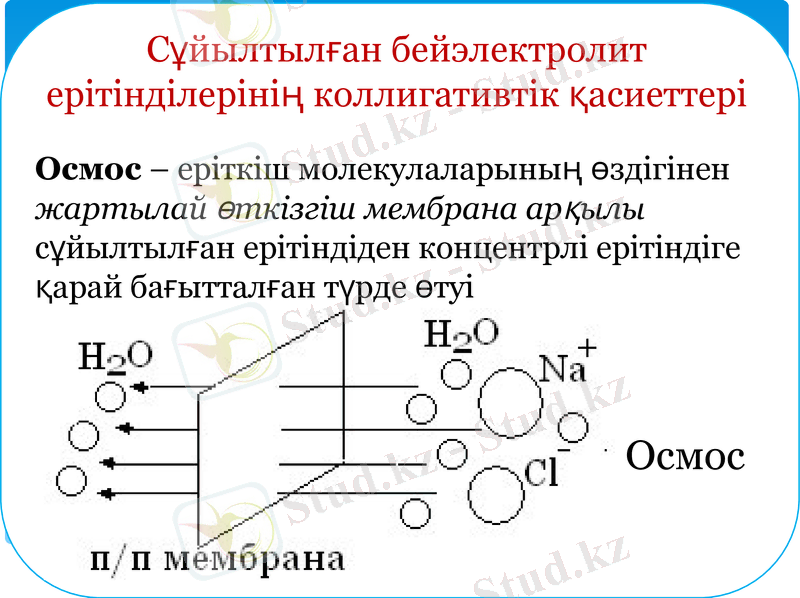
Сұйылтылған бейэлектролит ерітінділерінің коллигативтік қасиеттері
Осмос - еріткіш молекулаларының өздігінен жартылай өткізгіш мембрана арқылы сұйылтылған ерітіндіден концентрлі ерітіндіге қарай бағытталған түрде өтуі
Осмос

Сұйылтылған бейэлектролит ерітінділерінің коллигативтік қасиеттері
Осмостық қысым () - осмосты тоқтату үшін ерітіндіге қажет қысым, яғни, осмос құбылысын туғызатын күш

Росм (адам қанының) = const және 370С-та
740 - 780 кПа-ға немесе 7, 4-7, 8 атм -ға тең
Ағзадағы биологиялық сұйықтықтардығы жоғары молекулалық компоненттердің (мысалға ақуыз) осмостық қысымы онкотикалық қысым (2, 5 - 4 кПа) деп аталады

Рауль заңы:
Сұйылтылған бейэлектролит ерітіндісінің бетіндегі қаныққан бу қысымының салыстырмалы төмендеуі еріген заттың табиғатына тәуелсіз және ерітіндідегі еріген заттың мольдік үлесіне тең болады.
немесе,
мұндағы
p = p0 - p
p0 - таза еріткіштің үстіндегі қаныққан бу қысымы, Па;
р - ерітіндінің үстіндегі еріткіштің қаныққан бу қысымы, Па;
(x) - еріген заттың мольдік үлесі;
n - еріген зат мөлшері, моль;
N - еріткіштің зат мөлшері, моль.

Рауль заңынан туындайтын
бірінші салдар:
Ерітіндінің қату температурасының еріткіштің қату температурасына қарағанда салыстырмалы төмендеуі еріген заттың моляльдық концентрациясына тура пропорционал болады:
Тқату = К. в(х),
мұндағы
в(х) - ерітіндідегі еріген заттың моляльдық концентрациясы, моль/кг;
К - еріткіштің криоскопиялық тұрақтысы, К. кг/моль;
Тқату = Тқату(ер-ш) - Тқату(ер-ді)

Рауль заңынан туындайтын
екінші салдар:
Ерітіндінің қайнау температурасының еріткіштің қайнау температурасына қарағанда салыстырмалы жоғарылауы еріген заттың моляльдық концентрациясына тура пропорционал болады:
Тқайнау = Е. в(х),
мұндағы
в(х) - ерітіндідегі еріген заттың моляльдық концентрациясы, моль/кг;
Е - еріткіштің эбуллиоскопиялық тұрақтысы, К. кг/моль;
Тқайнау = Тқайнау(ер-ді) - Тқайнау(ер-ш)

Р осм. =СМRT -
Вант-Гофф заңы:
Берілген температурада сұйылтылған ерітіндінің осмостық қысымы еріген заттың молярлық концентрациясына тура пропорционал.
мұндағы
C- ерітіндінің молярлық концентрациясы, моль/л;
R - 8, 314 Дж/(моль. К) тең болатын универсалды газ тұрақтысына сәйкес шама
T - температура, К.

Изотоникалық коэффицент. Гипо, гипер және
изотоникалық ерітінділер
Изотоникалық коэффициент-диссоциация процесі жүру нәтижесіндегі ерітіндідегі бөлшектер саны қанша есе көбейетінін көрсететін шама.

www. themegallery. com
Физиологиялық ерітінділер
Бұл қан плазмасына изотонды ерітінділер 0, 9 % NaCl 4, 5 - 5 % глюкоза ерітіндісі
Росм (ер-ді) > Росм (плазма), ерітінді гипертонды болады
Росм (ер-ді) < Росм (плазма), ерітінді гипотонды болады
Физиологиялық емес ерітінділер

Сутектік көрсеткіш рН -
сутек иондарының концентрациясының теріс таңбамен алынған ондық логарифміне тең болатын, ортаның қышқылдығының сандық сипаттамасы:
рН = - lg СН+ немесе рН = -lg [Н+]
1 2 3 4 5 6
7
8 9 10 11 12 13 14
рН
қышқыл
бейтарап
сілтілік

Қышқылдық және негіздік теориясы
Қышқыл (орысша: кислота) - химиялық қосынды, көк лакмус қағазына қызғылт рең беретін ерітінді, дәмі қышқыл. Қышқылдар құрамына қарай оттекті, оттексіз болып, олардағы сутек атомдарының сандарына қарай бір және көп негізді деп бөлінеді. Азот, тұз, күкірт қышқылдары сұйық заттар, ал фосфор және бор қышқылы (Н3BО3) - қатты заттар болса, кремний қышқылы суда ерімейтін іркілдек зат. Көмір және күкіртті қышқылдары тұрақсыз, оңай айырылатын заттар.
H2CO3→CO2↑+H2O;
H2SO3→H2O+SO2↑ Қышқылдардың құрылымдық формуласын жазғанда әуелі сутектің таңбасын шетіне жазамыз, өйткені ол бір валентті элемент.

2. 4. Протолиттік тепе - теңдік. Қанның буферлік жүйесі
Аррениустың электролиттік диссоциация ториясы түсіндіре алмаған мәселелерді Дания ғалымы Дж. Бренстед пен ағылшын химигі Т. Лоури ұсынған қышқылдар мен негіздердің протолиттік теориясы түіндіре алды. Бұл теория Бренстед- Лоури теориясы деп аталды. Бұл теория қышқылдар мен негіздерді, заттардың протонға қандай байланысы бар екендігін анықтайды.
Қышқылдр мен негіздерді бұл теория бойынша протолиттер, ал олардың бір-бірімен әрекетесуін протолиттік тепе-теңдік дейді.
Буферлік жүйелер - сырттан әсер болғанда өзінің қандай да бір параметрінің шамасын өзгертпей, тұрақты қалпында сақтайтын жүйелер

Қан құрамында төрт түрлі буферлік жүйе болады:
1. Бикарбонатты буферлік жүйе; ол көмір қышқылы мен натрий бикарбонаттарынан тұрады.
2. Фосфатты буферлік жүйе; бір және қос негізді фосфор қышқылды натрийдан тұрады.
3. Белокты буферлік жүйе:плазма белоктарынан құралады. Белоктар амфотерлік қасиетінің арқасында ортаның әрекетшіл ортасына қарай не сутегі, не гидроксил иондарын бөледі де, қанның сутектік көрсеткішін бір деңгейде ұстайды.
4. Гемоглобиндік жүйе: гемоглобиннің калийлі тұзына (КНвО2) байланысты. Бұл қосылыс көмір қышқылына қарағанда әлсіз қышқыл болғандықтан оған өзінің калий ионын береді де, сутегі ионын қосып алып, баяу диссоциацияланатын (ажырайтьш) қышкылға айналады. Канның буферлік қасиетінің 75 пайызы осы гемоглобинге байланысты.

Қанның буферлік жүйелері
Атауы
Құрамы
Буферлік әсерді сипаттайтын тепе-теңдік
Гидрокарбонатты
Н2СО3; НСО3-
Фосфатты
Н2РО4-; НРО42-
Гемоглобинді
(окси
гемоглобинді)
ННb; Нb-
(ННbО2; НbО2-)
ақуызды
PtCOОH; PtСOONa

- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz