Фосфор элементі: химиялық қасиеттері, аллотроптары, қосылыстары және биологиялық маңызы



Алматы 2018
Фосфор

“ФОСФОР - тіршілік пен
ақыл - ой элементі”
А. Е. Ферсман

Фосфор (лат. Phosphorus), P - элементтердің периодтық жүйесінің V тобындағы химиялық элемент, реттік нөмірі - 15, атомдық массасы 30, 97.
Бірнеше түрі бар:
ақ фосфор - тығыздығы 1, 828 г/см3; балқу температурасы - 44, 14°С; қызыл фосфор - тығыздығы 2, 31 г/см3; балқу температурасы - 593°С.
Химиялық элементтердің периодтық жүйесінде фосфор III периодта, V топтың негізгі топшасында орналасқан. Салыстырмалы атомдық массасы 31, реттік нөмірі (ядро заряды) 15.
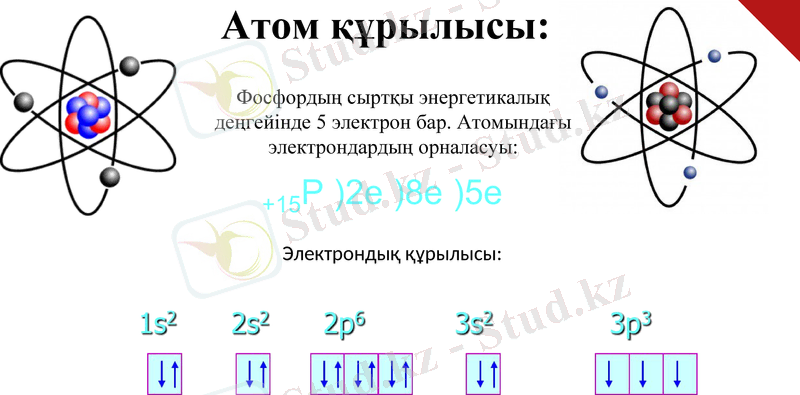
Атом құрылысы:
Фосфордың сыртқы энергетикалық деңгейінде 5 электрон бар. Атомындағы электрондардың орналасуы:
Электрондық құрылысы:

Фосфорды алғаш ашқан - Гамбургтік алхимик Геннинг Бранд (1669 жылы) . Басқа да алхимиктер тәрізді Бранд қарттарды жасартып, сырқаттарды жазатын өмір элексирі мен асыл емес металдарды алтынға айналдыратын философиялық тасты табуға әрекет жасады. Брандты алға жетелеген адамдардың қамы емес, оның байлыққа құмарлығы болды. Ол жайлы бұл алхимиктің жасаған нағыз, әрі жалғыз табысының тарихи дәйектері куәландырады. Бір тәжірибенің барысында ол зәрді буландырып, алынған қалдықты көмір және құм қосып, буландыруды жалғастырды. Кейін ретортада қараңғыда жарық шығаратын зат түзілді. «Рас», «kaltes Feuer» («суық от») немесе «менің отым» деп Бранд атаған зат қорғасынды алтынға айналдырмады және қарттардың сырт келбетін өзгертпеді, бірақ алынған заттың қыздырусыз жарқырауы ерекше, әрі таңсық болды. Жаңа заттың бұл қасиетін пайдалануды Бранд көп созбады. Ол фосфорды беделді адамдарға көрсетіп, олардан сыйлықтар және ақша ала бастады.
Ашылу тарихы:

Тек 1743 жылы А. Маркграф фосфорды алудың жетілген әдісін тауып, өз мәліметтерін көпшілік назарына жариялады. Бұл оқиға брандтық бизнеске нүкте қойып, фосфор және оның қосылыстарын тыңғылықты зерттеуге бастама болды.
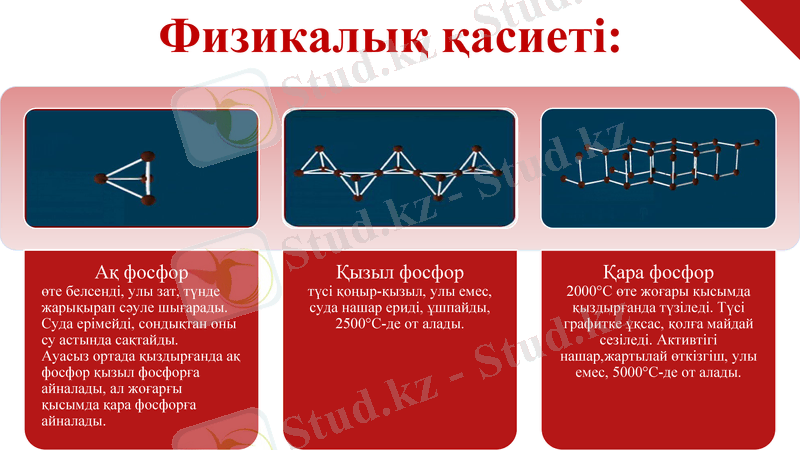
Физикалық қасиеті:

Венн диаграммасы
Ақ фосфор
Қызыл фосфор
Ортақ қасиет
Ақ түсті,
кристалл
Қараңғыда
жарқырайды,
өте улы т. б.
Аморфты,
Кристалды емес
Қараңғыда
жарқырамайды,
Улы емес т. б.
Суда
ерімейді

Химиялық қасиеттері:
Фосфор тотыктырғыш (азоттан темен) және тотықсыздандырғыш қасиет көрсетеді.
Тотыксыздандырғыш ретінде оттекпен және белсенді бейметалдармен реакцияға түседі.
Мырыш фосфиді - зиянкес кемірушілермен күресуде қолданылатын препарат.
Реакция жағдайына байланысты фосфор хлормен (70°С) әрекеттесіп, фосфор трихлоридін РСІ3 және 300° С-та фосфор пентахлоридін РСІ5 түзеді:
Фосфор сутекпен әрекеттесіп, фосфин РН3 түзеді:
Фосфин РН3 - түссіз, ерекше иісі бар, өте улы зат. Аммиакқа қарағанда негіздік қасиеті әлсіз.

Шырпының басына жанғыш заттар - күкірт пен бертолле түзының қоспасы жағылады. Қораптың жақтауына қызыл фосфор мен шыны үнтағы желіммен отырғызылады. Шырпының басын қорапқа үйкегенде, қызыл фосфор бер- толле тұзынан от алып, тез түтанады (21-сурет) . Реакция теңдеуі:
2Р + ЗСl2 = 2РСl3 галогендермен галогенидтер береді
2Р + 3S = P2S3 күкіртпен сульфид түзеді
ЗСа + 2Р = Са3Р2 металмен фосфид түзеді

Сіріңкені 1831жылы 19жасар Шарл Сориа алғаш ойлап тапқан. Бірақ ол сіріңкеге патент ала алмады, себебі ол қымбат болатын. 1832 жылы неміс мұғалімі Камерер сіріңкеге патент алып, оны өндіре бастады. Бірақ оның сіріңкесі ақ фосфордан жасалғандықтан өте қауіпті болды. Қауіпсіз сіріңкені 1848 жылы швед химигі Бетгер алды. Бұл өзіміздің кәдімгі сіріңкеміз, ол қызыл фосфордан жасалады.
Қызықты дерек:

Фосфор өзінің аталуына сәйкес (грекшеден аударғанда “жарық шығарғыш” деген мағынаны білдіреді) ауада оттекпен жарық шығара отырып, қарқынды әрекеттеседі. Осы тәжірибені жасап көрейік. Әуелі шыны қалпақшының тығыны зат жағатын темір қасықшаны өткізеді. Себебі фосфор жанғанда, ақ түтін будақтап, оның оксиді түзіледі. Ол ауада шашылмас үшін қасыққа салынған фосфорды спирт шамы жалынында қыздырып, жана бастағанда шыны қалпақшаға кіргізіп тығындайды. Сонда түзілген фосфор (V) оксиді бірте-бірте төмен қонып, суда ериді. Енді реакция теңдеуін жазайық:
4Р + 5O2 = 2Р2O5 оттегімен оксид түзеді
4P + 3O2→ 2P2O3

Фосфор
айналымы

Қызметі:
Газдық қызмет: фотосинтезге және азоттұрақтандыру нәтижесінде газдардың биогендік орын ауыструы.
Концентрациялық қызмет: тірі ағзалардың сыртқы ортаға шашыраған химиялық элементтерді жинауы.
Тотығу-тотықсыздандыру қызмтеті: заттар күйінің өзгеруі.
Биохимиялық қызмет: сан алуан заттардың ағзаларындағы күрделірек өзгерістер жасайды.

Фосфордың биологиялық маңызы:
Фосфор - күш-қуат көзі.
Қаңқаның мықтылығы құрамындағы фосфор мен кальцийдің мөлшеріне тығыз байланысты. Фосфордың мөлшері кальцийден бір жарым есе көп болуы керек. Ондай болмаған жағдайда тепе-теңдік мөлшерін белгілі бір деңгейде ұстап тұру үшін жеткіліксіз мөлшерін сүйектегі қордан алады. Бірақ D витамині оның арақатынасын реттеп отырады. Фосфор жүйке жасушаларының қызметі үшін де керек. Сондықтан оның мөлшері барлық уақытта біркелкі болуы керек. Фтор, стронций адам тісінің мықты болуына әсер етеді.
Фосфор - аралық зат алмасу процесінде маңызды рөл атқарады. Оның қатысуымен көмірсулардың фосфорлану процесі жүреді, қанның қышқыл-сілігілік тепе-теңдігі қамтамасыз етіледі, бұлшық еттің жиырылуын қуаттандыратын биохимиялық процестер атқарылады.
Фосфор ақуызы мол ет, сүт өнімдерінде кездеседі.
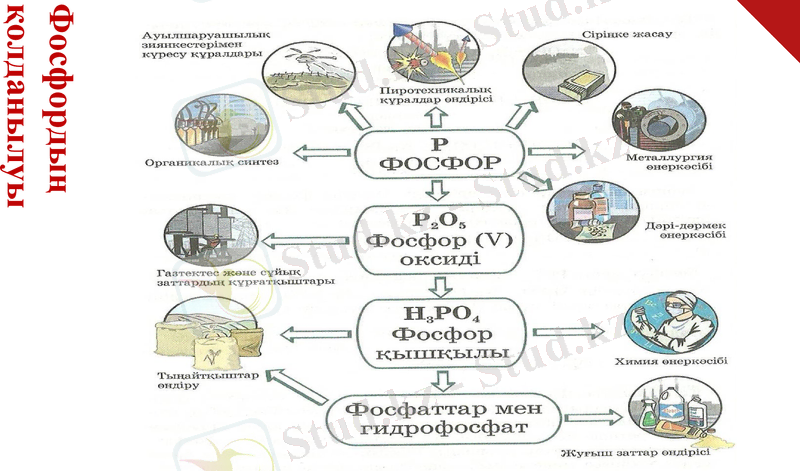
Фосфордың
қолданылуы

Фосфорды соғыс кезінде өртегіш бомба ретінде қолданды, фосфор жақсы жанатындықтан, дұшпаннан жасырыну үшін ақ түтіннен шымылдық жасап пайдаланды.
АҚШ әскері фосфор бомбасын Иракта қолданды

Табиғатта кездесуі:
Азот тәрізді фосфор да өсімдік пен жануар нәруызының негізгі құрам бөлігі. Фосфор өсімдіктердің дәнінде, жануарлардың сүтінде, қанда, ми мен жүйке ұлпаларында кездеседі. Мысалы, ересек адамдардың сүйегінде 600 г, ет ұлпасында 56 г, жүйке жүйесінде 5 г-ға дейін фосфор болады. Барлық сүтқоректілердің сүйегі құрамында фосфор Са3(РO4) 2 немесе ЗСа3(РO4) 2•СаСO3•Н2O түрінде болады. Осындай фосфаттар сүтқоректілер қаңқасына беріктік қасиет береді. Жануарлар мен адамдар фосфорды өсімдік арқылы қабылдайды. Фосфор қосылыстары тіршіліктегі барлық зат алмасу процестеріне қатысады.
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz