Тірі ағзалардағы буферлі ерітінділердің маңызы және адам қанының буферлік жүйелері



СТУДЕНТТІҢ ӨЗІНДІК ЖҰМЫСЫ
Факультеті: «География және табиғатты пайдалану» Кафедрасы: «Гидрология және Метеорология»
Тақырыбы: Тірі ағзадағы ерітінділердің маңызы. Буферлі ерітінділер
Орындаған: Жиенбекова А. Т. Тексерген: Тугелбаева Л. М.

Мазмұны
Кіріспе . . .
Негізгі бөлім. 1) Буферлік жүйелер 2) Буферлік әсер 3) Адам қанының буферлік жүйесі
Қорытынды . . .
Пайдаланылған әдебиеттер . . .

Буферлі ерітінділер
Буферлік ерітінділер - сутек иондарының концентрациясын белгілі бір дәрежеде ұстайтын ерітінділер. Олар негізінен әлсіз қышқылдар немесе негіздер және олардың тұздарының қоспасынан тұрады, сұйылтқанда, концентрлегенде, күшті қышқыл немесе негіздің аз мөлшерін қосқанда өзінің сутектік көрсеткішінің (рН) мәнін болымсыз өзгертеді. Мысалы: ацетаттық Буферлік ерітінділернің (СН3СООН+ +СН3СООNa қоспасының) pH-ы 4, 7, лимондық Буферлік ерітінділернің (С6Н6О7Na2 ерітіндісі) pH-ы 5, 0, фосфаттық Буферлік ерітінділернің (Na2Н2РО4+ +NaОН қоспасының ерітіндісі) pH-ы 11, 5. Буферлік ерітінділер аналитикалық химияда, биохимиялық және физиологиялық зерттеулерде кеңінен қолданылады. Буферлік ерітінділер тірі организмдерде үлкен рөл атқарады (мысалы, қанның, лимфалардың, клеткааралық сұйықтардың pH тұрақтылығы) . Олардың бикарбонаттық, фосфаттық, белоктық (белоктар әлсіз қышқылдық әрі негіздік қасиет көрсетеді) табиғаты бар.
Кіріспе

Буферлік жүйелердің адам ағзасы үшін маңызы жоғары. Адам қаны буферлік жүйелерге жатады. Адам ағзасында әсіресе, бүйректің бөліп шығару және өкпенің тыныс алу қызметтері үшін буферлік жүйелердің маңызы жоғары. Адам ағзасындағы сұйықтықтар (қан, ұлпа сұйықтығы, лимфа т. б. ) қасиетінің бірі - олардағы сутегі иондарының тұрақты кон-центрациясын көрсетуі. Ағза сұйықтығының қышқылдылығының тұрақты болуының маңызы зор. Буферлі жүйелер деп қышқылдың немесе сілтінің аз мөлшерін қосқанда, сонымен қатар сұйылтқанда, сутек иондарының концентрациясы, яғни рН өзгермейтін ерітінділерді айтады. Адам ағзасындағы рН деңгейін сақтап туру буферлі жүйелердің көмегімен жүзеге асырылады. Буферлі ерітінділер әдетте әлсіз қышқыл мен кушті негіз тұзының қоспасында (CH3CООH+CH3COONa 4 ацетатты буферлі қоспа) немесе әлсіз негіз бен оның күшті қышқыл тұзының қоспасынан (NH4OH+NH4CI аммиакты буферлі қоспа) тұрады. Сонымен бірге, әлсіз қышқылдардың қышқыл және орта тұздарының (NaHCО3+Na2C03 карбонатты буферлі қоспа) немесе екі кышқыл түздарының қоспасы (NaН2РО4+NaHPО4 фосфатты буферлі коспа) буферлік қасиет көрсетеді.

Буферлі ерітіндіге қышқыл не сілті косқанда, не болмаса оларды сұйылтқанда рН өзгермей түрақты болуын буферлік әсер деп атайды.
Әлсіз қышқыл мен оның сілтілік тұзынаң тұратын буферлі ерітіндіге (CH3COOH+CH3COONa) күшті қышқыл қосқандағы оның буферлік әсерін былай түсіндіреді: Күшті кышқыддың Н+ иондары тұздың аниондарымен байланысып, әлсіз қышқылдың диссоциацияланбайтын молекулаларын түзеді. Мысалы:
CH3COONa+HCl ↔ CH3COOH+NaCl
ал күшті негіз қосқанда ОН иондары Н+ қосылып Н2О молеқулаларын түзеді:
СНзСООН+NaOH ↔ CH3COONa+H20
Әлсіз негіз бен оның тұзынан тұратын ерітіндінің
NH4OH+NH4CI буферлік әсерін былай түсіндіреді:
Күшті қышқыл қосқанда
NH40H + HC1 → NH4Cl + H20
Күшті негіз қосқанда
NH4CI+NaOH→NH4OH+NaCl

Буферлі ерітінділердің белгілі шамада рН-ты ұстау қасиеті де міне осында жатыр.
Буферлік әсерді су, ондағы еріген қышқыл (негіз) және тұз арасындағы тендікті сақталуымен түсіндіреді. Ерітіндіге әлсіз қышқылдың тұзын қоссақ, ол қышқылдың диссоциациясын тежейді, ал егер әлсіз қышқыл (ерітіндіде) қоссақ, тұздың гидролизденуін тежейді. Мысал ретінде әлсіз қышкыл мен оның тұзынан тұратын буферлі қоспаны қарастырайық. Әлсіз қышқыл ерітіндіде былай диссоциацияланады:
НАп ↔ Н+ + Ап-
Әрекеттесуші массалар заңы бойынша әлсіз қышқылдың электролиттік диссоциация тұрақтысын былай жазады:
Мұндағы [НАп] - диссоциацияға ұшырамаған қышқыл молекулаларының тепе-теңдік концентрациясы [НАп] =СНАп; ал [А-] - тұз және қышқыл диссоциацияланғанда түзілетін аниондардың тепе-тендік концентрациясы, шартты түрде [А-] ꞊ Стүз десек, онда жоғарыдағы тендеуге
тепе-теңдік концентрация мәндерін қойып, оны логарифмдесе, жалпы түрде мынаған келеді:
Бұл теңдеулерден байқайтынымыз, берілген құрамдағы буферлік ерітіндінің рН қышқыл және түз, немесе негіз және түз концентрацияларының қатынасымен анықталады, сондықтан оларды сұйылтқанда ерітінді рН өзгермейді. Себебі ерітінді көлемі өзгергенде әр құрамдастың (компоненттің) концентрациясы бірдей өзгереді.
Буферлік әсердің сақталу шегін буферлік сиымдылықпен береді. Ол біртіндеп күшті қышқыл не негіз қосқанда буферлі ерітіндінің өзінің рН-ын тұрақты етіп сақтап қалу қасиетін анықтайды.
Буферлік сиымдылық деп 1л буферлі ерітіндінің рН ын бір бірлікке өзгерту үшін оған қосуға қажетті күшті қышқылдың (НСІ) не күшті негіздің (NaOH) эквивалентті концентрациясын айтады. Буферлік сиымдылықты В мына тендеумен есептейді:

С-күшті қышқылдың не негіздің эквивалентінің мольдік массасының саны (концентрациясы) . Буферлі сиымдылық буферлі ерітінділер компоненттерінің табиғатына және жалпы концентрацияларына, олардың концентрацияларының қатынастарына тәуелді. Буферлі ерітінді компоненттерінің концентрациялары неғұрлым жоғары және компонент концентрацияларының қатынастары 1 санына жақындаса, буферлік сиымдылық соғұрлым жоғары болады.
Буферлік сыйымдылық біренеше факторларға тәуелді:
1. Қышқылдық-негіздік компонент саны неғұрлым көп болған сайын бұның буферлік сиымдылығы жоғары болады.
2. Буферлік сиымдылық буферлі ертінділердің компонент концентрациясының әрекеттесуіне тәуелді яғни буферлі ертіндінің рН тәуелді. Буферлі сиымдылық компонент концентрациясы артқан сайын жоғарылайды.
Буферлі ерітінділердің буферлік қасиеттер көрсететін аймағы рН=рК±1 арасында орналасады.
Бұл қатынастар үшін:
және рН = рК - lg (10/1) рК-1 тең болады.
Демек берілген қышқыл және түз (немесе негіз және тұз) жұбынан рН мәні рК±1 аралығындағы буферлі ерітінділерді дайындауға болады.
Егер Сқыш=Стұз болса, онда рН=рК. Мысалы: рКсн3соон=4, 75, бұл буфердің буферлік әсері 3, 75 - 5, 75 аралығында орналаспақ.
Буферлі жүйелер сапалық және сандық талдауда ерітіндінің рН-ын бірқалыпты сақтау үшін кең пайдаланылады. Мысалы, Ва2+ катионын Sr2+ мен Са2+-ден калий дихроматымен бөлген кезде ацетатты буферді қолданады.
Көптеген органикалық реагенттермен жүретін, түсі әртүрлі реакциялар ерітіндінің белгілі бір рН мәнінде жүреді. Мысалы, Ni2+ катионын диметилглиоксиммен анықтағанда реакция аммиакаты буфер ортасыңда жүреді.

Биологиялық сұйықтардың рН тұрақты шамасымен сипатталады, оның бұл шамадан ауытқуы шектелген. Сұйық ортаның қышқылдылығын тұрақты сақтап тұру адам ағзасының қызметі үшін маңызы жоғары. рН реттеу қызметін буферлі жүйелер атқарады. Олар сұйық ортадағы рН мәнін және гомеостазды сақтап тұрушы қызмет атқарады. Буферлік жүйелердің адам ағзасы үшін маңызы жоғары. Адам қаны буферлік жүйелерге жатады. Адам ағзасында әсіресе, бүйректің бөліп шығару және өкпенің тыныс алу қызметтері үшін буферлік жүйелердің маңызы жоғары. Адам ағзасындағы сұйықтықтар (қан, ұлпа сұйықтығы, лимфа т. б. ) қасиетінің бірі - олардағы сутегі иондарының тұрақты кон-центрациясын көрсетуі. Ағза сұйықтығының қышқылдылығының тұрақты болуының маңызы зор, себебі: 1) Н+ иоидары көптеген биологиялық өзгерістерге каталиттік түрде әсер етеді. 2) Ферменттер мен гормондар белгілі бір рН аралығыңда биологиялық белсенділік танытады; 3) [Н+] тіпті аз озгеруі (қан және ұлпа аралық сұйықтарда) ағзаның осмос қысымына әсері мол. Қанның қалыпты рН (7, 36) өте кішкене ауытқуы қолайсыз жағдайларға әкеледі. Мысалы, рН 0, 4-ке ауытқуы өлімге соғуы мүмкін.
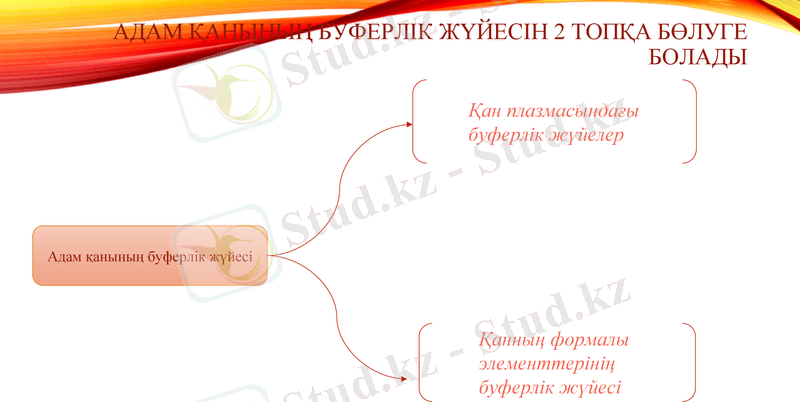
Адам қанының буферлік жүйесін 2 топқа бөлуге болады
Адам қанының буферлік жүйесі
Қан плазмасындағы
буферлік жүйелер
Қанның формалы
элементтерінің
буферлік жүйесі

Оларды жекеше былай жіктейміз.
Қан плазмасындағы буферлік жүйелер
Бикарбонатты буфер (Н2С03 +NaНСО3)
Ақсылдық буфер (H2N-R-COOH+H2N-R-COONa)
Фосфатты буфер (NaH2P04+Na2HP04)
Бос амин қышқылдары мен олардың тұздары
Органикалық фосфаттар (фосфор қышқылының эфирлері)
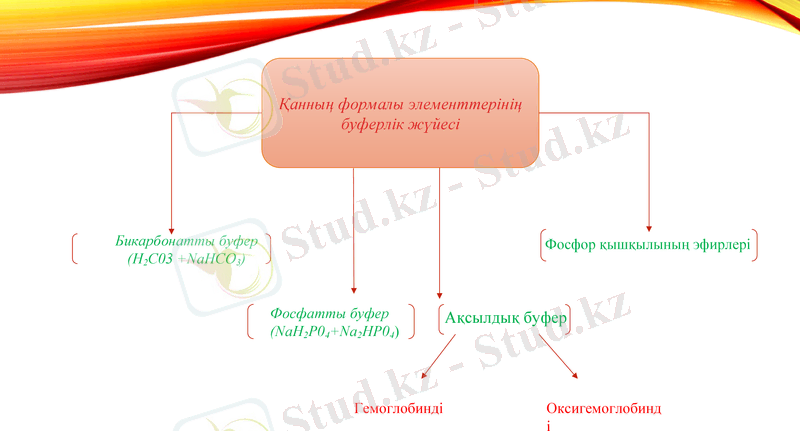
Қанның формалы элементтерінің буферлік жүйесі
Бикарбонатты буфер (Н2С03 +NaНСО3)
Фосфатты буфер (NaH2P04+Na2HP04)
Ақсылдық буфер
Фосфор қышқылының эфирлері
Гемоглобинді
Оксигемоглобинді

Бикарбонатты буферлік жүйе әлсіз көмір қышқылы мен диссоциациясы нәтижесіндегі түзілетін гидрокарбонат-иондар тепе-теңдігімен байланысты.
HCО3- + Н+ ↔Н2СО3
НСОз- + Н2О↔Н2СОз + ОН-
Ағзадағы көмір кышқылы, көмірсулар, майлар, ақсылдардың ыдырау өнімі-көміртек диоксидінің гидротациясы нәтижесінде түзіледі. Бұл процесс фермент карбоангидраза арқылы жеделдейді.
С02 + Н20 ↔ Н2СО3
Фосфатты буферлік жүйе гидрофосфат және дигидрофосфат иоңдарының тепе-теңдігімен сипатталады:
НР042- + Н+ ↔ Н2Р04-
НР042- + Н20 ↔ Н2Р04- + ОН-
Гемоглобин-оксигемоглобин буферлік жуйесіне қанның буферлік сыйымдылығыньщ 75% -ы тиісті, ол әлсіз қышқыл гемоглобин ННв және гемоглобин иондарының Нв- теңдігімен анықталады: HВ-+H+↔ HHB НВ-+Н20↔ННв + ОН-

НСО3-, НР042- және Нв әлсіз қышқыл аниондары болғандықтан, Бренстед бойынша негіздер болып есептеледі,
яғни Н иондарынының тиімді акцепторлары. Сондықтан қанға
күшті қышқылдар түскенде олардағы Н+ көп мелшері НС03,
НР042-және Нв иондарымен байланысып, диссоциацияланбаған көмір қышқылының, гемоглобиннін, дигидрофосфат иондарын түзеді. Мысалы:
NаНСО3 + НС1 ↔ Н2С03 + NaCl
Белоктық буфер жүйесі - плазмадағы күшті буферлік жүйелердің бірі. Белоктың буферлік қасиеті оның молекуласындағы қышқыл мен сілті топтарына яғни амфотерлік реакция беретініне байланысты. Белок қышқыл жерде сілті ретінде қышқыл затпен, сілтілі жерде қышқыл ретінде сілтілі затпен әрекеттеседі.
Көп жағдайларда буферлік жүйелер рН кему бағытына қарсы тұру үшін жұмыс жасайды, себебі ағзаның тағамды сіңіруі нәтижесінде де біраз мөлшерде көміртек диоксиді түзіледі (тәулігіне 550-775г) . Ол сумен әрекеттесіп, Н+ ионының (25-35моль) тәулік мөлшеріне сәйкес келетін көмір қышқылын береді. Қандағы рН төмендеуіне әкелетін үдерістің бірі -
өкпеде жүретін гемоглобиннің оксигемоглобинге айналуы,
ННв + 02 ↔ ННв02, себебі ННв02 ННв-ге қарағанда күштірек қышқыл.

- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz