Химиялық байланыс: негізгі түрлері мен қасиеттері



ҚАЗАҚСТАН РЕСПУБЛИКАСЫНЫҢ ДЕНСАУЛЫҚ САҚТАУ МИНИСТРЛІГІ
СӨЖ
Химиялық пәндер кафедрасы
Тақырыбы: Химиялық байланыс. Химиялық
байланыстың негізгі түрлері мен қасиеттері
Дайындаған: Ф. А. Шайловбеков
Тобы: 103 Б ЖМ
Қабылдаған: А. Ш. Өмірқұлов
ОҢТҮСТІК ҚАЗАҚСТАН
МЕДИЦИНА
АКАДЕМИЯСЫ АҚ

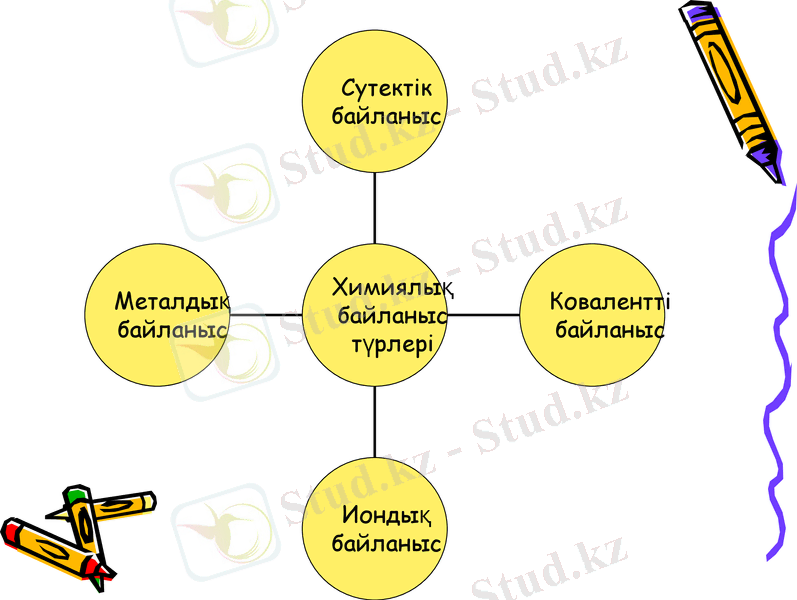
Жоспар:
І. Кіріспе
ІІ. Негізгі бөлім
Ковалентті байланыс
Иондық байланыс
Металдық байланыс
Сутектік байланыс
ІІІ. Қорытынды
ІV. Қолданылған әдебиеттер.

ХИМИЯЛЫҚ БАЙЛАНЫС
- химиялық қосылыстағы атомдардың бір-біріне әсері арқылы жүзеге асатын күштер жиынтығы
Notes: Сегодня на уроке мы начинаем изучать новую тему: ХИМИЧЕСКАЯ СВЯЗЬ. Запишите тему урока. Что же мы понимаем под «химической связью»?
Щ. Химическая связь - это совокупность сил, обусловливающих взаимодействие атомов друг с другом в химическом соединении. Запишите.
Щ.

Химиялық байланыс түзілген кезде атомдардың электрондық құрылымы өзгеріске ұшырайды.
Атомдардың электрондық құрылымы анағұрлым тұрақты болған жағдайда ғана химиялық байланыс түзіледі.
Химиялық байланыс түзілуде ең басты рольді электрондар атқарады.

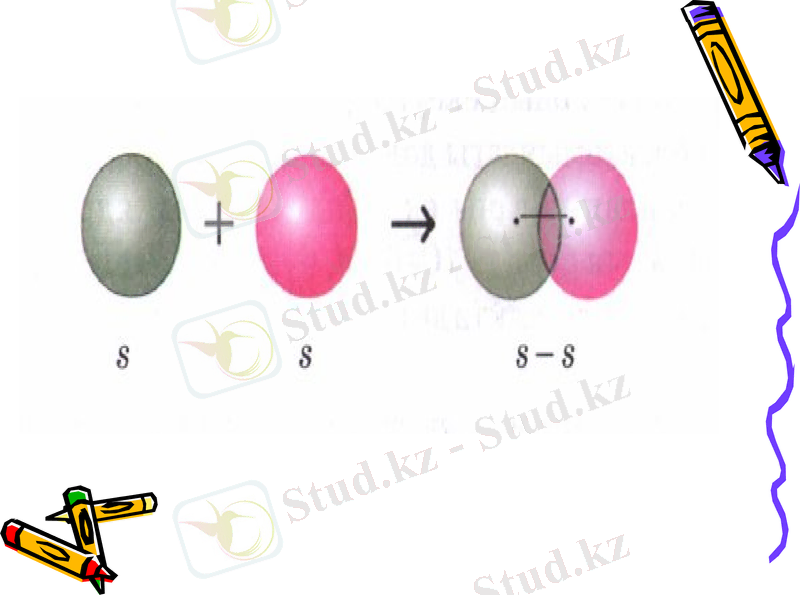
Ковалентті Химиялық байланыста - әрекеттесуші атомдарға ортақ электрондар жұбы пайда болып, олардың санына қарай бір немесе бірнеше еселенген байланыстар түзіледі. Мысалы, сутек молекуласы атомдары арасында бір (Н:Н), оттек молекуласында қос (:О::О:), азот молекуласында үш (:N:::N:) еселенген ковалентті Химиялық байланыс бар.

Джильбер Льюис

Оттек атомының электрондық формуласы 1s 22s22p4, валенттілік электрондары 2s22p4, электртерістілігі 3, 5.

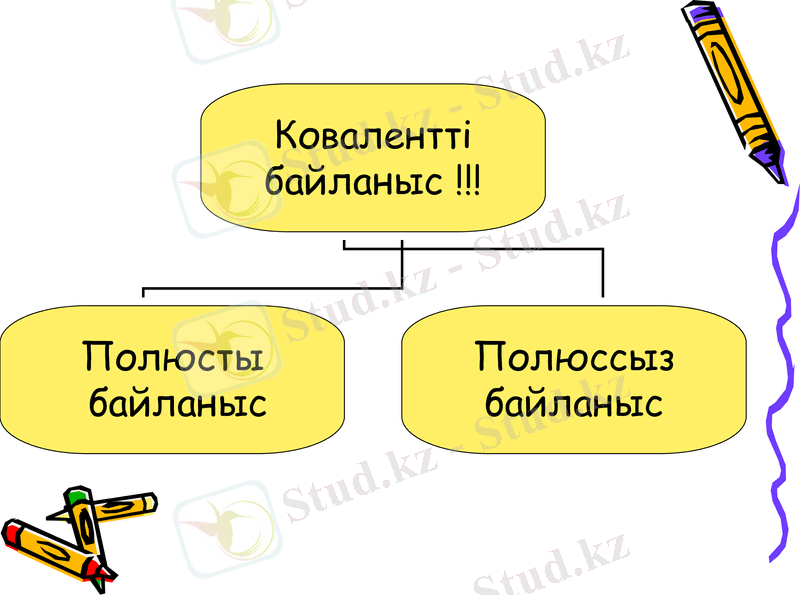
Полюсті молекулада Химиялық байланыс түзетін ортақ электрондар электр терістілігі күшті атомға ығыса орналасады. Молекуланың полюстілігі диполь моменті арқылы көрсетіледі. Полюстік молекулалардың қайнау және балқу температурасы төмен, полюсті еріткіштерде үйектеліп иондарға ыдырайды.

Полюссіз ковалентті Химиялық байланысты молекулада электрон жұбы атомға ауыспай, симметриялы түрде ортада орналасқан. Полюссіз Химиялық байланыстағы қосылыстардың қайнау және балқу температуралары төмен, полюсті еріткіштерде иондар түзбейді, электр тоғын өткізбейді. Ортақтаспаған электрон қосағынан және электронсыз бос орбитасы бар атомдардан (донар-акцепторлы) түзілетін сутектік және металдық Химиялық байланыстар координациялық байланыс деп аталады.

Сутекті Химиялық байланыс - екі не бір молекуладағы атомдар арасында сутек атомының оң заряды арқылы түзіледі.

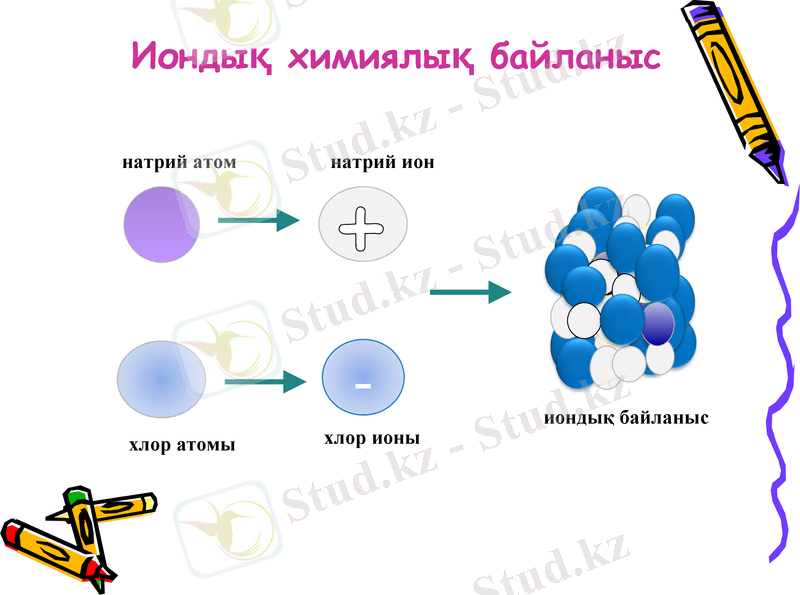
Иондық байланыс !!!
Иондық Химиялық байланыс электр терістілігі бойынша айырмашылығы үлкен металл мен бейметалл атомдары арасында түзіледі. Химиялық әрекеттескенде валенттік электрондарын беріп, оң зарядты иондарға (катиондарға) : К־-е-К+ бейметалл атомдары электрондар қосып алып, теріс зарядты иондарға (аниондарға) айналады: Cl+е-Cl־. Әр аттас зарядты иондар бірін-бірі тартып молекула құрайды: K+ + Cl ־= KCl.

Иондық байланыс теориясын
1916 жылы неміс ғалымы
В. Коссель ұсынған болатын. Бұл теория типтік металдар мен типтік бейметалдар атомдары арасында: CsF, CsCl, NaCl, KF, KCl, Na2O, CaO түзілетін байланысты түсіндіреді. Осы теорияға байланысты иондық байланыстың түзілу кезінде типтік металл атомдары электронды береді, ал типтік бейметалл атомдары электронды қосып алады.
КОССЕЛЬ (Kossel),
Вальтер
1888 - 1956 ж. ж.

Иондық Химиялық байланыс қарама-қарсы зарядталған иондардың электрстатикалық тартылысы нәтижесінде жүзеге асады. Иондар түзілу арқылы жүзеге асатын байланыстарды иондық байланыс, қосылыстың өзін иондық қосылыс деп атайды. Иондық қосылыстардың қайнау, балқу температурасы жоғары, қызуға тұрақты, олар полюстік еріткіштерде тез ериді, ерітінділері электр тогын жақсы өткізеді.
натрий атом

Металдық байланыс !!!
Металдық Химиялық байланыс - металл атомдарының сыртқы қабатындағы бос электрондар қатысуымен түзілетін байланыс. Химиялық байланыс валенттік электрондар арқылы жүзеге асады.

Химиялық байланысының негізгі сипаттамалары: 1) байланыс энергиясы, 2) байланыс ұзындығы, 3) валенттік бұрыш. ыш. Байланыс энергиясы - өзара байланысқан атомдарды не иондарды бір-бірінен ажырату үшін жұмсалатын энер Байланыс ұзындығы - Химиялық байланыстағы атомдар ядроларының арасындағы қашықтық, Валенттік бұрыш - байланысқан атомдар ядролары арқылы жүргізілетін жорамал сызықтар арасындағы бұрыш. Бұл көрсеткіштер зат молекуласының құрылысын, пішінін және беріктігін сипаттайды.

Назар аударғандарыңыз үшін рахмет!!!
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz