ІІІА топша элементтерінің қосылыстары мен физикалық және химиялық қасиеттері



IIIA топша элементтері. Бор, Алюминий олардың қосылыстары мен қасиеттері
Орындаған: Ерденбек І. Б.
ҚАЗАҚСТАН-РЕСЕЙ МЕДИЦИНАЛЫҚ УНИВЕРСИТЕТІ
ОСӨЖ
101 б тобы фарм.
Тексерген: Кеноханова А. Ж.

Жоспар
IIIA топша элементтерінің жалпы сипаттамасы
Бордың физикалық және химиялык қасиеттері
Алюминийдің физикалық және химиялык қасиеттері
Г а л л и й туралы
И н д и й жалпы сипаттама
Т а л л и й қасиеттері
Қорытынды
Пайдаланылған әдебиеттер
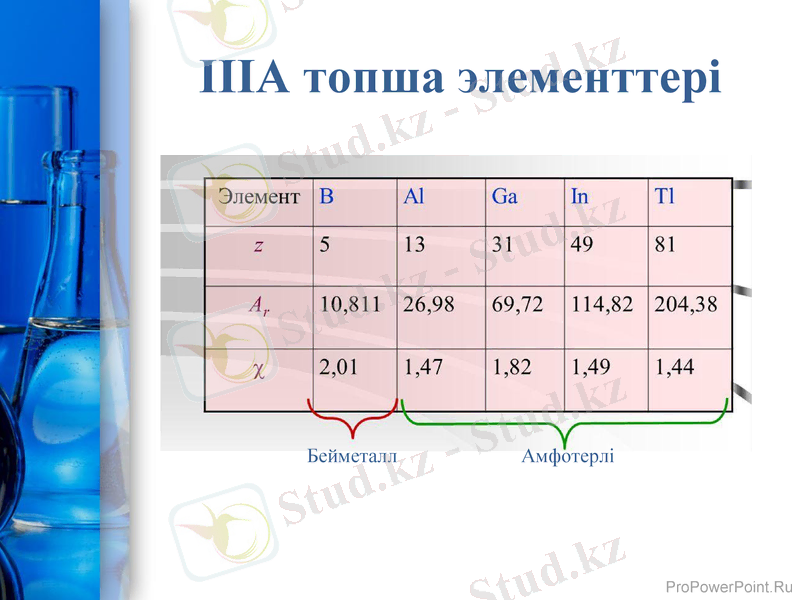
IIIA топша элементтері
Бейметалл
Амфотерлі
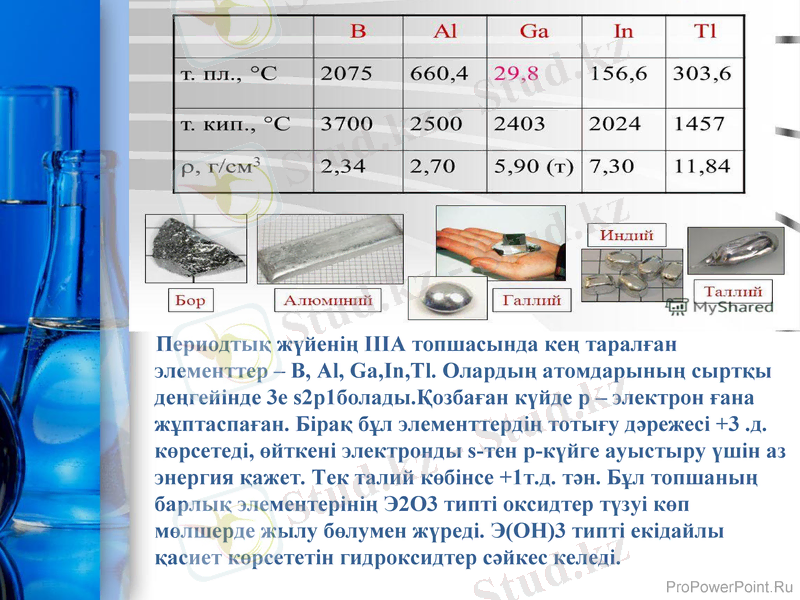
Периодтық жүйенің ІІІА топшасында кең таралған элементтер - В, Al, Ga, In, Tl. Олардың атомдарының сыртқы деңгейінде 3е s2p1болады. Қозбаған күйде р - электрон ғана жұптаспаған. Бірақ бұл элементтердің тотығу дәрежесі +3 . д. көрсетеді, өйткені электронды s-тен р-күйге ауыстыру үшін аз энергия қажет. Тек талий көбінсе +1т. д. тән. Бұл топшаның барлық элементерінің Э2О3 типті оксидтер түзуі көп мөлшерде жылу бөлумен жүреді. Э(ОН) 3 типті екідайлы қасиет көрсететін гидроксидтер сәйкес келеді.

Бордың ашылу тарихы
Бордың ашылуы 1808 жыл деп есептелінеді. Оны алғаш ашқан авторлар саны бірнешеу, солардың бірі -француздың атақты ғалымдары Ж. Гей-Люссак пен Л. Тенар. Олар бор қышқылын қыздырып, одан кейін (бор ангидридін) металлл калиймен тотықсыздандыру арқылы онша таза болмаса джа бор алған, оны мына үлгімен көрсетуге болады:H3BO3-XB2O3-X-B. Сол жылы ағылшын химигі Гемфри Дэви де балқыған бор оксидін электролиздеу әдісімен онша таза емес бор алды. Таза бор бұлардан 100 жыл кейін ғана алынды. Ілгерідегі ғалымдар борды өзінің ертеден белгілі қосылысы - бура, бор немесе «бораций», арабша «бурақ» деген сөзіне сәйкес атаған.

Бордың физикалық қасиеттері
Бор - қиын балқитын, диамагнитті, қара (кристалданған) немесе бурыл (аморфты) түсті ұнтақ, жылуды және электрді нашар өткізеді.
Бор басқа элементтерден қасиеттері бойынша ерекшеленеді. Ол - жалғыз бейметалл, химиялық инертті және В-Ғ, B-N, В-С, т. б. сияқты коваленттік байланыстар түзеді.
Бордың химиясы кремнийдің химиясына ұқсас, бұл жағдайда диагональ ұқсастық байқалады.

Химиялық қасиеттері
Кристалданған бор химиялық инертті. Оттегімен 750°С маңайында әрекеттесіп, В2O3 түзеді. Қайнаған НҒ, НСІ және NaOH ерітінділері оған әсер етпейді. Аморфты бордың химиялық белсенділілігі жоғары және ыстық концентрленген HNO3, H2SO4 ерітінділерімен, хром қоспасымен, концентрленген Н2O2 және (NH4) 2S2O8 ерітінділерімен баяу тотығады:
В + HNО3 = Н3ВО3 + 3NО2

Оксидтері, оксоқышқылдары
Бордың маңызды оттегілік қосылыстарына бор оксиді В2O3, бор қышқылдары және олардың тұздары бораттар жатады. Бор оксидінің алынуы:
4В + 3O2 = 2В2O3
2Н3ВO3 = В2O3 +ЗН2O
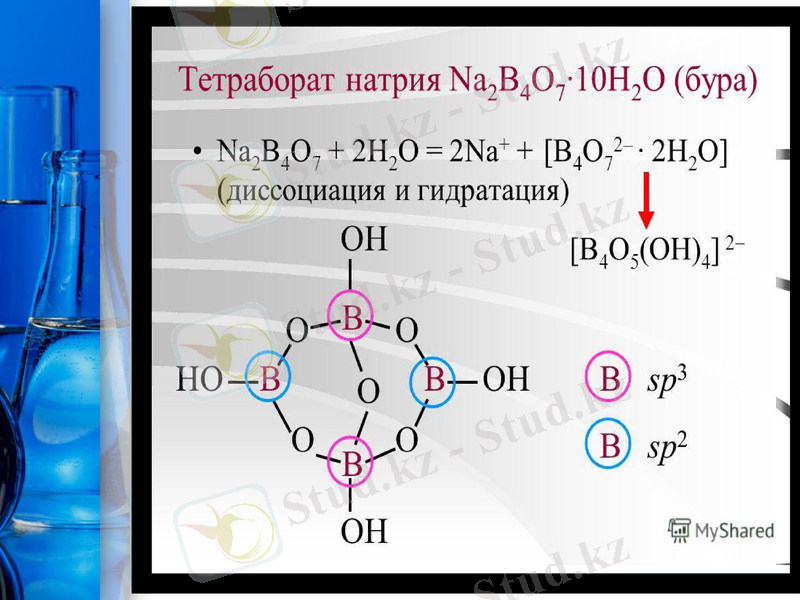
Ортобор (бор) қышқылы В(ОН) з немесе Н3ВО3 бордың ерігіш қосылыстарының, мысалы бураның Na2[B4O5(OH) 4] 8Н2O гидролиздену өніміне жатады.
Na2[B4O5(OH) 4] 8Н2O + H2SO4 = 4В(ОН) 3 + Na2SO4 + 5Н2O
Бор қышқылы қолға майлы болып сезілетін, балық қабықшаларына ұқсас кристалдар. НзВ03 суда жақсы ериді жэне бір негізді әлсіз қышқылдарға жатады.

Бура - суда жақсы еритін түссіз кристалдар. 60, 8°С -та гидратқа Na2[B4O5(OH) 4] ЗН2O айналып, балқиды, ал 161 °С -та сыртқы сферадағы суды толық жоғалтады, ал 380°С -та толық сусызданып, шыны тәріздес натрий тетраборатын Na2B4O7 түзеді. Металдардың оксидтері және тұздарымен балқытқанда, боялған шынылар (перлы) пайда болады:
2Na2B4O7 + 2Co(NO3) 2 = 2Co(BO2) 2 + 4NaBO2 + 4NO2 + O2

Қолданылуы
Бор термисторлар, термиялық нейтрондардың жартылай өткізгішті есептегіштерінде, нейтрондарды жұтатын материалдардың негізі, қорытпалардың, керамиканың, стакандардың бөлігі болып табылады. Атом өнеркәсібінде бор мен бордың карбидтері пайдаланылады, олар қорғаныш жабындарды жасау үшін қолданылады.

Кездесуі
Германия, Америка, Тибет т. б. жерлерде өндіріске қажетті бр кендері бар. Қазақстанда бор кендері ашарит, борацит, гидроборацит, пандермит т. б. миералдар түрінде кездеседі. Таза кристалды бордың тығыздығы -2340 кг/м3, балқу температурасы -20750С, қайнау температурасы-38500С. Бор қаттылығы жағынан алмаздан кейінгі периодтық жүйедегі металдық және бейметалдық элемент. Оның қаттылығы 9, 3-ке тең.

Алынуы
Жоғары температурада азотпен әрекеттескенде бор нитридін ВN, көмірмен -бор карбидін В4С, металдармен -боридтер түзеді. Таза аморфты борды Анри Муассан магниетермиялық немесе натритермиялық әдіспен алады.

Алюминийдің ашылу тарихы
Алюминийді бос күйінде алғаш рет 1825 жылы даниялық физик Ханс Кристиан Эрстед алған.
Өнеркәсіптік әдіспен (балқыма электролизі) алюминийді алғаш рет 1854-1856 жылы француз химигі Анри Этьен Сент-Клер Девиль алды. 2007 жылдан бастап Қазақстанда алюминий алатын Павлодар электролиз зауыты жұмыс істей бастады. Алюминий оксидінің балқымасына электр тоғымен ыдыратып алады:
⁺³₂O⁻²₃=4Al°+3O°₂

Қосылыстары
Алюминий - екідайлы элемент. Ол сұйылтылған қышқылдармен және сілтілермен жақсы әрекетеседі: 2Al + 6HCl = 2AlCl₃ + 3H₂ 2Al + 2NaOH + 6H₂O = 2Na[Al(OH) ₄] + 3H₂
Алюминий белсенді металл болғандықтан, көптеген металдарды олардың оксидтерінен тотықсыздандырады: 8Al + 3FeO*Fe₂O₃ =4Al₂O₃ +9Fe

Алюминий техникада және тұрмыста кең қолданылады. Жеңіл және бағалы қасиеттері бар құймалар алынатындықтан, оның авиациялық өнеркәсіпте, автокөлікте, электротехникада электр сымдарын жасау үшін, сонымен қатар жарылғыш заттарды алуда, химиялық аппаратураларды дайындауда, ғимараттарды салуда, жиһаздарды, ыдыстарды және т. б. жасауда маңызы зор.


Кездесуі
Алюминий кеңдерінің бай қорлары Қазақстанда, Оралда, Хибин тауларында, Башкирияда, Сібірде кездеседі. Боксит - Al₂O₃-nH₂O Қазақстанда бокситтердің белгілі кен орындары бар. Олар Қостанай және Ақтөбе облыстарында орналасқан. Павлодар алюминий зауытында металл күйіндегі алюминий өндіріледі

Маңызы
Ересек адам күніне алюминийдің 30-50 мг қажет етеді. Күнделікті өмірде оны нан өнімдерінен аламыз. Шайдың құрамында суға қарағанда 20-200 есе көп болады. Алюминий судың, ауаның, дәрілік препараттың, иіс сулардың, алюминийден жасалған ыдыстарда болады. Алюминий зат алмасуға, жүйке жүйесінің қызметіне, жасушаның көбеюі мен өсуіне кері әсерін тигізеді. Сонымен қатар ағзадағы көп мөлшері қозғалыс белсенділігінің төмендеуіне, есінен тануына да әсер етеді. Кейбір зерттеулерде алюминий мидың зақымдануына да әсер етеді. Алюминий тұздарының көп болуы ағзадағы кальцийді төмендетеді, фасфордың адсорбциялануын азайтады, сүйектегі, бауырдағы, мидағы алюминийдің құрамын 10-20 есеге арттырады.

Г а л л и й туралы
Галлий (лат. Gallіum), Ga - элементтердің периодтық жүйесінің ІІІ тобындағы хим. элемент, ат. н. 31, ат. м. 69, 72; 5, 9 г/см3, балқу t 29, 8°С, қайнау t 2237°С, күмістей . Г-ді 1875 ж. француз химигі П. Э. Лекок де Буабодран ашып, оны Франция құрметіне Г. деп атаған. Қалыпты температурадағы ауада Г. тұрақты. Қышқылдарда, сілтілерде ериді, амфотерлі қосылыстарында +1, +2, +3 валентті, тұрақтысы +3. Қалыпты жағдайда хлор және броммен, қыздырса оттек, күкірт және йодпен әрекеттеседі. Г. алюминий, мырыш, темір, қорғасын, германий, титан кендерінде және мұхит суларында кездеседі. Оның негізгі минералы - галлит (CuGaS2) .

И н д и й жалпы сипаттама
Индий(Іndіum), Іn - элементтердің периодтық жүйесінің ІІІ тобындағы хим. элемент, ат. н. 49, ат. м. 114, 82; тығызд. 7, 31 г/ см3, балқу t 156, 78°С, қайнау t 2024 °С. Күмістей ақ металл, оңай балқиды және өте жұмсақ. Ауада тұрақты. Индий төмен тотығу дәрежелі қосылыстары сулы ерітінділерде диспропорцияланады:
ЗІпСІ = ІпСІ + 2Іп
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz