Ақуыздардың құрылымы мен қызметі: фолдинг және шаперондардың рөлі



ПРЕЗЕНТАЦИЯ
Тақырыбы: Ақуыздың құрылысы және қызметі. Ақуыз фолдингі. Шаперондар, жасушадағы қызметі.

Жоспар:
Кіріспе
Ақуыз - аминқышқылдарынан құралған органикалық зат
Негізгі бөлім
Ақуыз молекуласының құрылым деңгейлері
Ақуыздардың қызметі
Фолдинг және фолдинг факторлары
Шаперондар және оның сипаттамасы
Қорытынды
Қолданылған әдебиеттер

Кіріспе
Ақуыздар - жасушаның ең маңызды макромолекулаларының бірі. Оның элементтік құрамын, құрылысының теориясын алғашқылардың бірі болып зерттеген және «протеин» (protein - бірінші) деп атауды ұсынған голландия химигі және дәрігері Г. Я. Мульдер (1802-1880) болатын.

Ақуыздар аминқышқылының тізбегінен тұрады. Ақуыздар тірі организмның құрамына кіріп қажетті маңызды функцияны атқарады. Ақуыздарды құрылымы және функционалды атқаратын қызметіне қарай бөлу қиын. Ақуыздарды құмына, қышқылдығына қарай ақуыз емес топтарына қарай бөлген. Демек, ақуыздар жай (протеин) және күрделі (протеид) деп бөлінеді. Жай ақуыздар гидролиздегенде тек аминқышқылын түзеді. Жай ақуыздарға альбумин, склеролротеидтер жатады. Күрделі ақуыздарға ақуызбен нуклеин қышқылының комплекстері (нуклеопротеидтер), полисахаридтермен ақуыз комплестері (гликопротеидтер), липидтер (липопротеидтер), бояғыш заттармен (хромопротеидтер), фосфор қышқылының қалдықтарымен (фосфопротеидтер), ауыр мателдардың иондары (металопротеидтер) жатады. Ақуыздар молекуласының формасы бойынша глобулалы және фибрилді деп бөлінеді.

Ақуыздар реакцияға түскенде әр түрлі түске боялады, сондықтан оларды сапалық анализ жасаумен анықтайды. Ақуыздардың (пептидтер) қасиеті - олардың құрамына кіретін аминқышқылдардың табиғатымен және мөлшерлік қатынастаырмен анықталады. Ақуыз молекуласында аминқышқылдары бір-бірімен пептидтік байланыс арқылы байланысып үлкенді кішілі полипептид тізбегін түзеді.
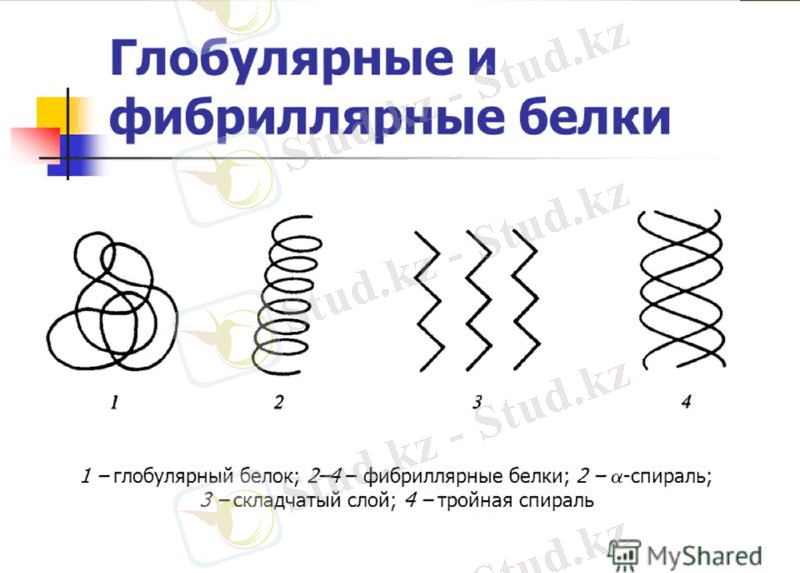

Ақуыз молекуласының құрылым деңгейлері
Біріншілік құрылымы - полипептидтік тізбекте бір-бірімен пептидті байланыс арқылы қосылған амин қышқылдарының саны және кезектігі. Егер де ақуыздың полипептидтік тізбектегі амин қышқылдарының орналасу реті өзгеретін болса, ол өзінің биологиялық қасиеттері мен қызметтерін жоғалтады, мұндай жағдай - орақ клеткалы анемия кезіндегі гемоглобиннің молекуласында байқалатыны анықталған. Бұл құрылым ДНҚ-ның белгілі бір гендерінің триплетті кезектігі ретінің, яғни генетикалық кодтың өнімі болып табылады.
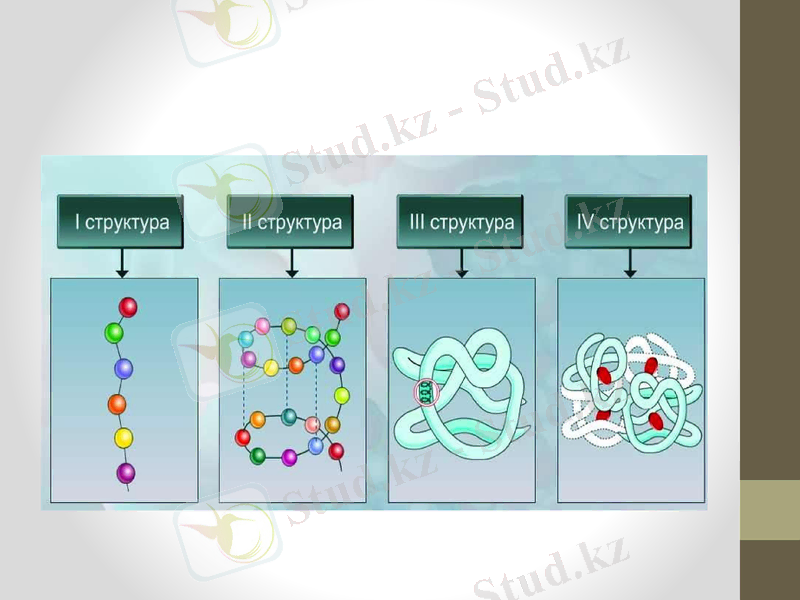

Екіншілік құрылымы - конформациясын немесе басқа сегменттермен өзара әрекеттесуін ескермегендегі полипептидті тізбектің бөліктері атомдарының локальды кеңістіктік орналасуы болып табылады. Л. Полинг пен Р. Кори полипептидтік тізбектің қарапайым кеңістіктік құрылым сутектік байланыспен тұрақтанған α-спираль түрінде болады, α-спиральдің бір орамына 3, 6 аминқышқылдық қалдық сәйкес келеді деген қорытынды жасады. Сутектік байланыс бірінші аминқышқылдың карбонилдік тобы мен 5-ші аминқышқылдың имин- тобының, ары қарай екінші аминқышқылдың карбонилдік тобы мен 6-шы аминқышқылдың иминтобының арасында пайда болады және т. б.

Үшіншілік құрылым - α-спиральдің кеңістіктік конформациясы немесе басқа молекулаларымен өзара әрекеттесуін ескермегендегі глобулярлық ақуыздардың полипептидтік тізбектерінің белгілі бір көлемде жинақталуы әдісін айтамыз. Бұл құрылым дисульфидтік, иондық және сутектік байланыстармен тұрақтандырылады. Ақуыз молекуласының құрылымдық ұйымдастығының бұл деңгейінде полипептидті тізбек белгілі формаға, көлемге ие болады. Бұл жағдайда аминқышқылдарының радикалдары кеңістікте орналасқанда олардың молекуласының үстінде негізінен ионогенді, гидрофильді радикалдар және функционалдық топтар жинақталады. Гидрофобты радикалдар глобуланың ортасына қарай орналасады.

Төртінші құрылым - тек олигомерлік ақуыздарда ғана бар, яғни бірнеше протомерлерден тұратын ақуыздарда кездеседі. Бірнеше протомерден тұратын және төртіншілік құрылымы бар ақуыз ортаның рН, температурасы біраз өзгерген кезде өзін құрастырушы протомерлерге ыдырайды. Протомерлердің бірыңғай ақуыз молекуласына бірігуі суббірліктің бір-бірімен коваленттік емес байланысы арқылы қосылуымен жүзеге асырылады: полярлы емес, иондық және сутектік.

Ақуыздардың қызметі
1. Құрылымдық қызмет - ақуыздар арқылы клетканың көптеген компоненттері түзіледі, ал липидтермен кешен түрінде олар клетка мембранасының құрамына кіреді. 2. Катализдік қызмет - барлық ферменттер өздерінің химиялық табиғаты бойынша ақуыздар. Бұл қызмет 1982 жылдан бастап бірегей болып есептеледі. Кейбір РНҚ-ың да катализдік белсенділігі анықталды. Оларды РНҚ-зималар немесе рибозималар деп атайды. 3. Тасымал-даушылық қызмет - гемоглобин ақуызы оттегіні тасымалдайды, басқа ақуыздар липидтерді, билирубинді, май қышқылдарын тасымалдайды. Трансферрин темірді тасымалдайды. 4. Механохимиялық (немесе жиырылдырушылық) қызмет - бұлшықет жұмысы және басқа да мүшелердегі қозғалу қызметі макроэргиялық байланыстарды пайдаланатын жиырылдырушы ақуыздардың (мысалы, актин, миозин) тікелей қатысуымен өтеді.

5. Реттеушілік қызмет. Клетка деңгейінде: ақуыз-репрессорлар және ақуыз-транскрипцияның активаторлары. Организм деңгейінде: кейбір ақуыз - гормондар. Мысалы, инсулин - ұйқы безінің гормоны, самототропин - өсу гормоны. 6. Қорғаныстық қызмет - интерферондар, иммуноглобулиндер, фибриндер. 7. Тіректік қызмет - сіңірлер, сүйектердің бетінің буындарының құрамына негізгі бөлігі ақуыздардан құралған, мысалы, коллаген, эластин. 8. Энергиялық қызмет - ақуыздардың АҚ-дары организмді энергиямен қамтамасыз ететін гликолиз жолына түсе алады.

9. Рецепторлық қызмет - көптеген ақуыздар таңдап білу (рецепция) үдерісіне қатысады. 10. Энергияны трансформациялау қызметі. Көз торшасының родопсині және ретинені жарық энергиясын электрлік энергияға трансформациялайды.

Фолдинг және фолдинг факторлары
Фолдинг - фолдаз және шаперондардың қатысуымен жүреді, және де энергетикалы және функциональді жағынан ең оптимальді пептидті тізбекті қалыптастырады. Мысалы, кейбір ауыр жүйке ауруларында фолдинг өз қызметін дұрыс атқармайды. Фолдинг факторларын келесі екі топқа бөлуге болады:
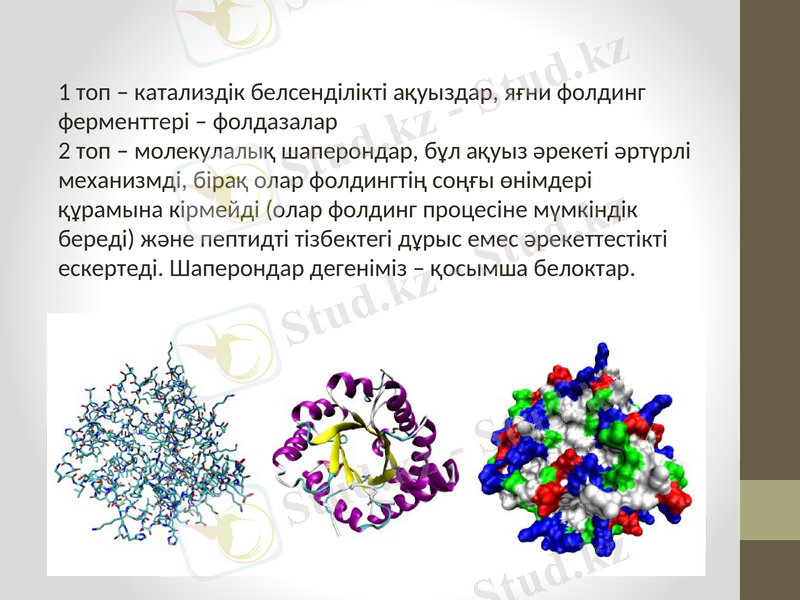
1 топ - катализдік белсенділікті ақуыздар, яғни фолдинг ферменттері - фолдазалар
2 топ - молекулалық шаперондар, бұл ақуыз әрекеті әртүрлі механизмді, бірақ олар фолдингтің соңғы өнімдері құрамына кірмейді (олар фолдинг процесіне мүмкіндік береді) және пептидті тізбектегі дұрыс емес әрекеттестікті ескертеді. Шаперондар дегеніміз - қосымша белоктар.

Шаперондар және оның сипаттамасы
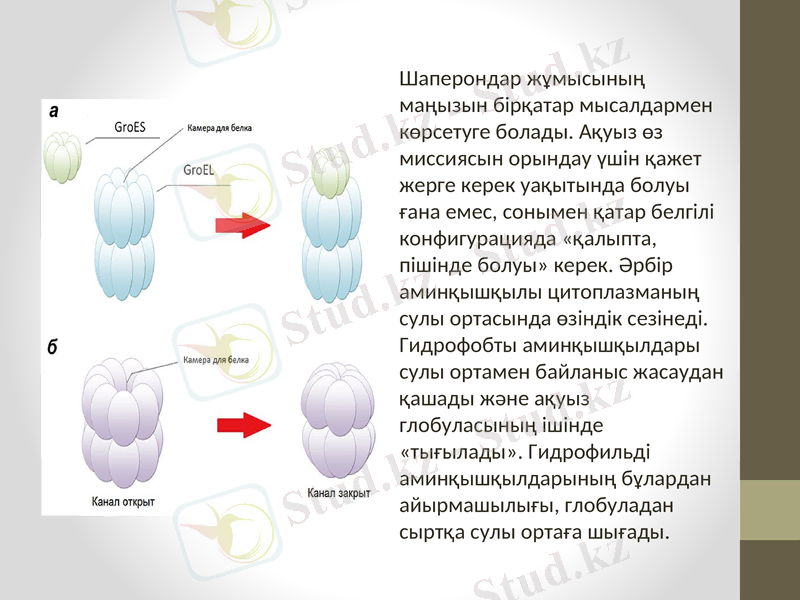
Шаперондарда - рефолдингті бақылау жүреді. Рефолдинг - қайтадан құрылу деген мағынаны білдіреді. Шаперондар барлық органеллаларда және цитоплазмада табылды. Ақуыздар-шаперондар полипептидтердің белсенді бетімен негізінен байланысу жолымен әрекеттеседі, мысалы, гидрофильді бетімен. Шаперондар бұл белсенді беттерді қоршайды және агрегациядан сақтайды, полипептидті шынжырдың дұрыс қалануын жеңілдетеді.

Шаперондардың кейбір сипаттамасы 1. Көптеген ағзаларда болады: бактериядан адамға дейін; 2. Көбісі жылылық шокты ақуыз деп атайды (hsp) ; 3. Қайтадан синтезделінген ақуыздарды денатурациялау жағдайы кезінде кейбіреулері себепші болады. 4. Олар жазылған және оралған ақуыздармен байланысады; 5. Көптеген шаперондар АТР-азды белсенділікпен АТР немесе АДР-тартатын, ақуыз-шаперонмен өзара көмектесе әрекет жасауға ие болады; 6. Әртүрлі клеткалар бөліктерінде: цитозоль, митохондрия, ЭПР қуысында табылады.
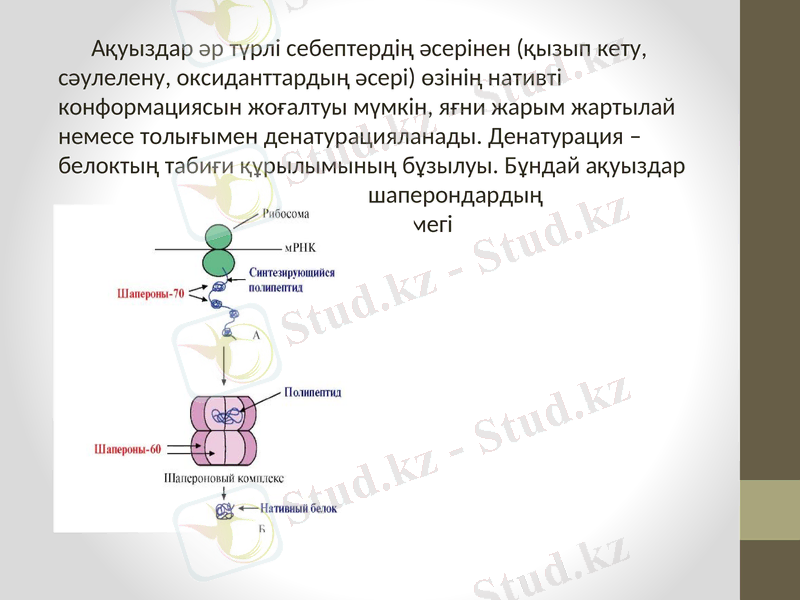
Ақуыздар әр түрлі себептердің әсерінен (қызып кету, сәулелену, оксиданттардың әсері) өзінің нативті конформациясын жоғалтуы мүмкін, яғни жарым жартылай немесе толығымен денатурацияланады. Денатурация - белоктың табиғи құрылымының бұзылуы. Бұндай ақуыздар шаперондардың белсенді көмегі кезінде рефолдингке немесе ренатурацияға ұшырауы мүмкін. Егер клетка ұзақ стрессті жағдайда болса, шаперондардың синтезі артады.

Ақуыздарды, клетка ішілік тасымалдауының кейбір түрлеріне шаперондар қатысады (лизосомаларда, митохондрияда) . Лизосомаларға, өзінің мезгілін өтеген және рефолдингке берілмейтін ақуыздар түседі. Митохондрияларға жаңадан синтезделген ақуыздар апарылады. . Мида конформациясы дұрыс емес прионды ақуыздар бар, бірақ кейбір ауруларда оның конформациясы өзгереді және бұл ақуыз - прион немесеақуызды жұқпалы бөлшек деп аталады. Приондар, конформациясын өзгертуге мәжбүр етеді және басқа ақуыздар, яғни антишаперондар ролін атқарады және фолдингті керісінше өткізеді.

Нәтижесінде, бірнеше жылдан соң адамды немесе жануарды өлімге әкелетін ауру жетіледі. Көптеген жасушаішілік ақуыздарда олардың бір-бірімен бірігіп әсер ететін, «серіктестерінің» саны аз, бір ғана болуы да мүмкін. Мысал ретінде, рецептор және оның лигандаларын жатқызуға болады, олар бір-бірімен кілт және құлып сияқты сәйкес келеді. Басқа рецептор типтеріне бұл лигандалар сәйкес келмейді, және әрбір рецептор өзіне құрылым жағынан жақын лигандаларын немесе заттарын белсендіреді. Бұдан шаперондардың ерекшелігі әртүрлі жұмыстарды орындауы үшін, ақуыздың кең айналымымен әсерлеседі.
Мысалы, жаңатүзілген аминқышқылдары тізбегінің дұрыс кеңістіктік конфигурацияны қабылдауға көмектеседі, зақымданған ақуыз малекулаларын жинақтайды, ақуыздарды әртүрлі қауіптерден қорғай отырып керек орындарға тасымалдайды.
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz