Атомның кванттық-механикалық моделі, кванттық сандары және периодтық жүйедегі s, p, d элементтері



ПРЕЗЕНТАЦИЯ
Тақырыбы: Атомның кванты - механикалық моделі. Квант сандары. ПЖ құрылысы: периодтар, топшалар, s, p, d - элементтер.

Жоспар
Кіріспе;
Негізгі бөлім;
Атом құрылысының квант-механикалық моделі
Электрондық бұлт туралы түсінік. Кванттық сандар
Химиялық элементтердің периодтық жүйесі
Период
Топтар
S-, d-, p-, элементтерінің жалпы сипаттамасы
Қорытынды;
Қолданылған әдебиеттер.

Кіріспе
Кванттық механика, толқындық механика - микробөлшектердің (элементар бөлшектердің, атомдардың, молекулалардың, атом ядроларының) және олардың жүйелерінің (мысалы, кристаллдардың) қозғалу заңдылықтарын анықтайтын, сондай-ақ, бөлшектер мен жүйелерді сипаттайтын физикалық шамаларды макроскопиялық тәжірибеде тікелей өлшенетін шамалармен байланыстыратын теория.
Ол өрістің кванттық теориясында, кванттық химияда, кванттық статистикада, т. б. қолданылады. Кванттық механика бейрелятивистік (жарық жылдамдығымен салыстырғанда төмен жылдамдықтағы с) және релятивистік (жарық жылдамдығымен салыстыруға болатын жоғары жылдамдықтағы с) болып бөлінеді.

Атом құрылысының квант-механикалық моделі
1933ж Нильс Бор Резерфордтың моделімен Планктың теориясын қолданып, атом моделінің құрылысын жасады. Атом құрылысы квант - механикалық теориясының ережелер:1. Электронның екі жақты табиғаты ( бөлшектік-корпускулалық және толқындық ) болады. Ол өзін бөлшек ретінде де, толқын ретінде де ұстай алады:бөлшек ретінде, электронның белгілі массасы мен заряды бар; мұнымен қатар қозғалыстағы электрон толқындық та қасиет көрсетеді, мәселен дифракцияға қабілеттілігімен сипатталады.


2. Электрон үшін координат пен жылдамдықты бірден, бір сәтте дәл өлшеу мүмкін емес. Жылдамдықты неғұрлым дәл өлшенген сайын, соғұрлым координатта белгісіздік болады және керісінше. 3. Атомдағы электрон белгілі траектория бойынша қозғалмайды, ядро маңындағы кеңістіктің кез келген бөлігінде бола алады, алайда оның атом кеңістігінің әртүрлі бөлігінде болу ықтималдылығы бірдей емес. Ядро айналасындағы электронның болуының ықтималдығы ең жоғары кеңістік атомдық орбиталь д. а.

Электрондық бұлт туралы түсінік. Кванттық сандар
Электронда теріс заряд болатындықтан, оның орбиталі зарядтың белгілі бір таралуын электрондық бұлт д. а. Электрон бұлты─атомдағы электронның кванттық механика тұрғысынан қарағандағы моделі. Орбиталь электрондық бұлттың формасын сипаттайды. Ядроның маңайындағы электрон бұлтының тығыздығы әртүрлі болады. Электронның болу мүмкіндігі дәлірек болатын кеңістікте электрон бұлтының тығыздығы да жоғары болады. Электрон бұлттары бір-бірінен өздерінің энергия мөлшері, пішіндері және кеңістікте орналасу бағыты арқылы ажыратылады. Э. Шредингер теңдеуі арқылы электрон қозғалысының ең маңызды сипаттамаларының бірі-оның толқындық функциясы анықталады. Әр элементтің атомы ядро зарядымен және саны соған тең электрондармен сипатталады, ал бұл электрондар микробөлшектер болғандықтан, олардың күйін төрт квант саны өрнектейді:


Бас квант саны (n) -электронның энергиясы мен орбитальдың өлшемін анықтап, энергетикалық деңгейді сипаттайтын шама. n=1, 2, 3, 4, 5. Оның мәні жоғары болса, энергиясыда жоғары болады. Энергетикалық деңгей-бас квант санының бірдей мәні бар орбитальдардың жиынтығы. Орбитальдық квант саны (l) -энергетикалық деңгеидің деңгейшесінде орналасқан электронның энергиясын сипаттайтын ж\е электрондық бұлт пішінін анықтайтын шама. Энергетикалық деңгейше-бір энергетикалық деңгейде болатын ж\е бірдей формадағы орбитальдардың жиынтығы. l=0 шар тәрізді(s-деңгей), l=1гантель формалы(p-деңгей) . Магнит квант саны (Ml) -сыртқы магнит өрісінің әсерінен орбитальдардың кеңістікте орналасуын және деңгейдегі орбиталдардың санын анықтайтын шама. -1, 0, +1 бүтін сандар мәнін қабылдайды. Спин квант саны (Ms) -электронның өз өсінің айналасында айналуын сипаттап, тек қана екі мәнді қабылдай алатын шама. (+1/2және1/2)

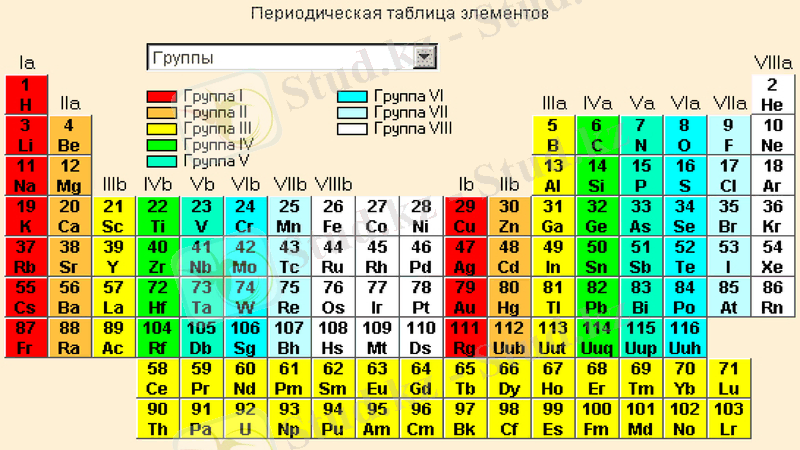
Химиялық элементтердің периодтық жүйесі
Химиялық элементтердің периодтық жүйесі (Менделеев кестесі) - Элементтердің әртүрлі қасиеттерінің атом ядросы зарядына тәуелділігін белгілейтін химиялық элементтердің жіктелу реті.

Жүйе атақты орыс химигі Д. И. Менделеевтің 1869 жылы ашқан периодтық заңының графикалық түрде бейнеленуі болып табылады. Оның бастапқы нұсқасын Д. И. Менделеев 1869-1871 жылдары шығарған еді және бұл нұсқасында элементтердің қасиеттерінің олардың атомдық салмағына (қазіргіше, атомдық массасына) тәуелділігін көрсеткен еді.

Периодтық жүйені суреттеудің (аналитикалық қисық сызықтар, кестелер, геометриялық фигуралар, және т. с. с) барлығы бірнеше жүздеген (кітабында 400-ден астам деп айтылады) нұсқасы ұсынылған. Жүйенің қазіргі кездегі нұсқасында элементтерді екіөлшемді кестеге жинақтау қарастырылады. Мұндағы әрбір бағана (периодтық жүйенің тобы) негізгі физико-химиялық қасиеттерді анықтаса, қатарлар периодтық жүйенің периодын құрайды және белгілі мөлшерде бір-біріне ұқсас боп келеді. Периодтық жүйенің бірнеше түрі бар.

Период
Период деп сілтілік металдан басталып инертті газбен аяқталатын элементтер тобын айтады. Периодтар горизонталь қатардан тұрады. Периодтық жүйеде 7 период бар, олар рим сандарымен белгілеген, I, II және III периодтар бір қатардан тұрады және кіші периодтар деп аталады, ал IV, V, VI, VII периодтар екі қатардан тұрады, оларды үлкен периодтар деп атайды. Бірінші периодта-2 элемент, екінші және үшіншіде-8-ден, төртінші мен бесіншіде-18-ден, алтыншыда-32, жетіншіде(аяқталмаған) -32 элемент бар. Әрбір период, біріншіден басқасы, сілтілік металдан басталып, инертті элементпен аяқталады.

Әр периодта 2, 8, 18, 32 элемент болады.
Бірінші периодтың ерекшелігі - онда екі элемент қана Н, Не орналасқан. Сутектің сілтілік металдарға да, галогендерге де ұқсайтын ортақ қасиетіне байланысты оны көбіне Іa кейде VІҚа топшаға да орналастырады.

Екінші периодтта 8 элемент ( Lі - Ne) бар. Ол сілтілік металл литийден Lі басталады, одан кейінгі ІІ валентті Ве металл, ал ІІІ валентті В элементтінің металдық қасиеті кеміп, ІV валентті көміртектен бейметалдар басталады, олардың (N, О, F) тотығу дәрежелері теріс. Период инертті газ - неонмен (Ne) аяқталады.

Үшінші периодта да 8 элемент орналасқан (Na - Ar) . Олардың қасиеттерінің өзгеру сипаты екінші период элементтеріне ұқсас, дегенмен Mg-мен Al-дің Ве-мен В-ға қарағанда металдық қасиеті басымдау, сондай-ақ бейметалдар - P, S, Cl-дың екінші периодтағы “ұқсастардан” айырмашылығы олар өздеріне тән ең жоғары оң валенттіктерін көрсете алады. Менделеев 2 және 3-период элементтерін типтік элементтер деп атаған, себебі олардың бәрі де табиғатта кең таралған.

Алғашқы 3 периодтың элементтері негізгі топшаларға (а) ғана кіреді. Қазіргі технологиялар бойынша бұл периодтардың алғашқы екі элементі (сілтілік және сілтілік-жер металдар) Қа-, ІҚа- топшаларды құрайтын s-элементтерден тұрады (кестеден қызыл түске боялған), қалған алтауы (B - Ne, Al - Ar) ІІҚа, VІІҚа-топшаларды құрайтын р-элементтерден тұрады (кестеде сары түсті) . Кіші периодтар деп аталған бұл үш период элементтерінің рет нөмірі артқан сайын атом радиустары кішірейіп, кейінгі атомның сыртқы қабығындағы электрондар саны көбейгенде, олардың өзара ығысуының күшеюінен атом радиустары ұлғая бастайды. Ең үлкен радиус периодтың басында орналасқан сілтілік металға тән. Осындай заңдылық иондар радиусының өзгеруінен де байқалады.

Төртінші периодта 18 элемент бар ( К - Кr), ол - үлкен периодтардың алғашқысы. Мұнда сілтілік және сілтілік-жер металдардан кейін ауыспалы деп аталатын 10 элемент (Sc - Zn) орналасады. Бұларды d - элементтер деп атайды (кестеде көк түсті), олар да қосымша топшаларға кіреді. Ауыспалы элементтер түгелдей металдар, Fe - Co - Nі триадасынан басқасы өздеріне тән ең жоғары валенттіктерін көрсетеді. Соңғы алты p-элементтер (Ga - Kr) негізгі топшаға (a) кіреді, қасиеттерінің өзгеруі бұрын айтқан ІІ және ІІІ период элементтеріне ұқсас.

Бесінші периодта 18 элемент (Rb - Xe) бар, құрылысы төртінші периодқа ұқсас. Одан айырмашылығы ауыспалы элементтер де, ксенон да (Xe) өзіне тән ең жоғары оң валенттіктерін көрсете алады. Соңғы галоген - иодта аздаған металдық қасиет пайда болады.

Алтыншы периодта 32 (Cs - Rn) элемент бар. Онда ауыспалы 10 элементпен (La, Hf - Hg) қатар 14 f - элементтер, лантаноидтар (кестеде жасыл түсті) орналасқан.
Жетінші периодта да францийден (Fr) басталатын 32 элемент болуға тиісті, бірақ ол әлі аяқталмаған (12 элемент әлі табылған жоқ) .

Топтар
Тігінен орналасқан элементтердің қатарын топтар деп атайды. Периодтық жүйеде сегіз топ бар, олардың нөмері рим сандарымен белгіленген. Топ нөмері элементтің ең жоғарғы тотығу дәрежесіне сәйкес келеді. Фтордың тотығу дәрежесі әрқашан -1-ге тең, мыс, күміс, алтынның тотығу дәрежелері +1, +2, +3-ке тең, ал VIII топ элементтерінен +8 тотығу дәрежесі тек осмий, рутений, ксенонға тән.
Әрбір топ-негізгі(A) және қосымша (Б) деп екі топшаға бөлінеді. Негізгі топшаны табиғи ұялас элементтер құрайды; оған типтік элементтер (II және III период элементтері) және химиялық қасиеттері соларға ұқсас үлкен периодтардың элементтері кіреді. Қосымша топшаны үлкен периодтың элементтері -металдар ғана құрайды.

VIII топ қалған топтардан ерекшеленеді. Инертті газдарың негізгі топшасынан басқа, онда үш қосымша топша бар: темір топшасы, кобальт топшасы, никель топшасы, оларда көлденіңінен алғанда триада деп атайды, мәселен, темір триадасы: Fe, Co, Ni.
Негізгі және қосымша топша элементтері химиялық қасиеттерімен ерекшеленеді. Мысалы, VII топтың негізгі топшасын бейметалл галогендер:F, Cl, Br, I, At, ал қосымша топшасын металдар:Mn, Tc, Re Топшалар өзара ұқсас элементтерді біріктіреды.

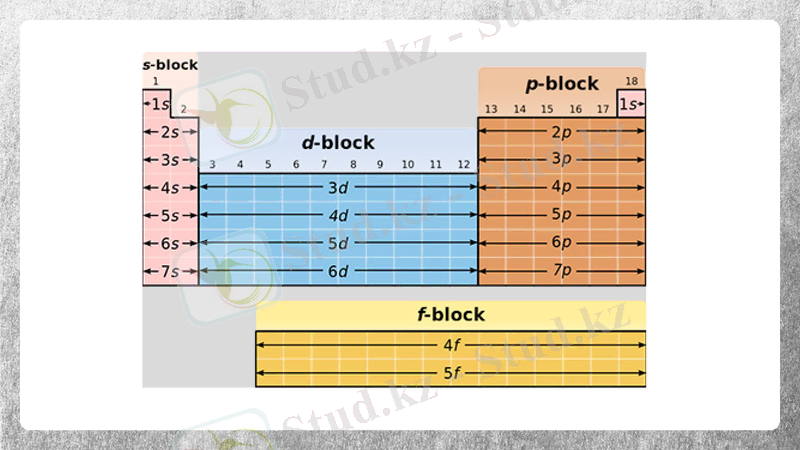
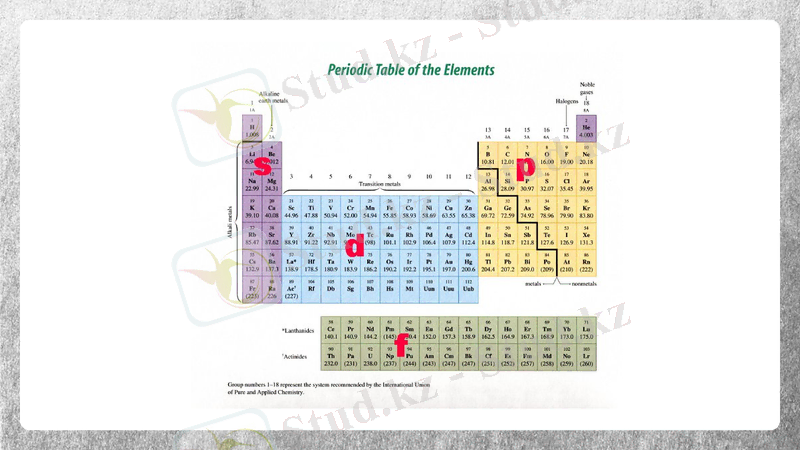
S-, d-, p-, элементтерінің жалпы сипаттамасы
S- электронның сыртқы қабатында 1 н/е 2 элемент. Топтарда иондар радиусы жоғарыдан төменге қарай.
Р-элементтерге Д. И. Менделеевтің периодтық жүйесінің 3А-8А топтарында орналасқан элементтер жатады.
d- элементтер. Преиодтық жүйеде 33 элементі бар.

І А тобының S элементтері
Сутек. Биосферада сутек бос күйінде кездеспейді. Ол табиғи су, газдар және органикалық заттардың құрамында болады. Тірі жасушалар массасының 90 пайызын құрайтын суда сутегі атомдарының негізгі мөлшері болады. .
Сутегінің екінші бір қосылысы- сутегінің асқын тотығы Н2О2 ағзада әртүрлі тотығу- тотықсыздану процестері нәтижесінде зат алмасудың қосымша өнімі ретінде түзіледі, каталаза ферменттерінің әсерінен ыдырайды:
Н2О2 Н2О+1/2 О2

ІА тобындағы S-элементтер негізінде жасалған дәрілік препараттар медицинада қолданылады.
1. Литий карбонаты- әртүрлі жүйке ауруларын емдеуде қолданылады.
2. Натрий хлориді- дәрілік заттарды еріту үшін т, б,
3. Гипертоникалық ерітінділер іріңді жараларды емдеу үшін қолданылады.
4. Натрий иодиді- эндемиялық жемсау ауруында қолданылады.
5. Калий хлориді- ағзада электролит алмасуы бұзылғанда, сонымен қатар жүрек соғысы бұзылғанда қолданылады. .

Р-элементтердің медико-биологиялық маңызы, медицинада қолданылуы.
Бор. Тірі ағзадағы бор қосылыстарының биологиялық маңызы зерттелмеген.
Медицинада қолданылуы:
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz