Биологиялық жүйелердегі осмостық қысым және жасушалық құбылыстар: Вант-Гофф пен Рауль заңдары



ПРЕЗЕНТАЦИЯ
Тақырыбы: Биологиялық жүйедегі осмос қысымының рөлі. Плазмолиз, гемолиз, тургор. Гипо-, изо-, және гипертонды ерітінділер.

Жоспар
Кіріспе
Негізгі бөлім
1. Биологиялық жүйедегі осмос қысымының рөлі.
2. Рауль заңы.
3. Плазмолиз, гемолиз, тургор.
4. Гипо-, изо-, және гипертонды ерітінділер
Қорытынды
Қолданылған әдебиеттер

Осмос - еріткіш молекулаларын өткізіп, еріген затты өткізбейтін жартылай өткізгіш қабық (осмометр) арқылы еріткіштің қозғалысы. Осмостың классикалық үлгісі төмендегі суретте осмометрдің қант ерітіндісін таза судан бөлуі ретінде көрсетілген. Ерітіндідегі су концентрациясы таза суға қарағанд төмен. Таза еріткіш жағынан алғанда мембрана арқылы су молекуласының диффузиясы ерітіндідегі су концентрациясын мембрананың екі жағынан да теңестіруге тырысуда. Алайда концентрацияларда өзгешелік бар кезде мембрана екі жағынан да осмостық қысымға түседі.
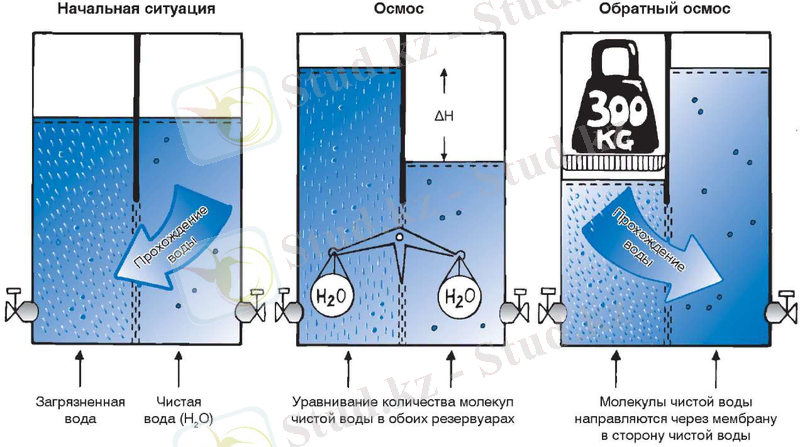

Сыртқы ыдыстағы еріткіш пен осмометрдегі ерітінді арасында тепе теңдік күй орнайды. Мұндай тепе теңдік ке сәйкес келетін қысымды осмостық қысымы деп аталады. Осмос қысымы - осмосты тоқтату үшін ерітіндіге түсірілетін қысым. Сонымен осмос қысымы деп ерітіндіні еріткішпен тепе теңдік күйде ұстап тұру үшін осмометр ішіндегі ерітіндіге түсірілетін қысым.

Еріткіш молекулаларының жартылай өткізгіш өткел арқылы жүйедегі еріген заттың концентрациясы төмен бөлігінен жоғары бөлігіне өздігінен өтү (диффузия) процессін осмос деп атаймыз.
Осмос құбылысын бақылау үшін қарапайым осмометр деп аталатын құрал қолданылады. Осмостық қысым мен концентрацияны байланыстырған Вант-Гофф заңы. Оны 1887 жылы ашты. Ерітінділер мен қышқылдарда осмос қысымы әртүрлі болып табылады

Осмос салдарынан ішкі ыдыстағы ерітінді көлемі ұлғаяды. Ерітінді көлемінің ұлғаюын тоқтату үшін ішкі ыдыстағы ерітіндіге сырттан қосымша қысым түсіру қажет. Осмосты тоқтату үшін ерітінді үстіне түсірілген қосымша қ Рауль заңы - ерітінді бетіндегі қаныққан бу қысымының салыстырмалы төмендеуі, еріген заттың мольдік үлесіне тең.

Раульдің (1) заңының салдары: еріткіштің ерітіндіден кристалдану температурасының төмендеуі ерітіндінің молялдығы мен еріткіштің криоскопиялық константасына тура пропорционал. Рауль (2) заңының салдары: еріткіштің ерітіндімен салыстырғанда қайнау температурасының жоғарылауы ерітіндінің молярдығы мен еріткіштің эбулиоскопиялық константасына тура пропорционал қысым осмос қысымы деп аталады.

Осмостың биологиялық маңызы; изотондық ерітінділер-осмостық баланстық бұзылуын болдырмау үшін тамыр арқылы егуге; глаубер тұзы және ащы тұз -ішті жүргізетін препараттар ретінде; дәкеден жасалған гипертонды танғыштар мен ауырғанда күре тамыр арклылы егуге қолданылады.
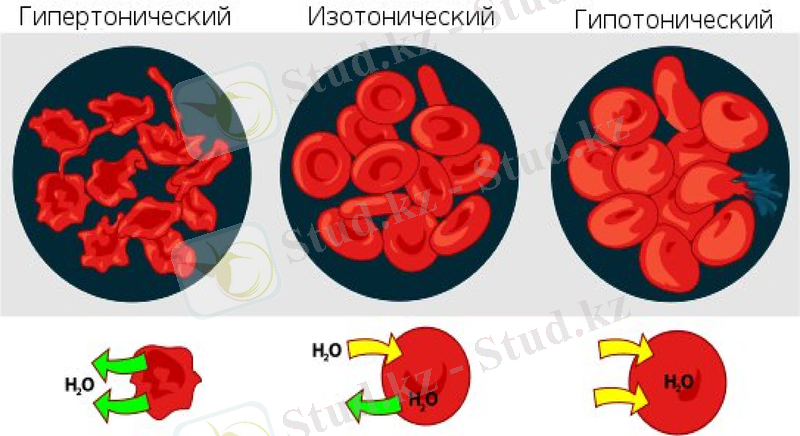
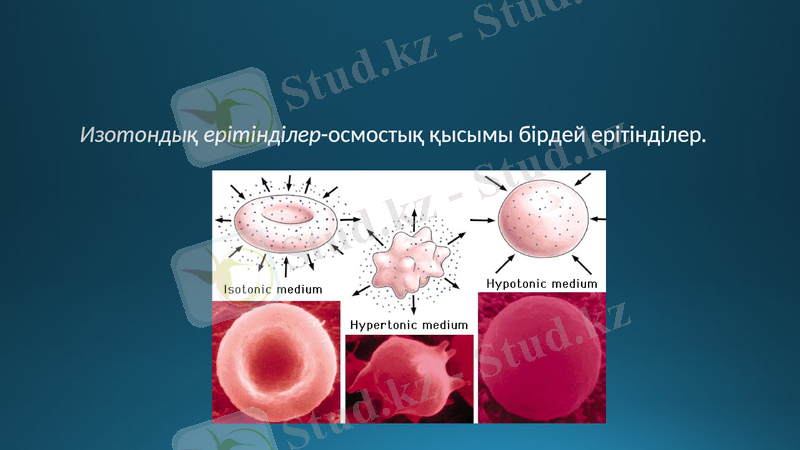
Изотондық ерітінділер-осмостық қысымы бірдей ерітінділер.
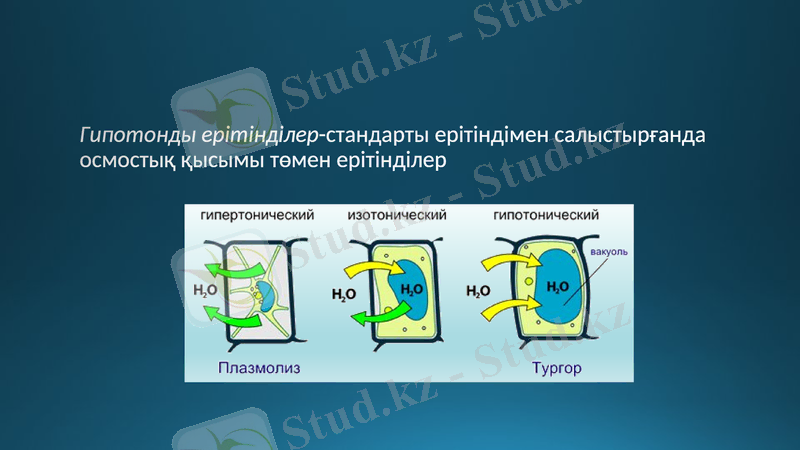
Гипотонды ерітінділер-стандарты ерітіндімен салыстырғанда осмостық қысымы төмен ерітінділер
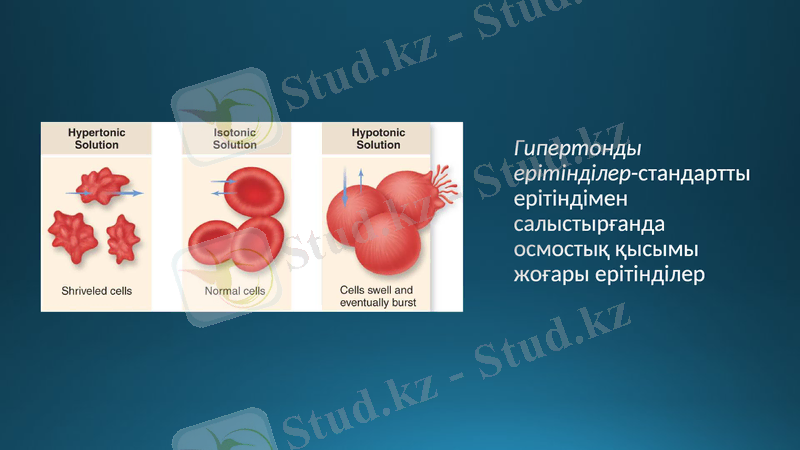
Гипертонды ерітінділер-стандартты ерітіндімен салыстырғанда осмостық қысымы жоғары ерітінділер

Гемолиз-жасушаны гипотонды ерітіндіге салғанда жасушаның ісіну құбылысы
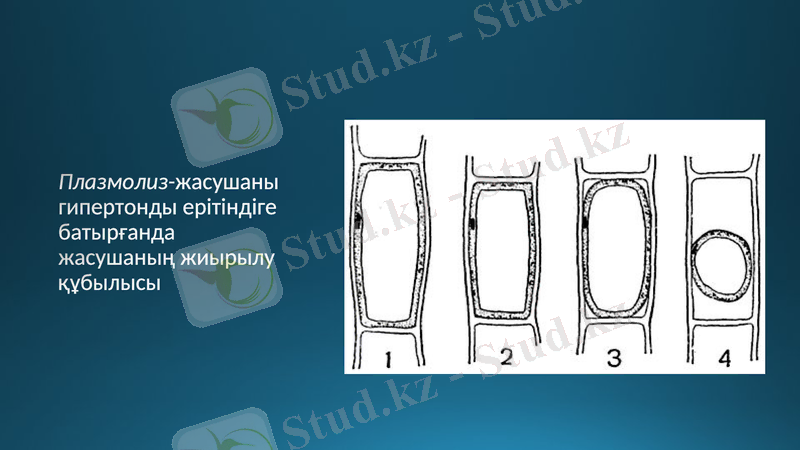
Плазмолиз-жасушаны гипертонды ерітіндіге батырғанда жасушаның жиырылу құбылысы
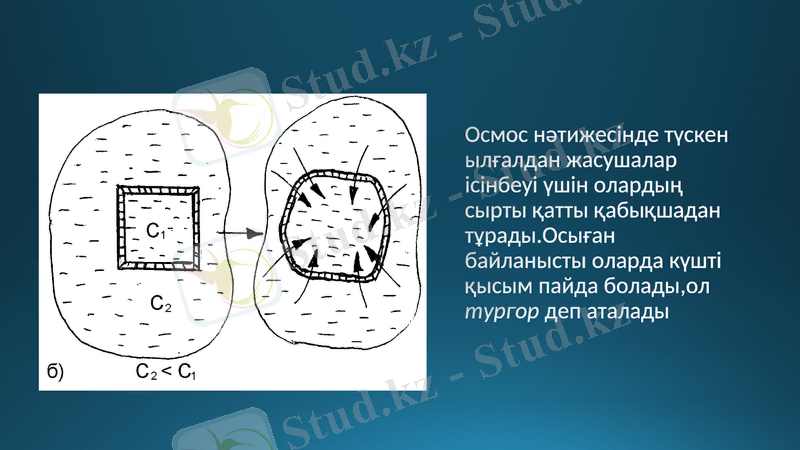
Осмос нәтижесінде түскен ылғалдан жасушалар ісінбеуі үшін олардың сырты қатты қабықшадан тұрады. Осыған байланысты оларда күшті қысым пайда болады, ол тургор деп аталады

Қорытынды
Жартылай өткізгіш мембрана арқылы төмен концентрациялы ерітіндіден жоғары ерітіндіге еріткіш молекулаларының біржақты өздігінен жүретін диффузиясы осмос деп аталады. Осмос процесі өте күрделі және оның табиғаты осы күнге дейін жеткілікті зерттелмеген, осмос құбылысын арнаулы аспаптарда осмометрлерде бақылауға болады. Осмосты тоқтату үшін ерітіндіге таңуға қажетті гидростатикалық қысымды осмос қысымы деп атайды.

Осмос қысымы Па немесе Ньютон 1м2 пен өлшенеді. осмостық қысым ерітіндіде еріген зат болғандықтан, еріткіштің химиялық потенциалы төмендеуіне байланысты болады. Барлық жүйелер өзінің бүкіл көлемінің барлық бөліктерінде химиялық потенциалдарын теңестіріп, бос энергияның төмен мәнді күйіне өтуге ұмтылады. Осмос қысымы бірінші кезекте ерітіндінің концентрациясына байланысты болады.

Қолданылған әдебиеттер
Патсаев Ә. Қ, Мамытова В. К, Нарманов М. М, Серимбетова Қ. М Бейорганикалық химия пәні бойынша студенттердің өзіндік жұмысына арналған Шымкент 2005ж
Глинка Н. Л «Общая химия» Л., Химия 1984
Угай Л. Л «Общая химия» М., ВШ 1997
Оганесян Э. Т «Неорганическая химия »М., ВШ 1987
Патсаев А. Қ, Мамытова В. К «Руководство к лаборатор-но-практическим занятием» Шымкент2003г
Т. Браун, Г. Ю Лемей «неорганическая химия» М, ВШ, 1981
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz