Жеке ақуыздардың құрылысы: домендік және фибриллярлы ақуыздардың ерекшеліктері мен биологиялық маңызы



ПРЕЗЕНТАЦИЯ
Тақырыбы: Жеке ақуыздар құрылысының ерекшеліктері. Доменді және фибриллярлы ақуыздардың құрылысының ерекшеліктері және биологиялық маңызы.

Жоспар
Кіріспе;
Негізгі бөлім;
Ақуыздардың құрылымдык элементтері;
Ақуыз молекуласының құрылымы
Глобулярлы және фибриллярлы ақуыздар;
Линдерстрем және Лангенің ұсынысы;
Қорытынды;
Қолданылған әдебиеттер.

Кіріспе
Тірі ағзалардың негізгі құрамды бөлігі ақуыз болып табылады. Ақуыз дегеніміз - барлық тірі организмдердің құрамына кіретін заттардың ішіндегі ең маңызды биологиялық макромолекулалар. Клетканың құрғақ массасының 50%-ы ақуыздар болады. Ақуыздар клетканың тіршілік процестерінде әр түрлі маңызды қызметтер атқарады. Мысалы: ақуыздар клетка мембранасының құрамында рецептор ретінде қызмет атқарады, бұлшық еттің жиырылуына қатысады, организмнің иммундық жүйесінде антиденелер ретінде қорғаныштык қызмет атқарады.
Ақуыздар органикалық заттар дамуының ең жоғарғы сатысы және жер бетіндегі тіршіліктің негізі. Организмнің тірек, бұлшық ет, жамылғы тканьдері ақуыздардан құралған. Олар организмде әр түрлі қызмет атқарады, химиялық реакцияларды жүргізеді, дене мүшелерінің қызметтерін өзара үйлестіреді, аурулармен күреседі, т. б.

Ақуыздардың құрамы мен құрылысы өте күрделі. Молекулалық массалары жүздеген мыңнан миллионға дейін жетеді. Төрт түрлі құрылымы болады. Олардың құрылымы бұзылса, денатурацияға ұшырап, организмдегі қызметін атқара алмайды. Ақуыздар гидролизденіп, аминқышқылдарын түзеді және өздеріне тән түсті реакциялары бар. Ақуыздар азықтың құрамына кіреді. Адам тәулігіне шамамен, - 100 г белок қабылдауы керек. Азықпен түскен ақуыз әуелі асқазанда, сосын ішектегі ферменттердің әсерінен гидролизденіп, аминқышқылдарына дейін ыдырайды. Ақуыз тірі организмнің негізін құрайды, онсыз өмір жоқ. Сондықтан Фридрих Энгельс: «Тіршілік - ақуыз заттарының өмір сүру формасы» - деп үйретеді.
Көгілдір спираль - Миоглобин ақуызының 3D-құрылымы, қызыл түспен оттегі молекуласы, сұр түспен Гем тобы белгіленген.

Ақуыз тек тірі организмдер құрамында ғана болады. Оның құрамында 50, 6 - 54, 5% көміртек, 21, 5 - 23, 5% оттек, 6, 5 - 7, 3% сутек, 15 - 17, 6% азот, 0, 3 - 2, 5% күкірт бар, кейде фосфор кездеседі. Осы элементтерден түзілетін амин кышқылдарының бір-бірімен байланысып қосылуы нәтижесінде ақуыз молекуласы түзіледі. Ақуыздар туралы алғашқы мәліметтер 18 ғасырдан белгілі. 1745 ж. италиялық ғалым Беккори бидай ұнынан лейковина деген белокты бөліп шығарған. 19 ғасырдың 30-жылдарында ет, жұмыртқа, сүт, өсімдік тұқымдарында ақуыздық заттар бар екені анықталды. Ғалымдардың содан бергі зерттеулері нәтижесінде барлық тірі организмдер клеткасында болатын тірі материя - протоплазма, негізінен, ақуыздан құралатыны анықталды.

Ақуыздардың құрылымдык элементтері
Ақуыздардың молекулалық салмағы 5-нан бірнеше миллион дальтонға дейін жетеді. Ақуыздардың құрылымдық элементтері, "құрылымдық бөліктері" - α-аминқышқылдары. Ақуыздардың құрамында аминқышқылдарынан басқа да заттар кездеседі. Бұл ақуыздық емес заттар простетикалық топтар деп аталады. Простетикалық топ ретінде металдардың атомдары, фосфат топтары, липидтер, көмірсулар, нуклеин кышкылдары болуы мүмкін. Ақуыз молекуласының ең маңызды құрылымдық элементтері - аминкышқылдары.

Аминқышқылдары
Аминқышқылдары - бұл органикалық бифункционалды қосылыстар. Олардың молекуласына карбоксил (СООН) және амин (NH2) топтары кіреді.
Аминқышқылдары бір - бірімен пептидті деп аталатын ковалентті амидті байланыс арқылы қосылған: Аминқышқылдар бір-бірімен пептидті байланыс арқылы қосылған қосылыстар пептидтер деп аталады, мысалы, дипептидтер, трипептидтер, тетрапептидтер және т. б. Аминқышқылдарының көптеген қалдықтарынан тұратын қосылыстар полипептидтер деп аталады:
Ақуыздардың құрамында 20 негізгі аминқышқылдары және бірқатар олардың туындылары табылған:

1 . Моноаминомонокарбонды:
-алифатты: глицин, аланин, валин, лейцин, изолейцин,
-ароматты: фенилаланин, тирозин, триптофан,
-гидроаминқышқылдары: серии, треонин,
-құрамында күкірт бар : цистеин, метионин.
2. Моноаминодикарбонды: аспарагин қышқылы, глутамин қышқылы.
З. Дикарбонды аминқышқылдарының амидтері:аспарагин, глутамин.
4. Диаминомонокарбонды: лизин, аргинин, орнитин, гистидин
5. Иминқышқылдар: пролин, гидроксипролин.
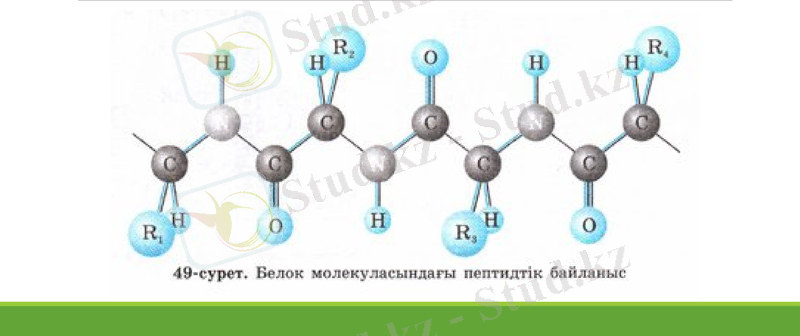

Ақуыздың құрамына 20 түрлі α - аминқышқылы кіреді, соның ішінде 19 - α аминқышқылы және 1- аминқышқылы.
Аминқышқылдарының физикалық - химиялық және биологиялық қасиеттерінің ерекшелігі - ол бүйірлік топтардың құрамына тәуелді. Аминқышқылдары топтарының құрамына байланысты 3 топқа жіктеледі:
1) полярсыз (гидрофобты) алифаттық және ароматтық топтары бар аминқышқылдары;
2) полярлы бейтарап (зарядталмаған) топтары бар аминқышқылдары;
3) полярлы зарядталған ( иондық) топтары бар аминқышқылдары.
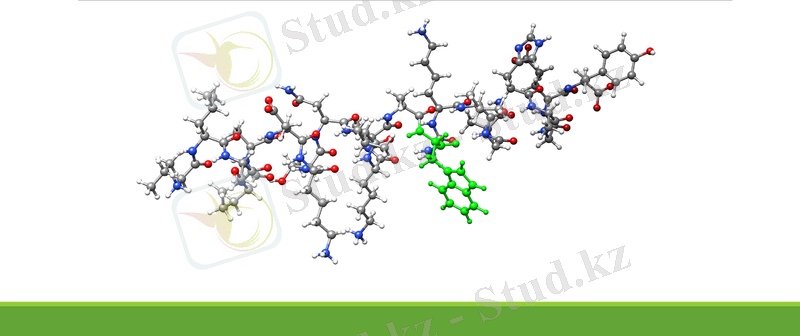

Ақуыз молекуласының құрылымы
Құрылым, құрылыс (лат. structura - структура, құрылым, орналастыру) дегеніміз - молекулада әр түрлі атомдардың өзара реттеліп орналасуы және олардың арасындағы байланыс түрі.
Тір организмдегі ақуыз молекуласының әрқайсысының өзіне ғана тән белгілі - бір кеңістік құрылымы болады. Ондай кеңістік құрылымды конформация деп атайды.
Конформация (лат. conformation -пішін ) - дегеніміз дара байланыс арқылы айналғанда түзілетін органикалық молекуланың әр түрлі кеңістік пішіні.

Глобулярлы және фибриллярлы ақуыздар
Ақуыз пішініне сәйкес екі топқа бөлінеді:
1 . глобулярлы ақуыздар;
2 . фибриллярлы ақуыздар.
Глобулярлы ақуыздардың құрылымы шағын ғана, олардың полипепдидтік тізбектері сфера және эллипсоид сияқты тығыздала бүктелген болады. Ақуыз глобуласының бетіне негізінен амин қышқылдарының полярлы тобы және зарядталған атомдары жинақталады. Олар сумен әрекеттесуге қабілетті келеді. Глобулярлы ақуыздардың көпшілігі суда және су ерітінділерінде ериді. Мұндай ақуыздарға барлық ферменттер, қанның, сүттің ақуыздары ( альбуминдер, глобулиндер және басқалары) жатады.
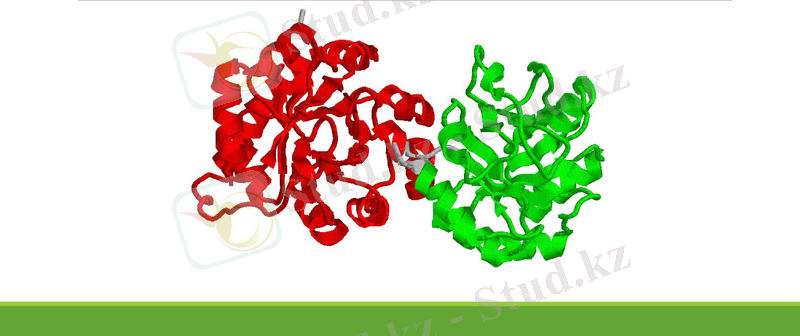

Ақуыз глобуласының ішкі бөлігі полярсыз ортаға жатады, ол гидрофобты және амин қышқылдарының полярсыз қалдықтарынан құралған. Гидрофобты ішкі ядроға су өтпейді, оның сумен байланысы жоқ, тығыз құндақталған.
Фибриллярлы ақуыздар тұрақты келеді. Суда және сұйық тұз ерітінділерінде ерімейді. Ақуыздағы полипептидтік тізбектер белдік (ось) бойында өзара параллель орналасады, сөйтіп ұзын талшықтар - фибриллдер түзеді. Мұндай ақуыздардың молекуласы созылған жіп сияқты, өздері екі одан көп полипептидтік тізбектерден тұрады.
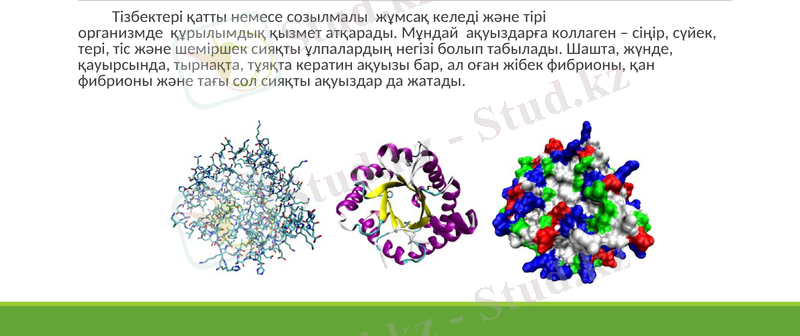
Тізбектері қатты немесе созылмалы жұмсақ келеді және тірі организмде құрылымдық қызмет атқарады. Мұндай ақуыздарға коллаген - сіңір, сүйек, тері, тіс және шеміршек сияқты ұлпалардың негізі болып табылады. Шашта, жүнде, қауырсында, тырнақта, тұяқта кератин ақуызы бар, ал оған жібек фибрионы, қан фибрионы және тағы сол сияқты ақуыздар да жатады.

Линдерстрем және Лангенің ұсынысы
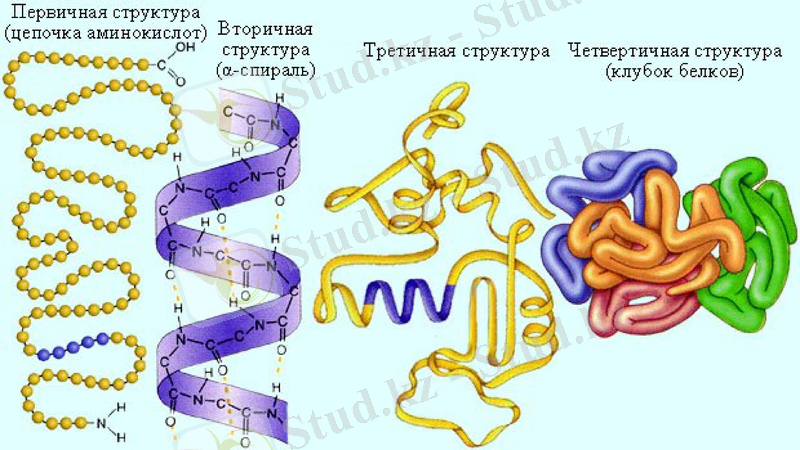
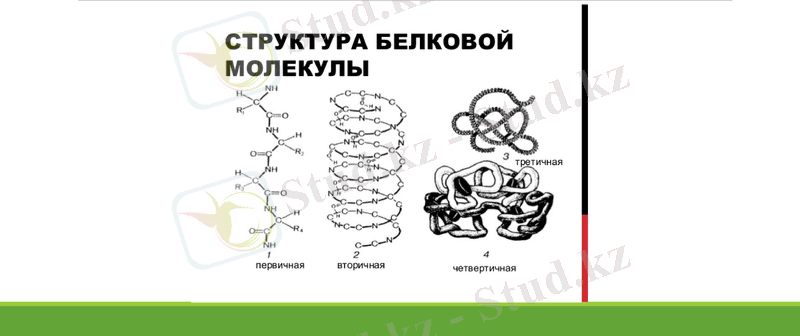
К. Линдерстрем - Лангенің ұсынысы бойынша ақуыз молекуласының құрылымын төрт деңгейге бөледі.
Біріншілік құрылым - бұл ақуыз молекуласының химиялық формуласы, яғни полипептидтік тізбекте амин қышқылдарының белгілі бір ретпен жалғасып орналасуы.
Екіншілік құрылым - полипептид тізбектің спираль тектес орналасуы.
Үшіншілік құрылым - полипептид тізбекте амин қышқылдарының кеңістікте орналасуы.
Төртіншілік құрылым - молекулада суббөлшектердің орналасуы.

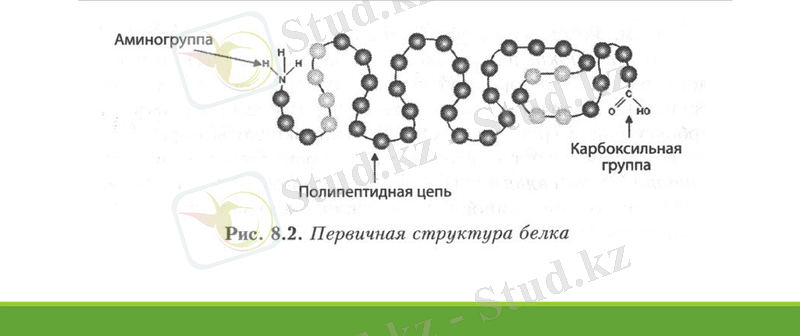
Ақуыздың біріншілік құрылымы дегеніміз - аминқышқылдары белгілі бір тәртіппен өзара пептидтік байланыс арқылы тізбек құрауы. Әр түрлі ақуыздардың құрамындағы амин қышқылдарының түрі де, саны да түрліше болып келуі мүмкін. Ал кейбір ақуыздар құрамындағы амин қышқылдарының саны мен түрі бірдей болуы мүмкін. Бірақ ақуыздың қасиетін, қызметін, оның ерекшелігін анықтайтын - амин қышқылдарының полипептидтік тізбектегі алатын орны болып есептелінеді. Бұл ақуыздардың құрылысы бірінші реттік құрылымы деп аталады. Ақуыздардың бірінші реттік құрылысын берік ковалентті байланыс - пептидтік байланыс құрайды. Полипептид тізбегіндегі аминқышқылының бір қалдығының басқасымен ауысуы немесе оның орнының алмасуы осы белоктың қызметін бұзады. Мысалы, адам гемоглобиніндегі 564 аминқышқылдары қалдықтарынан құралған полипептид тізбегіндегі бір қышқылдың қалдығы екіншісіне ауысса, адам ауыр сырқатқа ұшырайды.

Табиғатта ақуыздардың кейбіреуі тек созылыңқы полипептидтік тізбекте болады. Барлық ақуыздар бір - бірінен полипептидтік тізбектегі аминқышқылдарының саны және құрамымен ғана емес, сонымен қатар ең маңыздысы - аминқышқылдарының кезектілігімен ерекшеленеді. Ақуыз молекуласындағы аминқышқылдарының кезектілігі оның биологиялық қызметін анықтайды. Егер де ақуыздың полипептидтік тізбектегі аминқышқылдарының орналасу реті өзгеретін болса, ол өзінің биологиялық қасиеттері мен қызметтерін жоғалтады. Ақуыздардың бірінші реттік құрылысын зерттеу бірнеше кезеңдерден тұрады:

1. Шеткейлік амин қышқылдарын анықтау (ол үшін карбоксипептидаза ферменті -С- шеткейлік амин кышқылын бөліп алу үшін, ал 2, 4-динитробензол -N- шеттегі амин қышқылын бөліп алу үшін қолданылады) .
2 . Пептидтік тізбекті қысқартып, әрі қарай амин қышқылдық құрамын анықтау үшін ақуызды пепсинмен (тирозин мен фенилаланиннің арасындағы байланысты үзу үшін) өңдейді. Сонан соң, түзілген пептидтерді хроматография әдісімен зерттеуге болады. Бұл әдіс «шыны ыдыстарды сындыру» немесе «саусақтардың ізі» деген әдістермен белгілі.
3 . Осы жолдармен түзілген пептидтерден амин қышқылдары бірін-бірі жабатын пептидтік карталарды қарастырады. Содан кейін, полипептидтік тізбектегі амин қышқылдарының орналасу ретін анықтайды.
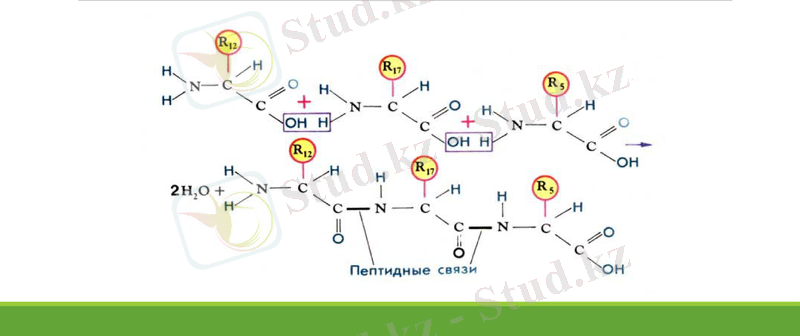

Полипептидтік тізбектің кеңістіктегі орналасуы. Ақуыздардың биологиялық қасиетін жоғалтуы (ферменттік немесе гормондық белсенділігін
жоғалтуы) қаралайым қыздыру кезінде-ақ байқалады. Бірақ, қыздыру кезінде олардың бірінші реттік құрылысының өзгеріссіз қалатындығы анықталды, яғни ақуыздардың өздеріне тән қасиеті, қызметі, олардың кеңістікте орналасуына тәуелді. Ақуыздардың екі түрі бар:
1. Глобулярлы ақуыз - ұзындығы мен енінің қатынасы 1:10, шар тәрізді, жақсы ериді.
2. Фибрилярлы ақуыз - ұзындығы мен енінің қатынасы 1:100, 1:1000, жіп төрізді, ерімейді.

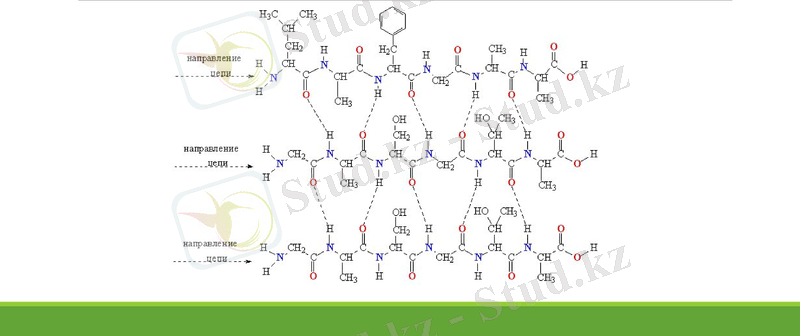
Ақуыздардың кеңістіктегі құрылысы рентген көмегі арқылы анықталған (Полинг, Кори -1950 ж. ) рентген арқылы құрылымдық талдаудың қорытындысы бойынша полипептидті тізбек кеңістікте α-спираль түрінде орналасады.
Спиральдің әрбір қадамы 3, 6-3, 7 амин қышқылы қалдығынан түрады (5, 44 А°) . Спиральдің түзілуі -NH- тобымен -СО- арасындағы сутектік байланысқа тәуелді.
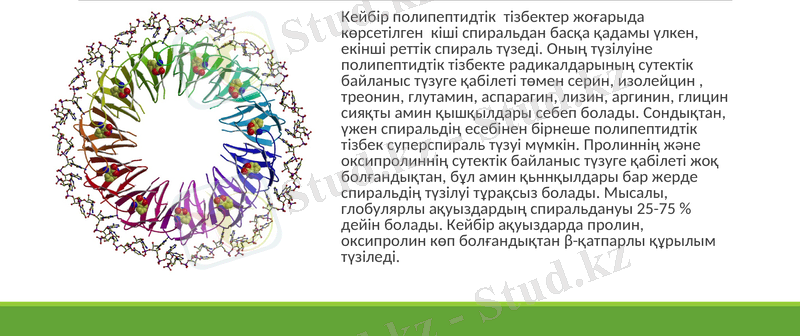
Кейбір полипептидтік тізбектер жоғарыда көрсетілген кіші спиральдан басқа қадамы үлкен, екінші реттік спираль түзеді. Оның түзілуіне полипептидтік тізбекте радикалдарының сутектік байланыс түзуге қабілеті төмен серин, изолейцин, треонин, глутамин, аспарагин, лизин, аргинин, глицин сияқты амин қышқылдары себеп болады. Сондықтан, үжен спиральдің есебінен бірнеше полипептидтік тізбек суперспираль түзуі мүмкін. Пролиннің және оксипролиннің сутектік байланыс түзуге қабілеті жоқ болғандықтан, бұл амин қьннқылдары бар жерде спиральдің түзілуі тұрақсыз болады. Мысалы, глобулярлы ақуыздардың спиральдануы 25-75 % дейін болады. Кейбір ақуыздарда пролин, оксипролин көп болғандықтан β-қатпарлы құрылым түзіледі.

Ақуыздың екінші реттік құрылымы дегеніміз - бұл полипептид тізбегінде жақын орналасқан аминқышқылы калдықтарының кеңістіктік құрылысы. Ең бірінші рет полипептидтік тізбектін екінші реттік құрылымын 1951 жылы Полинг пен Кори зерттеді. Осы зерттеудің нөтижесінде мынадай қорытынды жасады - ақуыз молекуласында екінші реттік құрылымның екі түрі бар - α-шиыршық (спираль) жөне β-катпарлы қабат . Қазіргі күнде спиральдің басқа түрлері табылды . Оң жақты α-спираль. Бұл - L-аминқышқылы қалдықтарынан құрылған полипептидтік тізбектің ең көп таралған ширақталған құрылымы. Әр аминқышқылы қалдығындағы С=0 тобы полипептид тізбегі бойында аминқышқылының үш қалдығынан кейінгі орналасқан аминқышқылының NH-тобымен, төменде көрсетілгендей, сутектік байланыс түзеді. Ондай сутектік байланыстар спиральдың белдігі бойымен бағытталады. Аминқышқылдарының барлык бүйірлік топтары спиральдан тыс орналасады. Спиральдің бір орамы білік бойынша 5, 4 Е. Бір аминкышкылының калдығына 1, 5 Е сәйкес келеді. α-спиральдің бір айналымына 3, 6 шамасындай аминкышкылының калдығы сәйкес келеді, спиральдің әр қадамы - 0, 54 нм (3, 6 х 0, 15 нм) .

Егер де полипептид тізбегі тек қана L-аминқышқылынан немесе аминқышқылынан құрастырылған болса, α-спираль түзіледі. Полипептид тізбегі L-аминкышқылының жене D-аминқышқылының қоспасынан құрылса, онда бұл тізбек α-спиральға ширақталмайды. Коллагеннің полипептидтік тізбегі бұл ақуызға ғана тән спираль түзеді. Сондықтан бүл спиральді коллаген спиралі деп атайды. Коллаген спиралі сол жаққа бұрылған. Бұл - едәуір созылған спираль, бір айналымына үш аминкышкылының калдығы келеді. Полипептид тізбегінің топтарының арасында сутек байланыстар түзілмейді. Бір полипептидтік тізбек тұрақты емес. Коллагеннің үш полипептидтік тізбегі коваленттік, сутектік байланыстар және гидрофобты әрекеттесу арқылы байланысқан. Үш коллаген спиралінен құрылған құрылымды тропоколлаген деп атайды. Тропоколлаген молекуласы өте тұрақты.

β-құрылым (катпарланған жапырақ) - полипептидтік тізбектің екінші реттік кұрылымының екінші түрі. Β -құрылым едәуір созылған полипептидтік тізбектен түзіледі. β-құрылым екі түрлі болады:
қосарланған (параллельденген) β-құрылым - бұл β-құрылымының түрінде екі полипептидтік тізбектің бағыты бір жақты; антипараллельденген - βқұрылым - екі полипептидтік тізбектін немесе бір полипептидтік тізбектің екі бөлігінің бағыты қарсы параллельденген.
β -құрылым полипептидтегі карбонилдік және аминдік топтар арасындағы сутектік байланыс арқылы тұрақтандырылады. β-құрылымының ерекшелігі:
1) полипептидтік тізбек созылған, бірақ толық созылған емес, сондықтан бүрмелі құрылым түзеді;
2) сутектік байланыстар бүрмелінің жазықтығында орналасады;
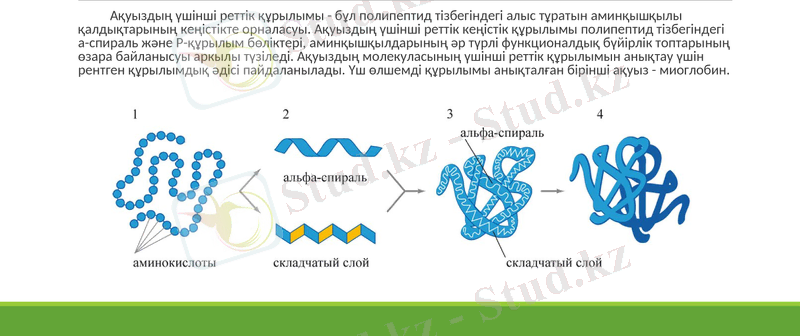
Ақуыздың үшінші реттік құрылымы - бұл полипептид тізбегіндегі алыс тұратын аминқышқылы қалдықтарының кеңістікте орналасуы. Ақуыздың үшінші реттік кеңістік құрылымы полипептид тізбегіндегі а-спираль және Р-құрылым бөліктері, аминқышқылдарының әр түрлі функционалдық бүйірлік топтарының өзара байланысуы аркылы түзіледі. Ақуыздың молекуласының үшінші реттік құрылымын анықтау үшін рентген құрылымдық әдісі пайдаланылады. Үш өлшемді құрылымы анықталған бірінші ақуыз - миоглобин.

Глобулярлы ақуыздар үшінші реттік құрылымына қарай 5 топқа бөлінеді :
1. α-ақуыздар . Бұл ақуыздардың глобуласы α -спиральдан ғана түзілген. Мысалы, миоглобин деген бұлшық еттің белогы. Миоглобин молекуласы құрылымының ерекшеліктері мыналар:
а) полипептидтік тізбектің 75%-дайы α-спираль түрінде, бірнеше α- спиральдық бөліктері бар;
б) молекуласы өте тығыз бүктелген, ортасына судың 4 молекуласы ғана орналасады;
в) аминқышқылдарының полярлы бүйірлік топтары молекуланың сыртқы үстінде орналасады да, гидратталған күйінде болады;
г) аминқышкылдарының полярсыз бүйірлік топтары молекуланың ішінде орналасады да, сумен әрекеттеспейді;
д) пролин қалдықтары полипептид тізбегінің бұрылыс жерінде орналасқан спиральді бөліктерінің аралығында;
е) гем деген простетикалық топ ақуыздық бөлігімен ковалентсіз байла- ныстар арқылы байланысқан.

Ақуыз молекуласы екі немесе одан да көп полипептид тізбегінен қүрылса, мүндай ақуыз олигомерлі ақуыз деп аталады. Олигомерлі ақуыздардың құрамындағы полипептидтік тізбектерді протомерлер немесе суббөліктер деп атайды.
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz