III Б топша элементтері (Sc, Y, La, Ac): сипаттамасы және қолданылуы



ОСӨЖ
Тақырыбы: III Б топша элементтері.
ҚАЗАҚСТАН-РЕСЕЙ МЕДИЦИНАЛЫҚ УНИВЕРСИТЕТІ
Орындаған: Ерденбек І. Б.
101 б тобы фарм.
Тексерген: Кенеханова А. Ж.
Алматы қаласы 2018ж.

Жоспар
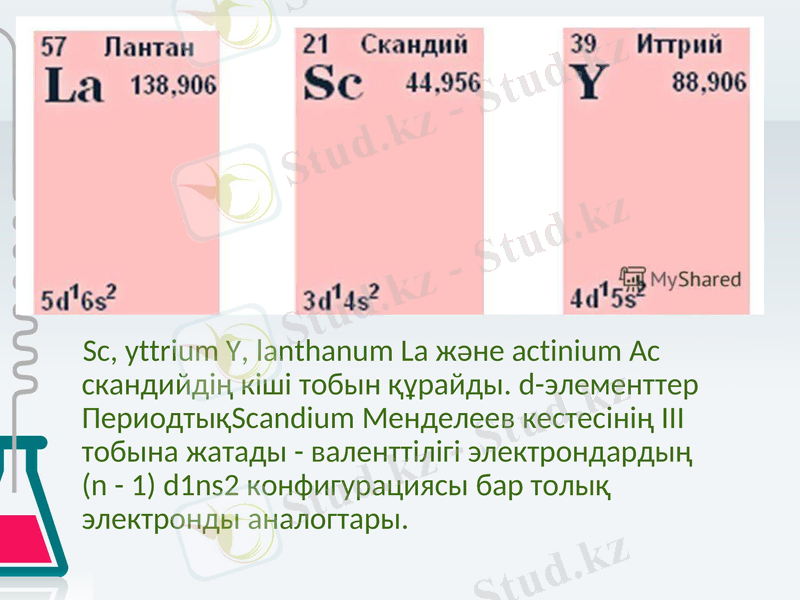
Sc, yttrium Y, lanthanum La және actinium Ac скандийдің кіші тобын құрайды. d-элементтер ПериодтықScandium Менделеев кестесінің ІІІ тобына жатады - валенттілігі электрондардың (n - 1) d1ns2 конфигурациясы бар толық электронды аналогтары.
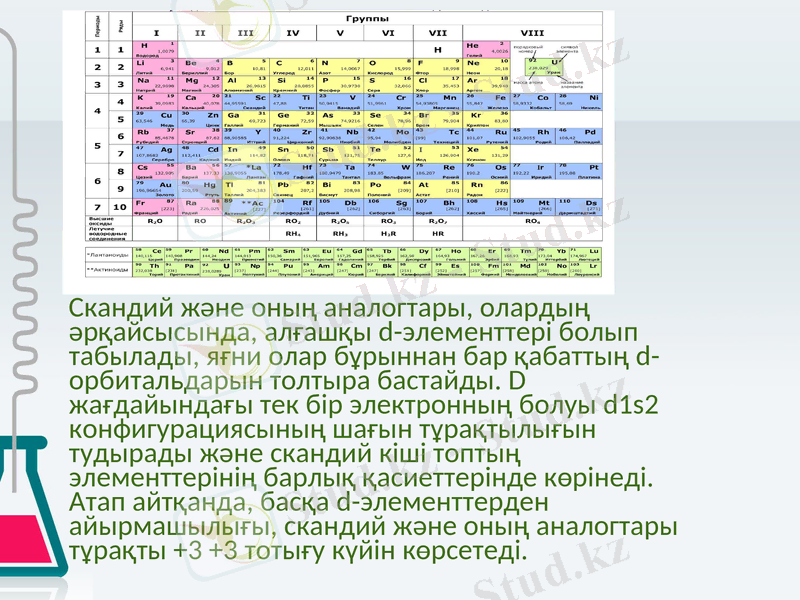
Скандий және оның аналогтары, олардың әрқайсысында, алғашқы d-элементтері болып табылады, яғни олар бұрыннан бар қабаттың d-орбитальдарын толтыра бастайды. D жағдайындағы тек бір электронның болуы d1s2 конфигурациясының шағын тұрақтылығын тудырады және скандий кіші топтың элементтерінің барлық қасиеттерінде көрінеді. Атап айтқанда, басқа d-элементтерден айырмашылығы, скандий және оның аналогтары тұрақты +3 +3 тотығу күйін көрсетеді.

Лантан(лат. lanthanum), La - элементтердің периодтық жүйесінің ІІІ тобындағы химиялық элемент, атомдық номері 57, ат. м. 138, 9055, сирек кездесетін элементтерге жатады. Лантанды 1839 ж. швед химигіК. Мосандер (1797 - 1858) лантан “топырағы” - La2О3 түрінде ашқан. Жылтыр, ақ түсті металл, тығыздығы 6, 162 г/см3, балқу t 920ӘС, қайнау t 3470ӘС. Тотығу дәрежесі +3. Лантан ылғал ауада тотығады, бөлме температурасында су және тұз, азот, күкірт қышқылдарымен, 200Ә С-тан жоғары температурада галогендермен әрекеттеседі. Лантан никелі бар геттер қорытпаларының негізі ретінде алюминийлі және т. б. қорытпаларға легирлеуші қоспа ретінде пайдаланылады. Сондай-ақ, ол болаттың коррозияға беріктігін және ыстыққа төзімділік қасиетін арттыруға қолданатын мишмиталл құрамдасы. Негізгі минералдары: монацит(Ce, La . . . ) PO4, бастнезит (Ce, La . . . ) FCO3. Лантанның қосылыстары LaCrO3 - жоғары температуралы электрөткізгіш керамикалық бұйымдар құрамына, La2О3 - оптикалық шынылардың құрамына кіреді, ал LaF3, La2О3 - лазерлік қасиеті бар заттар ретінде қолданылады.

Химиялық қасиеттенрі
Құрғақ ауада оксидті қабықпен қапталады.
Сумен, қышқылдармен жақсы әрекеттеседі
Қыздырғанда хлор, күкірт және басқа металлоидтермен, яғни ол әдеттегі металдың қасиеттерін көрсетеді.
Қосылыстарда тотығу дәрежесі +3.
Химиялық ерекшелігіне сәйкес, лантан кальцийге ұқсайды.

Маңызды қосылыстары
Лантан оксиді La2O3, ақ аморфты ұнтақ, суда ерімейді, бірақ қышқылдарда ериді. СО2-мен өзара әрекеттескенде карбонатқа айналады.
Лантан гидроксиді La (OH) 3, лантанның сумен қоспасында желатинді ақ тұнба түзіледі,
Лантаның тұздары сілтімен, ерітінділермен өзара әрекеттеседі. СО2-мен өзара әрекеттесу кезінде карбонатқа айналады.
Лантаның тұздары - түссіз крист. зат. Ерітілген тұздар - нитраттар, галоидтар, сульфаттар; ерімейтін - фтор, фосфат, карбонат. Негізгі лантан ацетаты егер йод қосылса крахмал сияқты әрекет етеді. Ақ гель жарқын көк түс алады. Бұл қасиет кейде қоспалар мен ерітінділерде лантанның табылуы үшін қолданылады.

Қолданылуы
Шыны өндіру
Металлотермия
Ағымдық химия көздері
Электроника

Актиний(лат. Actinium), Ac - Химиялық элементтердің периодтық жүйесінің 7-ші периодының ІІІ тобына жататын радиоактивті элемент. Реттік саны - 89. Ең ұзақ уақыт өмір сүретін изотопы Ac, жартылай ыдырау уақыты - 22 жыл.
Актинийді 1899 жылы А. Дебьерн уран рудаларын өңдеу қалдықтарында тапқан. Радийді нейтрондармен атқылау арқылы актинийді алады. Бұл - ақшыл-күміс түсті металл, химиялық қосындыларда валенттілігі 3+, химиялық қасиеттері бойынша лантанға жақын. Актиний - қауіпті радиоактивті улы зат. Актиний (Actіnіum) Ас - элементтердің периодтық жүйесінің ІІІ тобындағы радиоактивті элемент; реттік нөмірі 89, атомдық массасы 227. 1899 жылы француз химигі А. ДебьернС, өте әрекеттескіш; ауада тез тотығады, тұз және азот қышқылдарында ериді. Актиний химиялық қосылыстарда 3 валентті болып келеді. Қосылыстарының (°50±°. Актиний күмістей ақ түсті металл, балқу температурасы 1050%10-10×ашқан. Актинийдің жер қыртысындағы мөлшері 6гидрототықтар, фторид, оксалат, фосфат, карбонат, фторсиликат) көпшілігі ерімейді. Актиний галогенидтері ауада ұшқыр келеді, негіздік қасиеті лантаннан да күшті. Актиний тотығы оның гидрототығС-да қыздырып-күйдіру арқылы алынады. Оның галогенидтері фторлы сутекке, төрт хлорлы көміртекке, бромды алюмийниге актиний тотығының, құрғақ гидрототығының немесе оксалатының әсері нәтижесінде түзіледі. Актиний тұздары ақ түсті, ертінділері түссіз келеді.

Химиялық қасиеттері
Активті металл, қалыпты температурада оттекпен сумен ж/е қышқ. -мен әрекеттеседі
Қызған кезде ол галогендер мен күкіртпен әрекеттеседі.

Ең маңызды қосылыстары:
Актиноцит оксиді Ac2O3
Ac (OH) 3 акидий гидроксиді
Actinium Fluoride AcF3
Actinium хлорид AcCl3
Actinium бромі AcBr3
Actinium Iodide AcI3
Actinium AcOCl хлориді
Актобты оксибромид AcOBr
Acne Sulfide Ac2S3
Ацофиттің ацофосфаты AcP04. 1 / 2H2O

- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz