Оттегі мен күкірт: физика-химиялық қасиеттері, алынуы және қолданылуы



VIA топ элементтері.
Орындаған: Ерденбек І. Б.
ҚАЗАҚСТАН-РЕСЕЙ МЕДИЦИНАЛЫҚ УНИВЕРСИТЕТІ
101 б тобы фарм.
Тексерген: Кенехонова А. Ж.

Оттегі
Оттегі (латынша Oxygenium), O - элементтердің периодты жүйесінің VI-тобындағы химиялық элемент. Реттік нөмірі 8, атом массасы 15, 999. Оттегі -химияның ең маңызды элементі және Жер бетіндегі көптеген тірі ағзалардың тыныс алуын қамтамасыз етеді. Оттегісіз біз бірнеше минут қана өмір сүре аламыз. Жасушалар мен талшықтар өмір тіршілігіне қажетті өздеріндегі энергияны босата отырып, органикалық заттарды тотықтыру үшін оттегіні пайдаланады

Алынуы
Оттегін өнеркәсіпте ауаны қысып сұйылтады да, азот пен оттегінің қайнау температураларының айырмашылығына қарай буландырып бөліп алады. Осылайша алынған оттегі көгілдір түсті баллондарда сақталады, себебі сұйық оттегі ашық-көгілдір түсті болады. Ал зертханалық алу әдістері кейбір оттегіге бай күрделі қосылыстарды айыруға негізделген
Тұрмыста жиі қолданылатын «марганцовканы» айыру. Ол үшін құрғақ сынауыққа аздаған түйірлерін салып, оның аузын газ шығатын түтігі бар тығынмен жауып қыздырамыз. Сонда мына реакция жүреді:

Оттектің физикалық қасиеті
Оттектің кейбір физикалық қасиеттері бұрыннан белгілі. Ол иіссіз, дәмсіз, түссіз газ. Сондықтан оны ауадан ажырату қиын. Тек он сегізінші ғасырда тәжірибе жүзінде ағылшын химигі Дж. Пристли (1774 ж. ) мен швед ғалымы К. Шееле (1772 ж. ) оттекті бос күйінде алып, оның ауаның құрамдас бөлігі екенін дәлелдеді. Оттек ауадан сәл ауыр . 0°С-та және бір атм қысымда (101, 325 кПа) оның бір литрінің массасы 1, 43 грамм, ал ауаныкі - 1, 29 грамм тартады.

Оттектің физикалық қасиеті
Оттек суда аз ериді. Қалыпты жағдайда 20°С-та және 1 атм қысымда судың 100 көлемінде небәрі 3 көлем оттек газы ериді. Осы қасиетіне орай, арнайы газ өлшегіш деп аталатын шыны аспаптағы суды ығыстыру арқылы оттек газын жинап сақтауға болады. Оттек - 183°С-та сұйылады, - 218°С-та қатады.

Химиялық қасиеттері
Оттегі қыздырған кезде көптеген заттармен әрекеттеседі, бұл үдеріс жану деп аталады, ол жылу мен жарықты бөле жүреді.
Жай заттармен әрекеттесуі
Бейметалдармен әрекеттесуін көру үшін оттегі толтырылған сынауыққа көмірдің түйірін салсақ, ол жарқырап жана бастайды:
С + O2 = СO2
Түзілген көмір қышқыл газын әк суына жіберсек оның лайланатыны сендерге белгілі. Бұдан басқа күкірт, фосфор, т. б. бейметалдар да оттегінде жанады:
S + O2 = SO24Р + 5O2 = 2Р2O5
Кейбір металдар да оттегінде жанып оксидтер түзеді. Мысалы, оттегімен толтырылған сынауыққа магний ұнтақтарын сепсек, оның жарқырап жанғанын көруге болады.
2Mg + O2 = 2МgО
Болат сымның ұшына кішкентай көмір түйірін шаншып алып, оны тұтатып оттегімен толтырылған ыдысқа салсақ жанған көмірден бөлінген жылудың әсерінен темір жана бастайды.
ЗFе + 2O2 = Fе3O4 (FеO•Fе2O3)

Химиялық қасиеттері
Күрделі заттармен әрекеттесуі
Кейбір күрделі заттар да оттегінде жанып оксидтер береді, мысалы, тамақ пісіргенде ас үйдегі газ пешінде қолданылатын пропанның (С3Н8) жануы:
С3Н8+ 5O2 = ЗСO2+ 4Н2O
Автогендік әдіспен металдарды кесу мен жалғауда мына реакция жүреді:
2С2Н2 + 5O2 = 4СO2+ 2Н2O
Металлургия өндірісінде өртеу пештерінде күрделі заттардың тотығу реакциялары жүреді:
2ZnS+3O2 = 2ZnO + 2SO2Cu2S + 2O2 = 2CuO + SO2
Сонымен, оттегі жай және күрделі заттармен әрекеттескенде жану реакциялары жүріп, нәтижесінде әр түрлі оксидтер түзіледі.

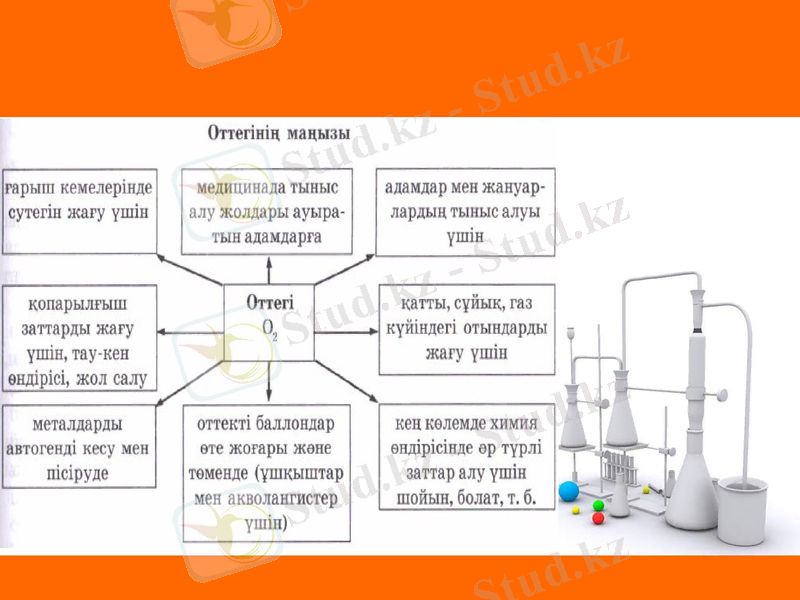
Оттегінің табиғаттағы айналымы және қолданылуы
Табиғатта оттегі негізінен фотосинтез нәтижесінде түзіледі, ол жапырақтарда және теңіз балдырларында жүретін үдеріс.
6СO2 + 6Н2O → С6Н12O6 + 6O2↑
Осы оттегімен адамдар мен жануарлар тыныс алады, одан басқа жер қыртысындағы минералдар түзіледі. Табиғатта оттегінің қатысуымен тоттану, шіру, aшy сияқты бүліну үдерістері де жүріп жатады. Оттегінін, атмосферадағы қоры 1, 5•1015 т, оның 1•1010 тоннасы жану үшін жұмсалады. Тыныс алу жеке ағзаның өмірі үшін, ал шіру - эволюция (даму) үшін маңызды үдерістер.

Оттегінің аллотропиялық түр өзгерістері. Озон
Оттегі табиғатта екі түрлі жай зат күйінде кездеседі, оның бірі O2, екіншісі O3, ол озон деп аталады. Енді озонмен жете таныссақ, озон найзағай ойнағанда ауада пайда болады. Сонда электр заря- дының әсерінен мына реакция жүреді:
3O2 → 2O3Бір элементтің бірнеше жай зат күйінде болу құбылысы аллотропия деп аталады.
Озонның формуласы О3, салыстырмалы молекулалық массасы 48, оттегінен 1, 5 есе ауыр (48 : 32 = 1, 5), суда аз еритін, -112°С-да қайнайтын, -193°С-да балқитын газ күйінде қою-көк түсті, ал қатты күйінде көктен қара-күлгін түске дейін боялады.

Күкірт
Күкірт (ағылш. Sulfur), S - элементтердің периодтық жүйесінің VІ тобындағы химиялық элемент; ат. н. 16, ат. м. 32, 06. Тұрақты 4 изотопы бар. Сондай-ақ жасанды жолмен алынған 6 изотопы белгілі. Күкірттің жер қыртысындағы салмақ мөлшері 0, 05%, теңіз суында 0, 08 - 0, 09%. Күкірт біздің заманымыздан 2000 жыл бұрын белгілі болған. Қалыпты жағдайда күкірт сары түсті, бейметалл. Табиғатта бос күйінде (саф К. ) және сульфидті (мысалы, пирит, галенит, антимонит, т. б. ), сульфатты (гипс, ангидрит, барит, мирабилит, т. б. ), т. б. минералдар түрінде кездеседі.

Периодтық жүйедегі орны
Күкірт III периодтың, VI топтың негізгі топшасының элементі, реттік нөмірі 16. Олай болса ядро заряды +16, протон саны 16, нейтроны да 16; электрондарының жалпы саны 16.
Электрондық құрылысы. Осы электрондар үш электрондық қабаттарда бөлініп орналасады, күкірттің электрондық формуласы: 1s22s22p63s23p4
Күкірт II, IV, VI - валентті бола алады, ал тотығу дәрежелері -2, 0, +4, +6 болып келеді.
Күкірттің жануы

Физикалық қасиеттері
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz