Тотығу-тотықсыздану реакциялары: элементтердің тотығу дәрежелерін есептеу және теңестіру әдістері



Элементтер және олардың тотығу-тотықсыздану қасиеттері
Орындаған: Ерденбек І. Б.
ҚАЗАҚСТАН-РЕСЕЙ МЕДИЦИНАЛЫҚ УНИВЕРСИТЕТІ
ОСӨЖ
101 б тобы фарм.
Тексерген: Кеноханова А. Ж.

Жоспар
Тотығу-тотықсыздану реакциялары
Элементтің тотығу дәрежесі
Тотығу дәрежелерін есептеу
Тотығу-тотықсыздану реакциялар теориясы (ТТР)
Тотықтырғыш, Тотықсыздандырғы
ТТР теңестіру. Электронды баланс тәсілі.
Пайдаланылған әдебиеттер

Тотығу-тотықсыздану реакциялары-нәтижесінде әрекеттесуші заттар құрамына кіретін бір немесе бірнеше элементтердің тотығу дәрежелерінің өзгеруімен жүрілетін реакциялар.
Мысалы:
2Нg2+O2- =2Hg0 + O20 (ТТР)

Элементтің тотығу дәрежесі дегеніміз оның шартты электрондық заряды. Ол қосып алу формуласы арқылы есептелінеді және оң, теріс нөлдік мәнге ие болуы мүмкін, «+» немесе «-» таңбалары болады.

Тотығу дәрежесін есептегенде келесі заңдылықтарды қолдану керек:
1) Атом немесе молекула әрқашан элекртобейтарап, себебі олар да оң таңбалар теріс таңбалар санымен теңеседі;
2) Бөлшектің белгісі оны байланыстыратын электрондық жұбының жақын орналасуына байланысты;
3) Металдар катионы әрқашан оң зарядталады: Al3+, Na+, Ca2+;
4) Қышқыл қалдықтардың анионы әрқашан теріс зарядталады: NO3-, SO42-, PO43-;
5) Бейметаллдардың тотығу-тотықсыздану дәрежесі оң және теріс болуы мүмкін: N3-H4+, HN5+O3.

Сонымен қатар тотығу дәрежесін анықтау үшін келесі қағидалар қолданылады.
1 ) жай заттардың элементінің тотығу дәрежесі 0-ге тең; Na0;
2) қосылыстарда сілтілік металдар (+1) тотығу дәрежесіне тең; K+1OH; Na+1Cl;
3) қосылыстарда жер сілтілік металдар (+2) тотығу дәрежесіне тең; Ca+2SO4;
4) қосылыстарда оттегі (-2) тотығу дәрежесіне ие; H2O-2; ;
ескерту: асқын тотықтарда (-1) ; ; OF2 қосылысында (+2) тотығу дәрежесіне ие.
5) қосылыстарда сутегі (+1) тотығу дәрежесіне тең;
ескерту: металл гидридтерінде сутегі (-1) тотығу дәрежесіне ие, ;
6) молекуланың құрамына кіретін барлык атомдардың тотығу дәрежелерінің алгебралық қосындысы 0-ге тең

Азот атомының қосылыстардағы тотығу дәрежелерін анықтайық,
NH3, N2N4, NH2, N2O, NO, HNO2, NO2, HNO3 қосылыстарында тотығу дәрежесі: -3, -2, -1, +1, +2, +3, +4, +5 сәйкес болады.

Тотығу дәрежелерін есептеу:
а) H20, Cl20, Al0;
б) K2+Cr26+O72-, K+Mn7+O42-, K2+ Mn6+O42, Cr23+(SO4) 32-;
в) Ca2+F2-, C4-H4+, N3-H3+, (N3-H+4) +N5+O2-3;
г) 0СH+30СO2-O2H+, C-H+3C-H+O2-.

Тотығу-тотықсыздану реакциялар теориясы (ТТР)
1. Тотығу дегеніміз - электрондарды беру процесі: Al0 - 3e¯= Al3+.
2. Тотықсыздану дегеніміз - тотықтырғыштарға электрондардың қосылу процесі: Mn7++5e¯= Mn2+.
3. Тотығу-тотықсыздану процесінде тотықсыздандырғыш берген электрондардың саны тотықтырғыш қосып алған электрондар санына тең болуы шарт.
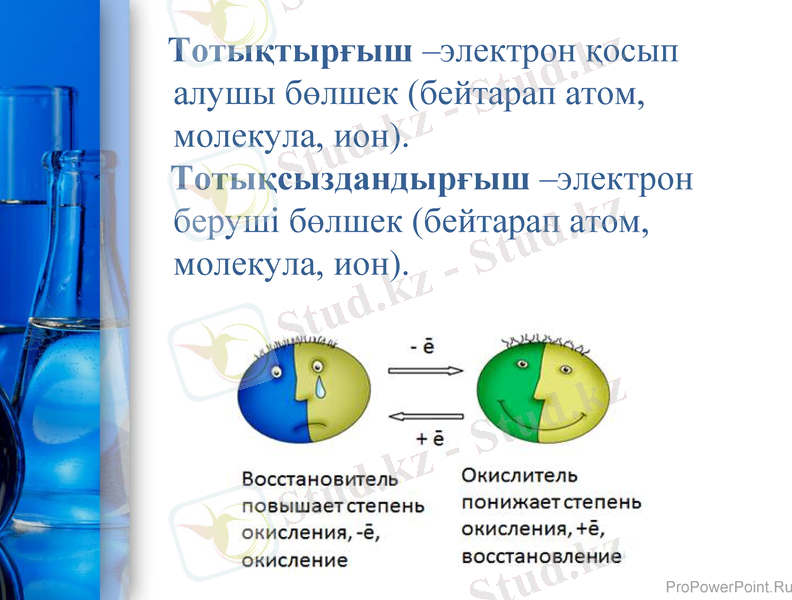
Тотықтырғыш -электрон қосып алушы бөлшек (бейтарап атом, молекула, ион) .
Тотықсыздандырғыш -электрон беруші бөлшек (бейтарап атом, молекула, ион) .

Тотықсыздандырғыштар (е беруші)
Тотықтандырғыштар ( е қосып алушы)
1. Аниондар Cl-, Br-, I-, F-, S2-, N3-
2Cl-2e=Cl20
2. Me - металдар
Al0-3e=Al3+
3. минимальды тотығу дәрежелі элементтер:
Fe2+, Cu+, Pb2+, Sn2+
Fe2++1e=Fe3+
4. Электролиз кезіндегі катод
1. Галогендер Cl2, Br2, I2, F2
2 Cl0+2e=2Cl‾
2. Максималдық тотығу дәрежелі элементтер:
H2S6+O4, KMn7+O4, K2Cr6+2O7, Fe3+, Cu2+, Pb4+, Sn4+
Fe3++1e=Fe2+
3. Электролиз кезіндегі Анод

Маңызды тотықтырғыштар
1. Маңызды тотықтырғыштар типтік бейметалдар (F2, CL2, Br2, I2, O2), галогендер (-1), оттегі (-2) тотығу дәрежелеріне ие болады.
2. Құрамында оттегі болатын қышқылдар мен тұздар арасында біршама маңызды тотықтырғыштар KМnO4, K2CrO4, K2Cr2O7, концентрленген күкірт қышқылы, азот қышқылы және нитраттар, галогендердің оттекті қышқылдары. Mn+7 тотықтырғыш ретінде ортаның қышқылдығына байланысты алуан түрлі өнімдерге дейін тотықсыздана алады: қышқыл ортада - Mn2+ке дейін, бейтарапта MnO2 -ге дейін сілтілікте MnO4-2 -ке дейін
5K2SO3+2KMnO4+3H2SO4=6K2SO4+2MnSO4+3H2O
3K2SO3+2KMnO4+H2O =3K2SO4+2MnO2+2KOH
K2SO3+2KMnO4+2KOН=К2SO4 +2K2MnO4+H2O

Калий хроматы және дихроматы құрамында Cr+6 ионы болуынан тотықтырғыш болып табылады, ол Cr+3 ионына дейін қайта тотықсызданады.
K2 Cr2O7 +3H2S+4H2SO4=Cr2(SO4) 3+3S+K2SO4+7H2O.
Концентрленген күкірт қышқылындағы H2S+6O4 күкірт +6 тотығу дәрежелі болғандықтан тотықтырғыш қасиет көрсетеді, ол тотықсызданып +4 (SO2), 0 (S), немесе -2 (H2S) дейін тотықсыздана алады (тотықсыздандырғыш күйі күшті болса, күкірттің тотықсыздануы терең жүреді) .
Cu+2H2SO4=CuSO4+SO2+2H2O,
3Mg+4H2SO4=3MgSO4+S+4H2O,
4Zn+5H2SO4=4ZnSO4+H2S+4H2O

Маңызды тотықсыздандырғыштар
1. Қарапайым заттар арасындағы маңызды белсенді металдар (сілтілік, жер сілтілік, мырыш, алюминий, темір және т. б. ), сондай-ақ, кейбір бейметалдар (сутегі, көміртегі, фосфор, кремний) жатады. Мысалы: Көміртегі CO және CO2 -ге дейін тотығады.
C+O2=CO2
2. Оттексіз қышқылдар (HCI, HBr, HI, H2S) және олардың тұздары жай заттарға дейін тотықсызданады.
3. Cілтілік және жер сілтілік металдар гидридтері.
CaH2+2H2O=Ca(OH) 2+2H2
4. Тотығуд дәрежесі ең төмен металдар (Sn2+, Fe2+, Cu+2 иондары және т. б. ) тотыға отырып, өздерінің тотығу дәрежесін арттырады.
SnCI2+CI2=SnCI4
5FeCI2+KМnO4+8HCI=5FeCI3+MnCI2+KCI+4H2O.

↓ ↓
тотықсыздандырғыш тотықтырғыш
S2--2e=S0 5 тотығу процесі
Mn7++5e=Mn2+ 2 тотықсыздану процесі
Мысалы, тотығу-тотықсыздану реакциялары теңдеуін анықтау керек:
Na0 + H+1CI+3O-22®Na+1CI+3O-22+CI20+H+12O-2
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz