Фтор элементі: тарихы, физико-химиялық қасиеттері, өндірісі және биологиялық маңызы



ФТОР ( F ) элементі
Орындаған: Муса А. ВС 106 тобы
Тексерген: Ахатова З. С.

ФТОР
Фторды алғаш рет 1886 жылы А. Муассон алған. Грек тілінен алынған
«фторос»-бүлдіргіш деген сөзді білдіреді. 1810 ж. А. Ампер, балқытқыш қышқыл, тұз қышқылына ұқсас екенін байқап, хлорға ұқсас элемент бар екенін сеніммен айтқан, ол оны басында флюорий деп атаған (CaF2 далалық шпат, одан балқытқыш қышқылды алған флюорит деп аталады, бұл минерал бытыраңқы боп келеді, оны көбіне металлургияда шлакты жағу үшін қолданған) . 1816 ж. А. Ампер болжамдағы элементті фтор деп атады. Бұл атау біздің әдебиетімізде сақталған, бірақ батыс елдерінің көбі фторды флюор деп атайды.


Фтордың алынуы
Фторды бос күйінде алу, химиялық элементтерді алудағы қиыншылықтың ірісі болды, бұл элемент қосылысы ерекше берік болғандықтан оны жайырақ алды. А. Муассон сұйық фторсутекті -55ºС электролизге ұшыратып, ерекше химиялық активтілікке ие ашық-сары фтор газын алды, Фтордың ағынында күкірт, көмір, қағаз, ағаш жанып кетті; сутегі ерекше әсер етті - реакция тіпті (- 220ºС) температурада қопарылыс бере жүрді. Фторды алу үшін оңай балқитын калий бифторидін KHF 2 240ºС температурада электролизге ұшыратады. Электролизер қызыл мыстан жасалған ыдыс: катод мысты, анод графитті. Металдың бетіндегі мыс фториді қабаты оны фтордың бүлдіргіш әсерінен қорғайды. Электролиздің жүру барысында және сутекті болып алу кезінде қиын балқитын фторид түзіледі және электролиздегі температураны жоғарлатуға тура келеді. Фторды арнайы болаттан жасалған баллондарда сақтайды.


Фтордың физикалық және химиялық қасиеттері
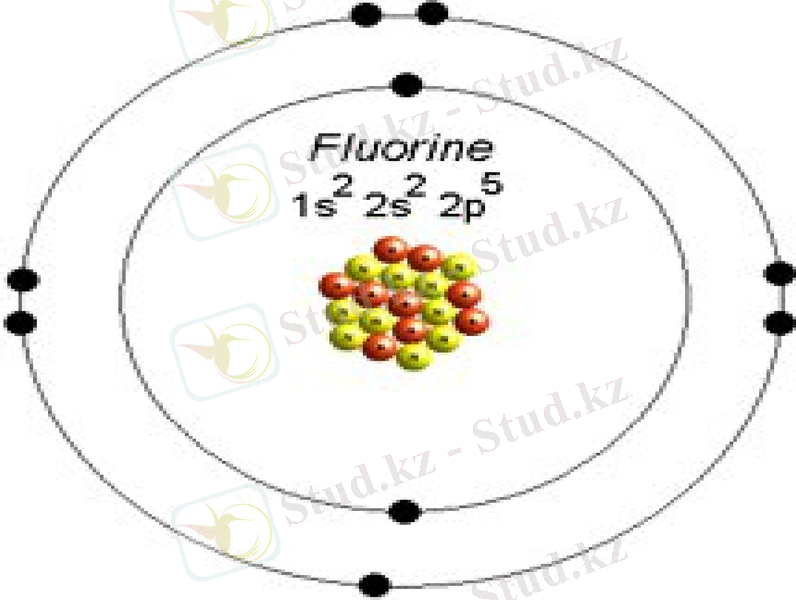
Фтор - әлсіз-сары түсті газтәрізді зат. Фтордың сипатты ерекшелігі болып оның атом массасы 19 тең бір ғана изотобының болуы табылады. Атом массасы 17, 18, 20 болатын изотоптар жасанды жолмен алынған, жартылай ыдырау периоды сәйкесінше 66 сек, 107 мин және 12 сек. . Тұрақсыз изотоптар ыдырайды.
Және де өз электронын тартып алумен байланысты өзгеру болуы мүмкін. Электрон К-қабатынан тартылады. Фтордың жоғары активтілігі және токсикалығы оның техникада қолданылуын тежеді. Қазіргі кезде фтормен жұмыс жасау кезіндегі туындаған қиыншылықтар артта қалды және оның қосылыстары қарқынды зерттелуде (кен көлемді анықтамалар бар, фтор химиясының сұрақтарын қамтитын шолу
томы жыл сайын шығады, әртүрлі мақалалар жарияланады) .


Фтор химия және техникада күтпеген перспективаларды ашқан, ерекше қызықты және көпуәделі зат болып шықты. Фтор атомына жоғары иондану потенциалы мәні (17, 42 эв ) тән. Фтордың оң зарядты ионын тіпті алуға болмайды. Бұл галоген - типті бейметалл - оның ішкі электрон бұлтын сегізге дейін толтыратын бір электронды қосып алу ерекшелігімен сипатталады. Фтор молекуласының активтілігі фтор мен хлорды салыстыру нәтижесінде алынған мәліметтерден өте жоғары болып шықты. Бірақ фтордың жоғары активтілігі туралы ортақ ой жоқ. Болжамдар бойынша, бұл құбылыс F 2 молекуласының диссоциациясының салыстырмалы аздаған энергиясымен тек 158, 34 кДж/моль байланысты, ал төмен энергиялы диссоциацияны фтор атомының түзілуі кезінде қатыспайтын электрондардың екеуара тебілуімен түсіндіреді.


Фтор атомында тебілу ерекше сипатқа ие,
өйткені оның молекуласының атомдар арасындағы байланыс ұзындығы аз. Басқаша көзқарас, фтор мен хлордың электрон деңгейлер санының әртүрлілігіне негізделген. Хлор молекуласында екі қосымша байланыстың түзілуі болжалған: 27 сызбада көрсетілгендей, 3p және 3d. Әр атомның жұптаспаған 3p электронымен негізделген ковалентті байланыстан басқа, молекулада 3p жұптың вакантты 3d-деңгейге өтуі нәтижесінде екі байланыс түзіледі. Фтор молекуласында мұндай қосымша байланыстар жоқ (фторда d- орбиталь жоқ), сондықтан оның молекуласының беріктігі әлсіз. Фтордың химиялық активтілігіне үлкен әсер ететін фактор болып, фтор атомы және реакция кезіндегі жұбы атомы немесе молекуласы арасындағы
реакцияның белгілі энергетикалық эффектісі табылады.
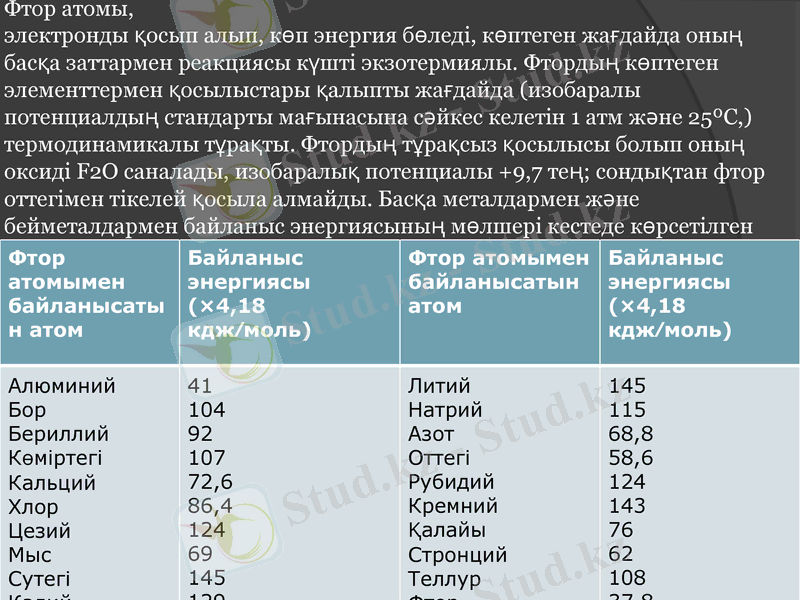
Фтор атомы, электронды қосып алып, көп энергия бөледі, көптеген жағдайда оның басқа заттармен реакциясы күшті экзотермиялы. Фтордың көптеген элементтермен қосылыстары қалыпты жағдайда (изобаралы потенциалдың стандарты мағынасына сәйкес келетін 1 атм және 25ºС, ) термодинамикалы тұрақты. Фтордың тұрақсыз қосылысы болып оның оксиді F2O саналады, изобаралық потенциалы +9, 7 тең; сондықтан фтор оттегімен тікелей қосыла алмайды. Басқа металдармен және бейметалдармен байланыс энергиясының мөлшері кестеде көрсетілген
Фтор атомымен байланысатын атом
Байланыс энергиясы (×4, 18 кдж∕моль)
Фтор атомымен байланысатын атом
Байланыс энергиясы (×4, 18 кдж∕моль)
Алюминий
Бор
Бериллий
Көміртегі
Кальций
Хлор
Цезий
Мыс
Сутегі
Калий
41
104
92
107
72, 6
86, 4
124
69
145
129
Литий
Натрий
Азот
Оттегі
Рубидий
Кремний
Қалайы
Стронций
Теллур
Фтор
145
115
68, 8
58, 6
124
143
76
62
108
37, 8


Фтордың сутегімен байланыс энергиясы үлкен мәнге ие болуы көңіл
аудартады; энергия мөлшерінің шамасы бойынша екінші орнында сілтілік металлдар тұр, одан кейін екінші топ металлдары және ауыр металдар. Фтор- кремний байланыс энергиясы ерекше үлкен; кремний тотығына HF әсер етіп төртфторлы кремнийді жеңіл алуға болады. Бұл реакцияда кремниймен мықты төрт байланыс түзу үшін, фтор сутегінен ажырайды. Сонымен қатар, фтор- оттегі, фтор-стронций, байланыс энергиясына жақын фтор-барий, фтор-мыс байланыс энергиясы мәніне мән беру керек. Фтормен қосылыста оттегі металл сияқты қасиет көрсетеді. Фтордың электронға жақындығы хлорға қарағанда аз, бірақ бромдыкінен көп, және 350, 7 кдж/г-атом тең. Фтордың стандартты тотығу-тотықсыздану потенциалы өте жоғары (+2, 85
В) . Фтор - күшті тотықтырғыш, оттегі атомынан электронды тарта алады, бірақ оның оттегіге жақындығы өте аз


. Фтор ионы Fˉ өлшемі бойынша оттегі Оˉ² ионына тең; сондықтан екі ионда бір-біріне ұқсас қосылыстар түзеді. Ион типті фторидтер (мысалы, натрий фториді) және оксидтер (мысалы, кальций тотығы) арасында құрылым кристалды торға ұқсастығы байқалады. Кейбір қасиеттерінің қатары бойынша металл фторидтерінің қасиеттері хлоридтер мен
бромидтерден ерекшеленеді. Күміс фториді суда ерігіш, ал бұл металдың бромидтері мен фторидтері мүлдем ерімейді. Фтор атомының тіпті фтор түзетін ковалентті байланыста да, электронды қосып алуға тырысуы оның қосылысының ионды сипатын қамтиды, ионды күйдің белгілі үлесі бар. Ауыр металдар фторидтері ұшқыш. Уранның гексофториді UF 6 56, 5ºС қайнайды. Бұл қасиет уран изотоптарын бөлу әдісін енгізуге негіз болды.


Фтор бірден үлкен валенттілік көрсете алмайды; үш жұптаспаған электронға ие болу үшін, фтор атомының қозуы үшін, оның 2p-электронының біреуін 3s-орбитальға ауыстыру керек. Фторда d-орбиталь болмағандықтан,
басқа мүмкіндік жоқ. Бірақ бас квант санының өзгеруімен байланысты ауысу, практика жүзінде ешқандай реакцияда жүзеге аспайтын, көп мөлшерде энергия жұмсауды қажет етеді: 1s²2s²2p 5 →1s²2s²2p 4 3s, Фтор және суға тән реакциялар, оттегінің бөлінуімен жүреді (әлсіз
озондалған) :
F 2 +H 2 O↔H 2 F 2 +O
2O→O 2
3O→O 3

Кремний тотығымен реакция ұқсас түрде жүреді: SiO 2 +2F 2 =SiF 4 +O 2
Қосылыстардан басқа галогендерді ығыстырып, фтор олармен
әрекеттеседі, осы кезде иодидтер тіпті жалындайды, мысалы:
NaI+ F 2 =NaF+IF Азот қышқылына әсер етіп, фтор одан сутегін ығыстырады: 2HNO3 + 2F 2 =2FNO 3 +H 2 F 2 Азот триоксифториді FNO 3 күшті тотықтырғыш саналады. Фтор сутегімен қарқынды әрекеттеседі. Фторсутек қоспасын жаққандағы жалын 4000ºС-дан жоғары температураға ие. Реакция өнімі сутегі фториді немесе фторсутек газы болып табылады. Әдетте оны әлсіз қыздыру арқылы кальций фторидіне (минерал балқытқыш шпат) күкірт қышқылымен әсер ету
арқылы алады: CaF 2 +H 2 SO 4 =CaSO 4 +H 2 F 2 Фторсутегінің химиялық және физикалық қасиеттері хлорсутекке ұқсас жағынан, бірақта жеке ерекшеліктерге ие. Фторсутегі сұйық күйде су молекуласы арасындағы байланыстардан неғұрлым берік сутегі байланыстармен байланысқан ассоциацияланған молекулалардан тұрады.

Бұл формула, протон бір фтор атомымен берік ковалентті байланыспен, ал басқасымен беріктігі азырақ сутегі байланысымен байланысқанын көрсетеді. HF мономерлік молекулалары газтәрізді күйде болады және тек жоғары температурада. Газтәрізді сутек фторидінде әртүрлі құрамды полимерлі молекулалар болатыны туралы мәліметтер бар; әсіресе циклді құрылысқа ие 6 6 H F димерлі және гексамерлі молекулалар көп.
Қатты сутегі фториді ұзын зигзагтәрізді полимерлі тізбектен құрылған.
Сутегі фториді молекуласының асссоциациясы +19, 54ºС салыстырмалы
жоғары температурада көрінеді. Сутегі фторидінің бұл қасиеті қайнау
температуралары 0-ден кіші галогендердің сутекті қосылыстарының
қатарынан ерекшелейді. Осы ерекшеліктен сутегі фторидінің сумен
ұқсастығын көрмеу мүмкін емес, сонымен қатар жетінші топтың
элементтерінің гидридтерімен салыстырғанда жоғары қайнау
температурасына ие. Бұл гидридтердің өзіндік түзілу себебі кішкене
атомдардан (су молекуласының ассоциациясында оттегі атомының р-
электрондары да маңызды роль атқарады) түзілген гидридтер жағдайында
ерекше көрінетін сутектік байланыс әсері болып табылады.

Сұйық (HF) n диэлектрлік өткізгіштігі (83, 3) судың бұл шама мөлшерінен
жоғары. Осы қасиетке байланысты фторсутек әртүрлі бейорганикалық
қосылыстарды жақсы ерітеді және тұзтәрізді қосылыстардың электролиттік
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz