Күкірттің құрылымы, физико-химиялық қасиеттері және қолданылуы



Презентация

Тақырыбы: Күкірт ЖӘНЕ ОНЫҢ ҚАСИЕТТЕРІ

Периодттық жүйедегі орны
Күкірт III периодтың, VI топтың негізгі топшасының элементі, реттік нөмірі 16. Олай болса ядро заряды +16, протон саны 16, нейтроны да 16; электрондарының жалпы саны 16.
Электрондық құрылысы. Осы электрондар үш электрондық қабаттарда бөлініп орналасады, күкірттің электрондық формуласы: 1s22s22p63s23p4
Күкірт II, IV, VI - валентті бола алады, ал тотығу дәрежелері -2, 0, +4, +6 болып келеді.

Шығу тарихы
Күкірт - қашан ашылғаны, қалай атау берілгені жөнінде тарихта дәл мағлұмат жоқ.
Ертеде күкіртті үйді жындардан, жаман энергиялардан тазалауға қолданған. Одессей аңызы бойынша ұзақ жолдан туған үйіне оралғанда бірінші жұмысы үйін күкіртті жағып жын - шайтандарды қуу болған.

Күкірт - сары түсті, суда нашар еритін, су жұктырмайтын, жылу мен тоқ өткізбейтін, морт келетін қатты зат. Балку температурасы 119°С. Күкірт атомының сыртқы валенттілік кабатында екі дара электроны болғандыктан, олар өзара байланыса алады.
Физикалық қасиеттері
S
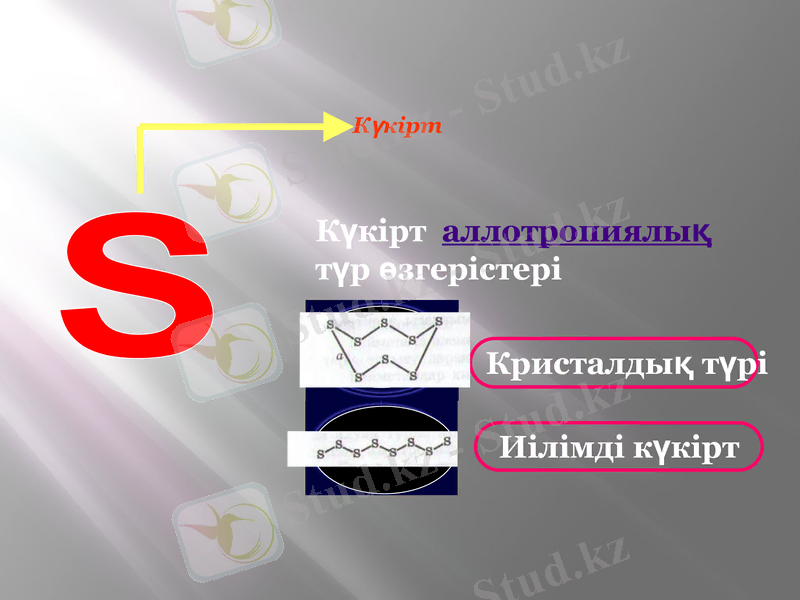
Күкірт
Күкірт аллотропиялық
түр өзгерістері
Кристалдық түрі
Иілімді күкірт

Аллотропия - (грекше allos - өзге және
tropos - бұрылыс, қасиет ) химиялық
Элементтердің бірнеше жай заттар
түрінде болуы.
Қазақша тұрпаттастық деп аталады.

ОЛ иіссіз, суда ерімейтін, сары түсті, морт сынатын, электр тогы мен жылуды нашар өткізетін, балқу температурасы 119 градус, сары түс, қоңыр түсті сұйықтыққа айналады. 250 градуста қоймалжың сұйықтыққа айналады. Температура жоғарылаған сайын молекуладағы атомдар саны азая бастайды:
S ∞ →S 8 → S6 → S4→ S 2
Кристалдық түрі

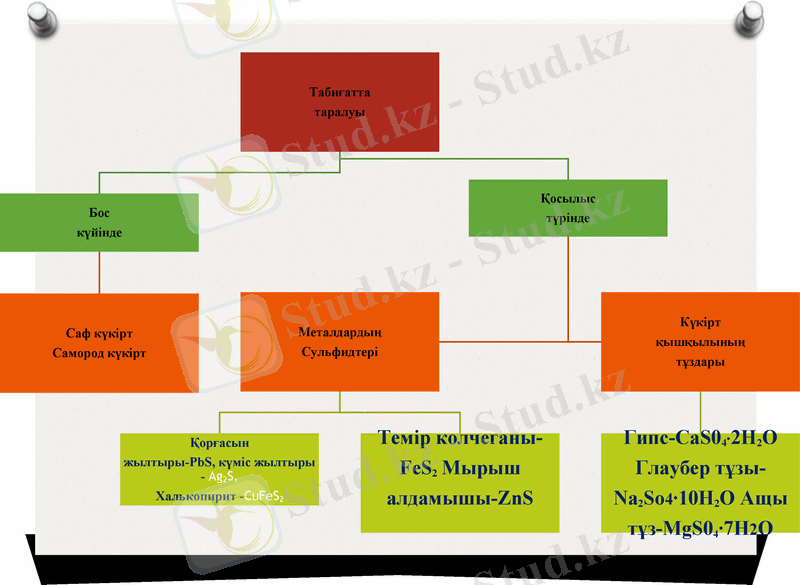
Табиғатта таралуы. Күкірттің табиғи қосылыстары
Балқаш, Шығыс Қазақстан облысында сульфидтер (ZnS, PbS, FeS2, т. б. ) күйінде болса, сульфаттары (CaSO4 • 2Н2O - ғаныш (гипс), Na2SO4 • 10Н2O - мирабилит, FeSO4 • 7Н2O - темір купоросы) т. б. болады. Күкірт қосылыстары мұнайда және тас көмірде де кездеседі. Бос күйіндегі күкіртті тау жыныстарынан балқыту арқылы алады.
Вулкан атқылағанда газбен ілесе ұшқан күкірт сыртқа шығып кристалл түрінде қатаяды. Ондай күкіртті вулканмен байланысты арасан көздерден (фумаролдардан), тау жыныстарының жарықтарынан, қуыстарынан кездестіруге болады.
Сульфид минералдардың тотығуынан пайда болатын күкірт кендері көбінесе сульфид кендерінің үстіңгі қабатында болады. Бұл жағдайда пайда болатын күкірттің реакциясын мынадай түрде көрсетейік:
RS + Fe2(SО4) 3 = 2FeSO4 + RSO4 + S.

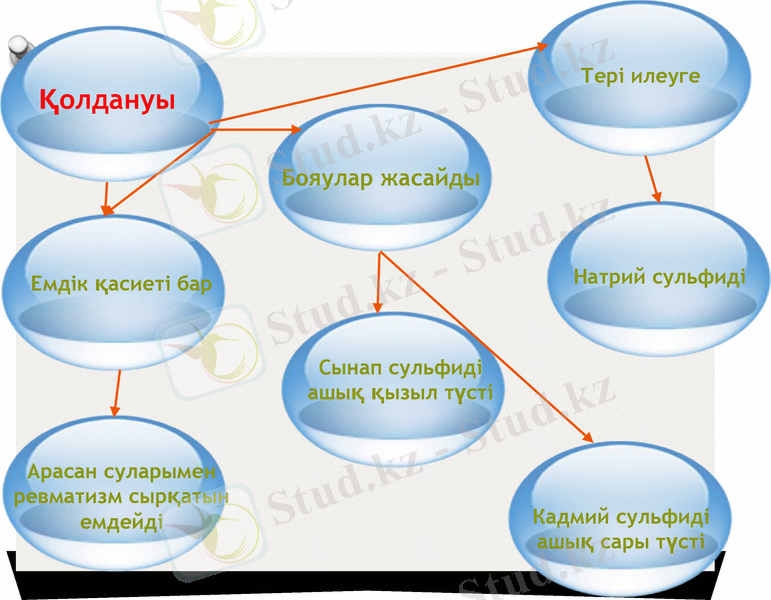
Қолданылуы

Физиологиялық әсері

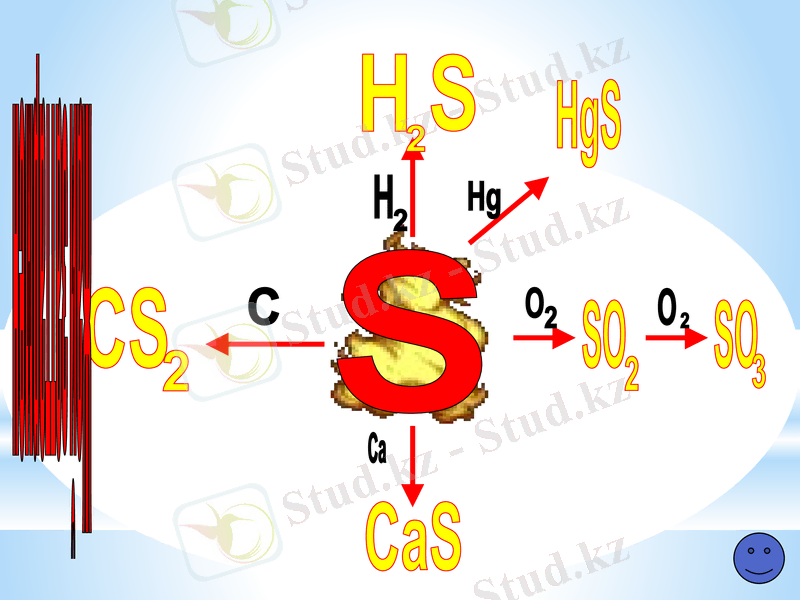
Химиялық қасиеті
S
S
Н
2
Н
2
HgS
SO
SO
3
O
2
O
2
СaS
CS
2
C
Ca
Жай заттармен
2
S
Hg

Күкіртті жағу
Жану реакциясы S+O2 =SO2 2S+3О2 = 2SO3

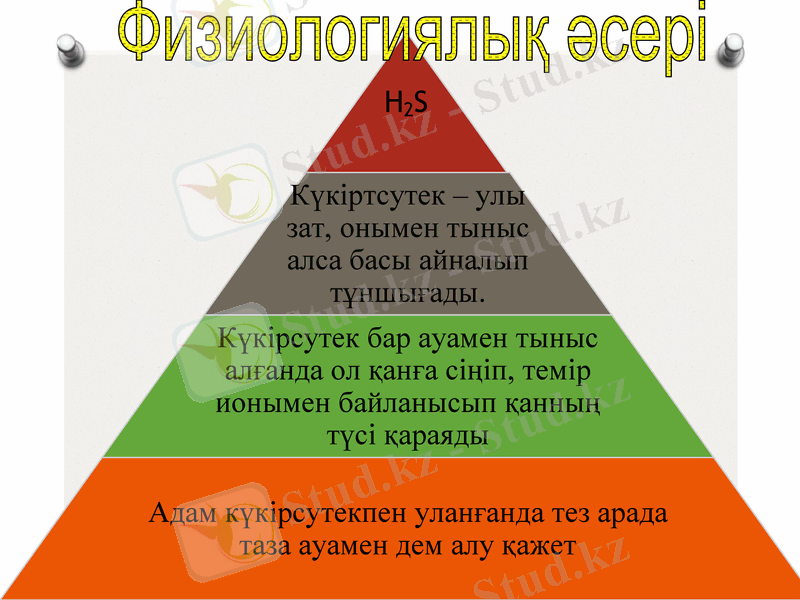
Күкіртсутек
Электрондық формуласы:
. .
H : S : H
. .
Құрылымдық формуласы:
S
H H

Күкіртсутектің химиялық қасиеттері
H2S+NaOH = NaHS+H2O
H2S+CaO =CaS+H2O
H2S+Pb(NO 3 ) 2 =2 HNO3 + PbS↓
Na2S+Pb(NO3) 2 = 2NaNO3 + PbS↓
S 2- +Pb 2+ = PbS↓
Физиологиялық әсері

Күкірт қышқылы
Күкірт қышқылы сутекті алу реагенті болып табылады
Күкірт қышқылы күшті тотықтырғыш болып табылады
Күкірт қышқылы кернеу қатарында тек сутектен дейінгі металдармен ғана емес сутектен кейінгі тұратын металдармен де әрекеттеседі
Барий хлориді сульфатқа сапалық реагенті болып табылады
Кукірт қышқылын өндіру химияда өте күрделі болып келеді

Күкірт қышқылының физикалық қасиеті
Күкірт қышқылы суда ерігенде көп жылу бөле отырып, онымен химиялық реакцияға түсіп, қүрамы әртүрлі гидраттар түзеді. Олар: H2SO4*2O, H2SO4*2H2O, H2SO4*4H2O.
Концентрациялы күкірт қышқылы - түссіз, ұшпайтын, май тәріздес, суда жақсы еритін, сұйық зат. Тығыздығы 1, 84 г/см3, массалық үлесі 98%. Ол 280°С-та қайнайды, ал 10, 4°С-та кристалданады. Күкірт қышқылы күшті су тартқыш зат. Егер концентрациялы қышкыл толтырылған стаканды біраз уакыт ашық калдырса, ауадағы су буын бойына тартып сіңіреді де, қышқыл ыдыстан асып төгіледі. Осы қасиетіне бола күкірт қышқылын түрлі газдарды ылғалдан құрғату үшін пайдаланады. Концентрациялы күкірт қышкылы адам терісіне, матаға, ағашқа тисе, оны карайтып күйдіреді. Сол себепті, күкірт қышқылымен жұмыс істегенде өте сақ болу керек. Теріге немесе матаға тиген күкірт қышқылын тездетіп сумен жуып, содан соң ас содасы ерітіндісімен шаю қажет.

- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz