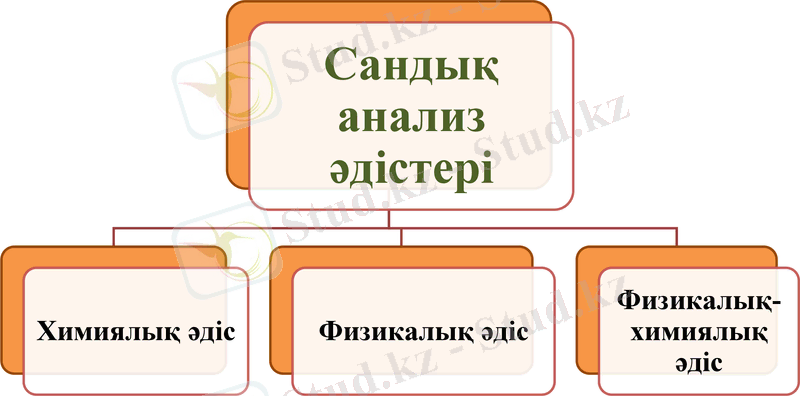
Тотығу-тотықсыздану титрлеу әдістері және перманганатометрия



ҚАЗАҚСТАН РЕСПУБЛИКСЫНЫҢ БІЛІМ ЖӘНЕ ҒЫЛЫМ МИНИСТРЛІГІ ҚАРАҒАНДЫ МЕМЛЕКЕТТІК ТЕХНИКАЛЫҚ УНИВЕРСИТЕТІ
Кафедра: ӨЭ және Х
Тақырыбы: «Тотығу-тотықсыздану титрлеу әдісі»
КУРСТЫҚ ЖҰМЫС
Орындаған: Рахатаева А. А.
Тобы: ХТОВ-15-1
Тексерген: Кабиева С. К.
Карағанды 2016

Жұмыстың мақсаты:
Тотығу-тотықсыздану, титрлеу әлістерін зерттеп, тәжірибе жасай отырып, аталған әдістерге кешенді талдау жасау.
Жобаны орындау сатылары:
І саты: «Тотығу-тотықсыздану титрлеу әдістері» тақырыбы бойынша әдебиет деректерін зерттеу.
ІІ саты: Зертханалық бөлім
Тәжірибелік әдістеме бойынша тәжірибе өткізу;
Тәжірибені талдау, сараптау.
ІІІ саты: Нәтижелерді талқылау. Курстық жоба деректерін ресімдеу.
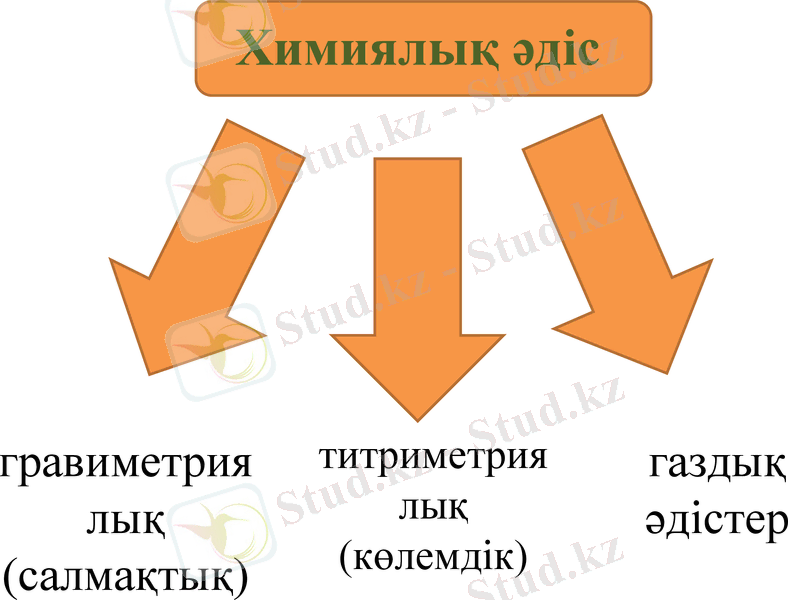
гравиметриялық (салмақтық)
титриметриялық (көлемдік)
газдық әдістер

Титрлеу

Тотығу-тотықсыздану реакциясы
Ох1+Red2→Red1+ Ох2
Ох1 + ne → Red1 Тотықсыздану
(тотықтырғыш)
Red2- ne → Ох2 Тотығу
(тотықсыздандырғыш)
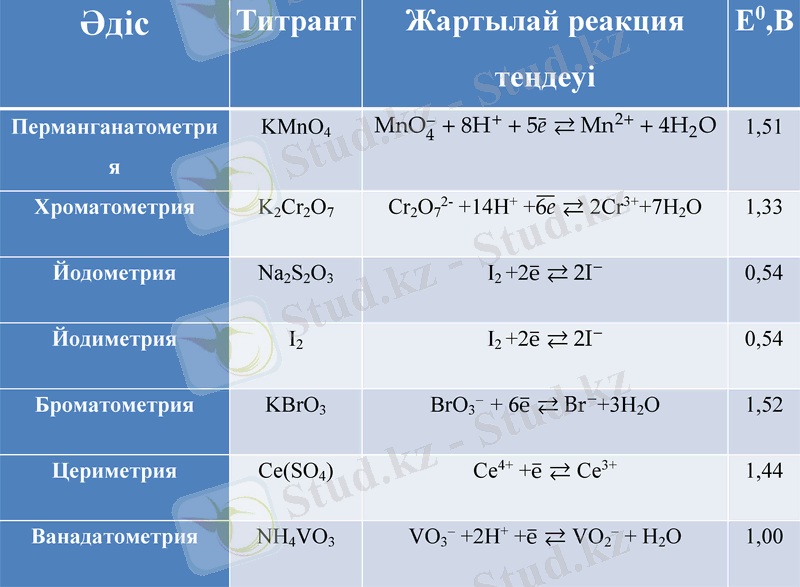

Перманганатометрия
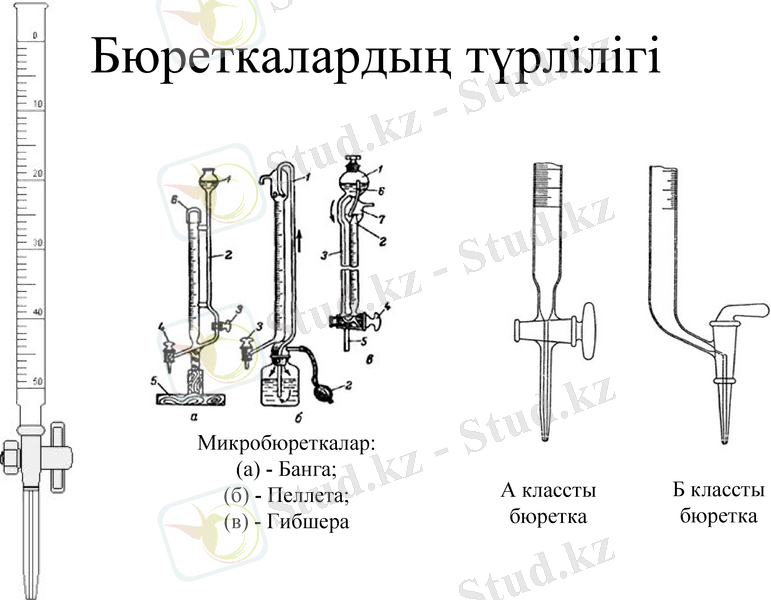
Бюреткалардың түрлілігі
А классты бюретка
Б классты бюретка
Микробюреткалар:
(а) - Банга;
(б) - Пеллета;
(в) - Гибшера

Бюретка құрылысы
1-бюретка деңгейшесі
2-бюретканы қысқыш
3-бюретка
4-ілмекті шүмек(кран)
5-колба
6-анализденетін ерітінді
7-магниттік шайқағыш бар

Калий перманганатының эквиваленттісінің молярлық концентрациясы мен титрін қымыздық қышқылының стандартты ерітіндісі бойынша анықтау

Жұмыстың барысы
1. Өлшеуірге калий перманганаты ерітіндісін құяды және деңгейін нөлге келтіреді.

4. Ыстық ерітіндіні өлшеуірден алып калий перманганатының ерітіндісімен титрлейді. Әрбір кезекті тамшыны алдыңғы тамшының түсі жойылғанда ғана тамызады.


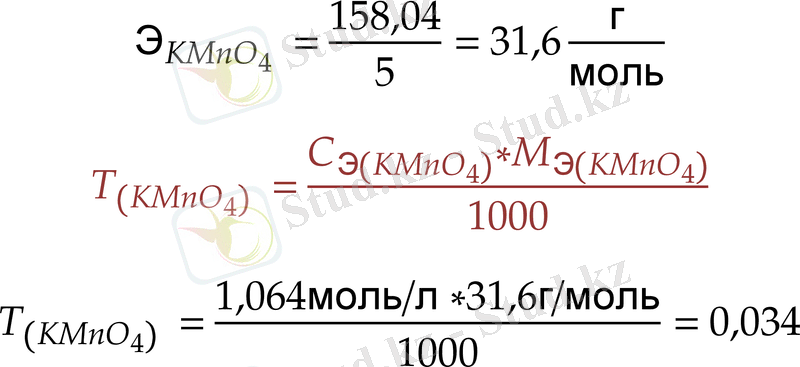

Перманганатометриялық әдістің кемшіліктері:
(MnO2) реагентінің салыстырмалы ластануы себебінен, перманганат екіншілік стандарт болып табылады;
Стандартты ерітіндінің тұрақсыздығы;
Хлорид ионы қатысында тотықсыздану жүрмейді;
Жылытуды жиі қажет етеді, себебі реакция жылдамдығы өте төмен.

Перманганатометриялық әдістің артықшылықтары:
Түстің өзгеруі кезінде титрлеудің соңғы нүктесінің болу мүмкіндігі;
Қышқыл немесе сілтілік ортада жүру мүмкіндігі;
Перманганат калийдің редокс-потенциалының жоғары болуы;
Арзан және қолжетімді реагент;
Тотығу-тотықсыздану қасиеттері жоқ заттарды анықтау мүмкіндігі.

Қорытынды
Сандық анализдің осындай қолайлы әдістерін біле отырып, әр түрлі заттарды анықтауға болады. Мысалы, жасалынған тәжірибелік жұмыс арқылы перманганатометрия әдісінің мәні ашылды. Перманганометрияны келесі мақсаттарда қолданады:
1. Тотықтырғыштарды және анықтауға; 2. Тотығу-тотықсыздану қасиеттері жоқ заттарды анықтауға; 3. Органикалық қосылыстарды анықтауға;
4. Өндірісте сүт және сүттен жасалған тағамдарды анализдеуге.
Тікелей перманганатометрия титрлеу әдісімен кез келген анықтайды.

Пайдаланған әдебиеттер тізімі
Маденова П. С. Аналитикалық химия: оқу құралы. -Алматы, 2012, - 211б
Логинов Н. Я., Воскресенский А. Г., Солодкин И. С. - М. : Просвещение, 1975 - 478 с.
Отто М. Современные методы аналитической химии т. 1, 2. М., Техносфера, 2003.
Васильев В. П. Аналитическая химия (оқулық) . ДРОФА, 2005 - 383 с.
Мұсабаева Б. Х. Аналитикалық химия әдістері: оқу құралы. -Семей: Семей қ. Шәкәрім атынд. мемл. ун., 2015, - 161б.
Цитович И. К. Курс аналитической химии. М., 2004
Ногаева А. Н., Сотченко Р. К. Аналитикалық химия: сапалық анализ. Оқу-әдістемелік құрал. Қарағанды: ҚММА, 2010-72б.
Молдақалыкова А. Ж. Аналитикалық химия пәнінің сапалық анализ бөлімі бойынша лабораториялық жұмыстар. Оқу құралы. Алматы, 2008. -192б
Патсаев Ә. Қ, Жайлау С. Ж., Шыназбекова Ш. С., Махатов Б. Қ. Аналитикалық химия. - Алматы, ЖШС «Эверо» 2012. - 473 б.
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz