Термодинамика негіздері: идеал газдың ішкі энергиясы, жылусыйымдылықтар, Карно циклы және энтропия



ТЕРМОДИНАМИКА НЕГІЗДЕРІ
Kazakh national medical university from S. J. Asfendiyarov
С. Д. Асфендияров атындағы қазақ ұлттық медицина университеті
Орындаған: Оразбаева Жансая
Топ: 18-008-1
Тексерген: Байдулаева Г. Е.

Идеал газдың ішкі энергиясы Газдың ұлғаю жұмысы
Термодинамиканың бірінші заңы
Жылусыйымдылқ теориясы
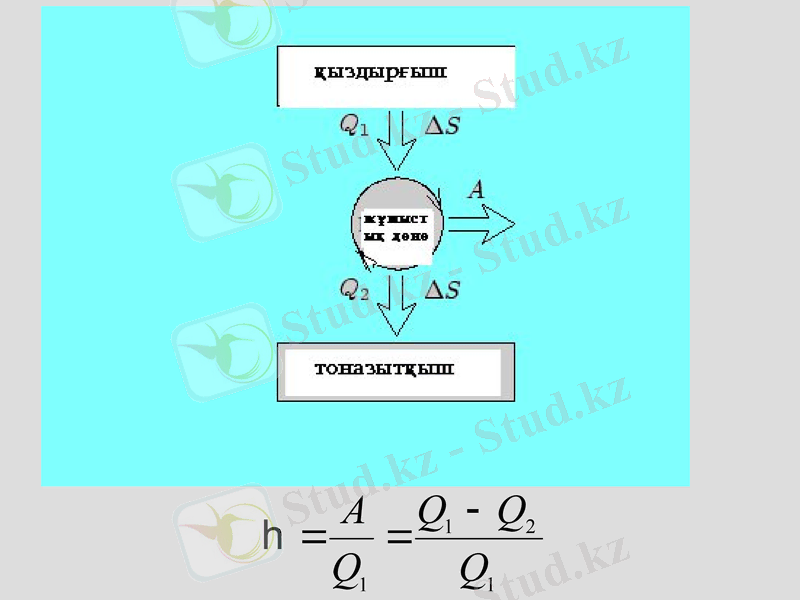
Карно циклы және оның ПӘК
Энтропия. Энтропииның ықтималды салыстырмалы күйімен байланысы Термодинамиканың екінші заңы және оның физикалық мәні
Жоспары

Идеал газдың ішкі энергиясы
Идеал газдың ішкі энергиясы оның молекулаларының кинетикалық энергиясынан тұрады
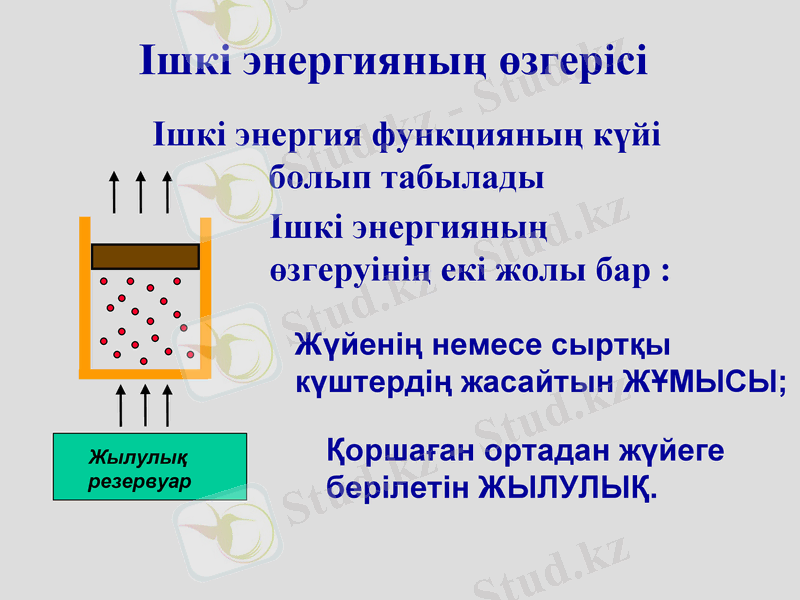
Ішкі энергияның өзгерісі
Ішкі энергия функцияның күйі болып табылады
Ішкі энергияның өзгеруінің екі жолы бар :
Жүйенің немесе сыртқы күштердің жасайтын ЖҰМЫСЫ;
Қоршаған ортадан жүйеге берілетін ЖЫЛУЛЫҚ.
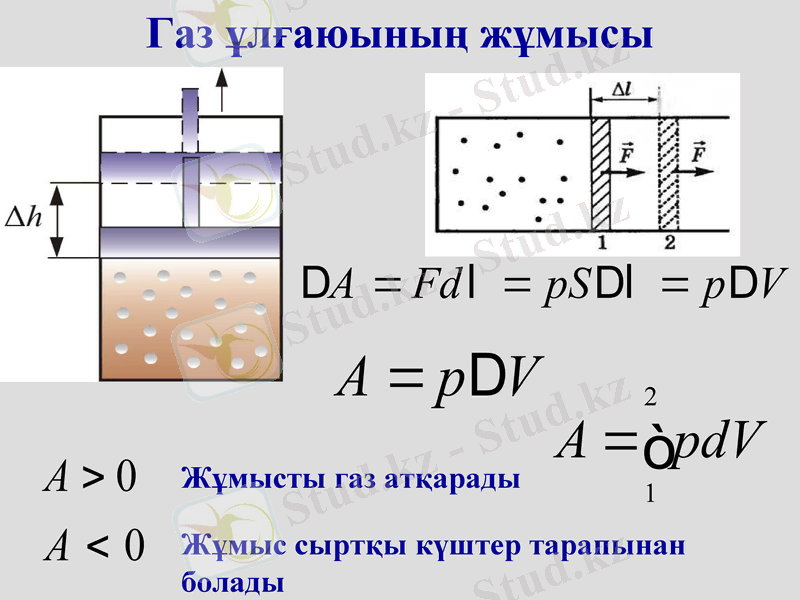
Газ ұлғаюының жұмысы
Жұмысты газ атқарады
Жұмыс сыртқы күштер тарапынан болады
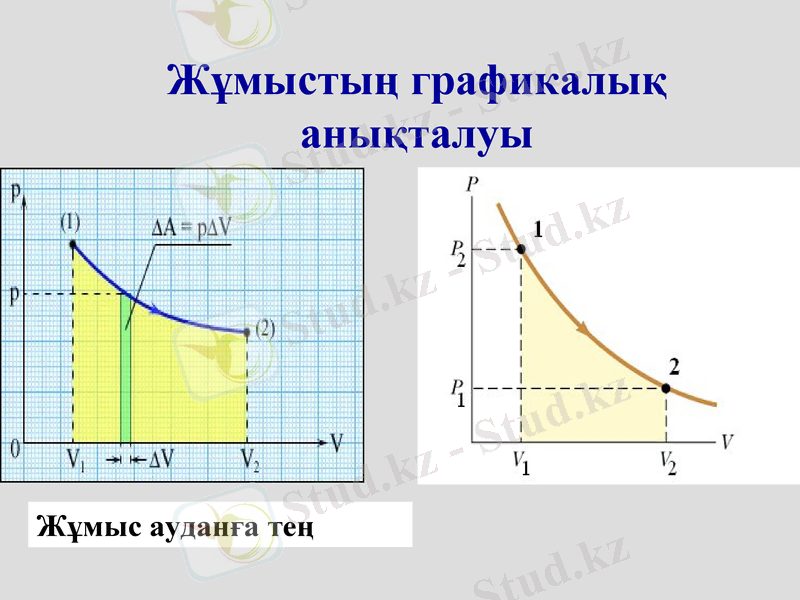
Жұмыстың графикалық анықталуы
Жұмыс ауданға тең
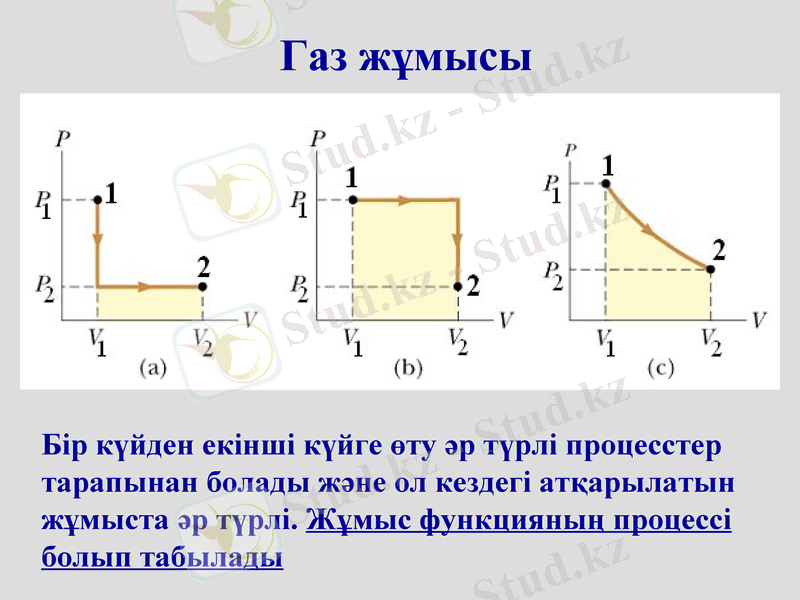
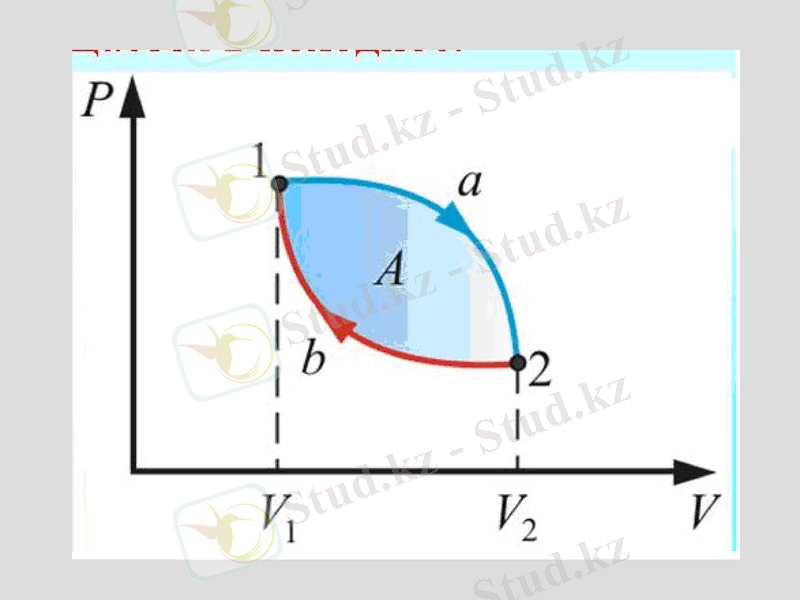
Бір күйден екінші күйге өту әр түрлі процесстер тарапынан болады және ол кездегі атқарылатын жұмыста әр түрлі. Жұмыс функцияның процессі болып табылады
Газ жұмысы
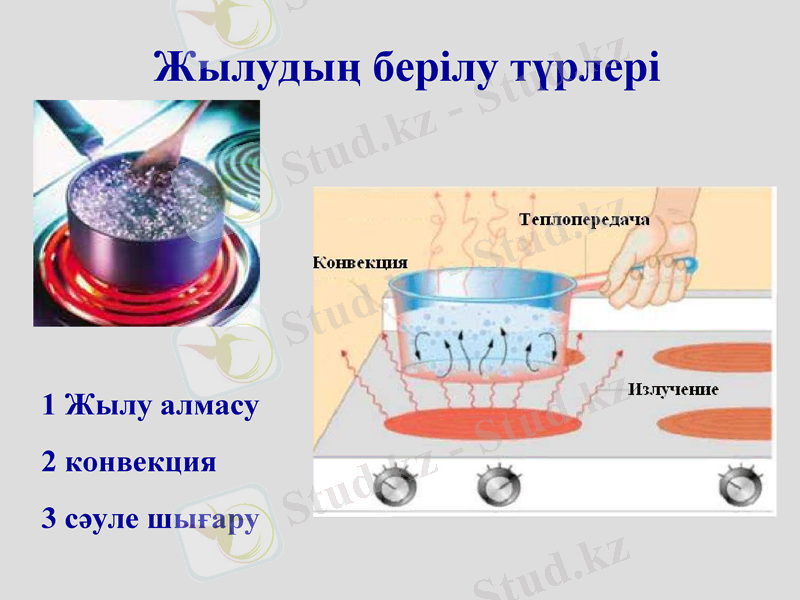
Жылудың берілу түрлері
1 Жылу алмасу
2 конвекция
3 сәуле шығару
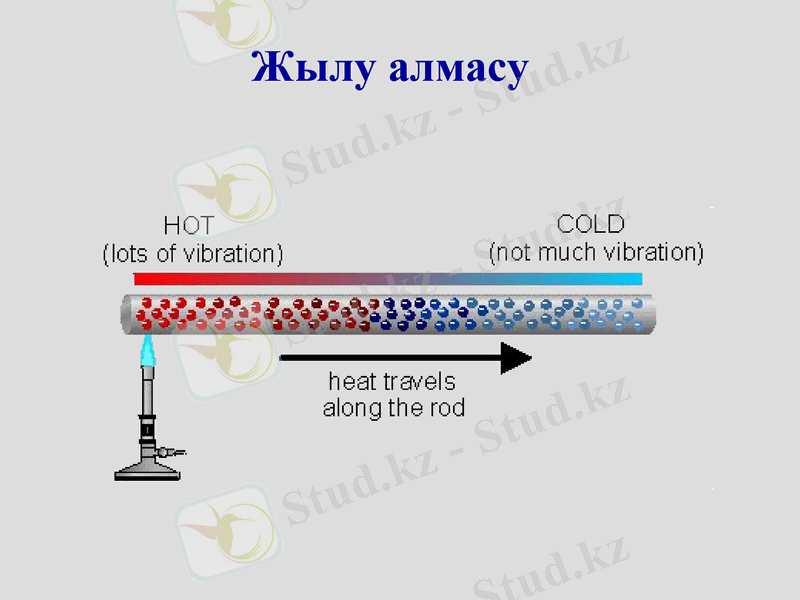
Жылу алмасу
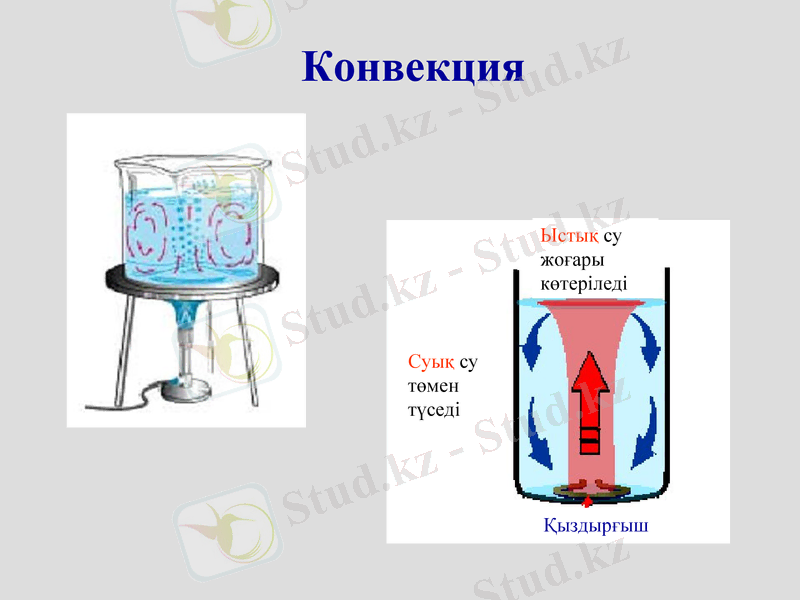
Конвекция
Ыстық су жоғары көтеріледі
Суық су төмен түседі
Қыздырғыш
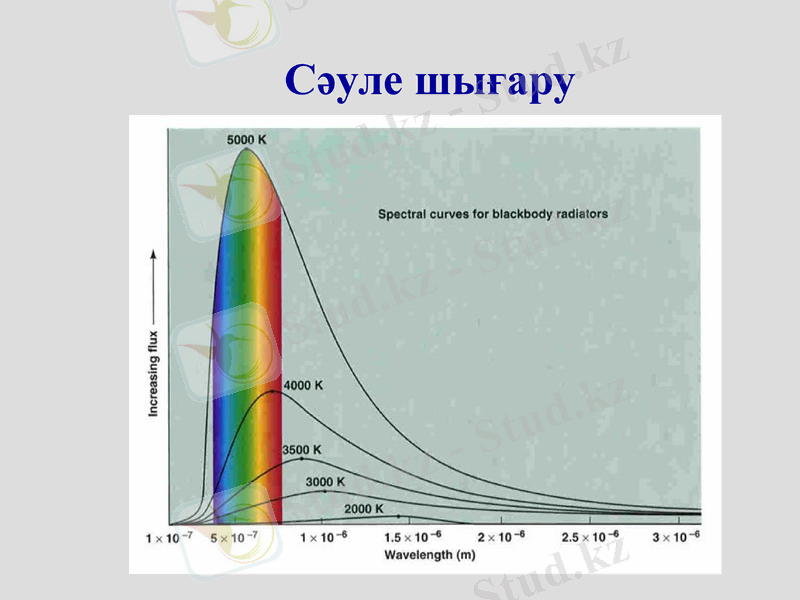
Сәуле шығару

Термодинамиканың бірінші заңы

Жылусыйымдылық
Меншікті жылусыйымдылық
Мольлық жылусыйымдылық

Жылусыйымдылық процесс түріне байланысты
Тұрақты көлемдегі мольдық жылусыйымдылық
Тұрақты қысымдығы мольдық жылусыйымдылық
Мольдық жылусыйымдылық арасындағы байланыс (Майер теңдеуі)
Пуассона коэффициенті (адиабата көрсеткіші)

Изобаралық процесс

Изохоралық процесс
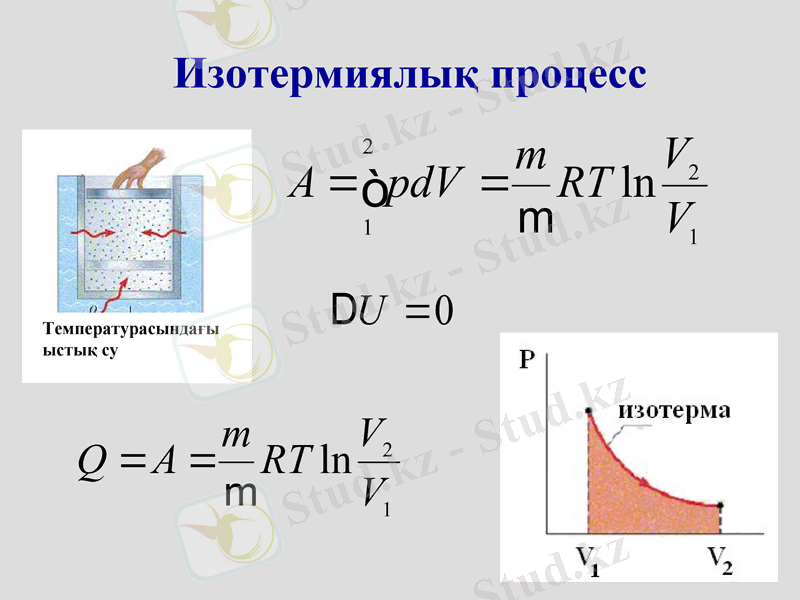
Изотермиялық процесс
Температурасындағы ыстық су

Адиабаталық процесс
Адиабаталық процесс кезінде қысымның ұлғаюы көлемнің кішіреуі мен температураның жоғарылауына тәуелді. Процесстің теңдеуі:

Энтропия
қайтымды процесс үшін
келтірілген жылу мөлшері
Клаузиус өлшем енгізді, оны энтропия деп атады:

Энтропия
Больцман энтропияны термодинамикалық ықтималдығымен байланыстырды :
Энтропия жүйенің біркелкілік емес шамасы; үлкен энтропия үлкен хаосқа соқтырады

Термодинамиканың екінші бастамасы
Суық денеден ыстық денеге жылу берілу мүмкін емес
Бір рет қана берілген жылудың көмегімен сыртқы ортаның қасиетін өзгертпей мәңгі қозғалтқыш алу мүмкін емес
Оқшауланған жүйедегі энтропия ондағы барлық процесстерде кеміді
Қайтымды процесстер үшін
Кайтымсыз процесстер үшін

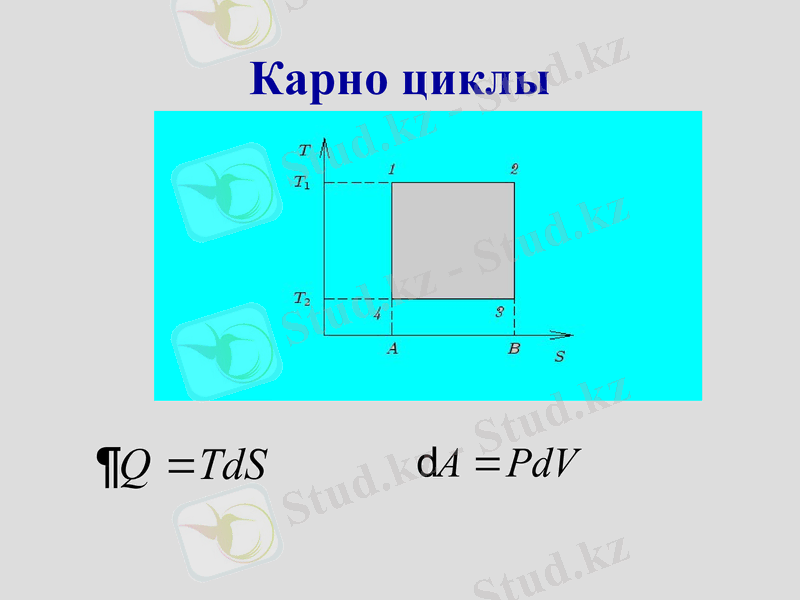
Карно циклы
1-2 изотерма
2-3 адиабата
3-4 изотерма
4-1 адиабата
Карно циклы


Глосарий
Термодинамика - физика ғылымындағыжылудың жұмыс және басқа энергиятүрлерімен арадағы қарым-қатынасын зерттейтін тармағы.
Температура - макроскопикалық жүйенің термодинамикалық тепе-теңдік күйін сипаттайтын физикалық шама.
Энтальпия-жылулық функция, жылу мөлшері - термодинамикалық жүйе күйінің функциясы болып келетін жылуға қатысты шама.
Энтропия - тұйық термодинамикалық жүйедегі өздігінен жүретін процестің өту бағытын сипаттайтын күй функциясы. Энтропияның күй функциясы екендігі термодинамиканың екінші бастамасында тұжырымдалады.
Ішкі энергия - дененің (жүйенің) тек ішкі күйіне байланысты энергия.
Термодинамика- раздел физики, изучающий наиболее общие свойства макроскопических систем и способы передачи и превращения энергии в таких системах.
Температу́ра - физическая величина, характеризующая термодинамическую систему и количественно выражающая интуитивное понятие о различной степени нагретости тел.
Энтальпи́я - функция состояния H термодинамической системы, определяемая как сумма внутренней энергии U и произведения давления P на объём V.
Энтропия - это функция состояния, описывающая ход самоходного процесса в замкнутой термодинамической системе. Тот факт, что энтропия является функцией функции, формируется со второй попытки термодинамики.
Вну́тренняя эне́ргия - принятое в физике сплошных сред, термодинамике и статистической физике название для той
части полной энергии термодинамической системы, которая не зависит от выбора системы отсчета[1] и которая в рамках рассматриваемой проблемы может изменяться.
Thermodynamics is the branch of physicsthat has to do with heat and temperature and their relation to energy and work.
Temperature is a physical quantity expressing hot and cold. It is measured with a thermometer calibrated in one or more temperature scales.
Enthalpy is a function of the state H of the thermodynamic system, defined as the sum of the internal energy U and the product of pressure P and volume V.
Entropy is a state function describing the course of a self-propelled process in a closed thermodynamic system. The fact that entropy is a function of a function is formed from the second attempt at thermodynamics.
Internal energy is a name adopted in continuum physics, thermodynamics, and statistical physics for that part of the total energy of a thermodynamic system that does not depend on the choice of reference system [1] and which can be changed within the framework of the problem under consideration.

Гельмгольц энергиясы - ішкі энергия (U) және термодинамикалық температура (Т) мен энтропияның (S) көбейтіндісінің арасындағы айырыммен анықталатын белгіленуі термодинамикалық потенциалдардың бірі.
Изотермиялық процесс - физикалық жүйеде тұрақты температурада жүретін процесс; термодинамикалық күй диаграммасында изотермамен кескінделеді
Изохоралық процесс - физикалық жүйеде тұрақты көлемде жүретін процесс. Ол термодинамикалық күй диаграммасында изохорамен кескінделеді.
Изобаралық процесс - сыртқы тұрақты қысымда физикалық жүйеде өтетін процесс.
Энергия (гр. energeіa - әсер, әрекет) - материя қозғалысының әртүрлі формасының жалпы өлшеуіші.
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz