Дәрілік препараттардың мөлшерін титриметриялық әдістермен анықтау: әдістер мен есептеулер



ПРЕЗЕНТАЦИЯ Такырыбы: Титриметриялық әдістермен дәрілік препараттардың мөлшерін анықтау.
Орындаған: Мұратхан И
Тобы 202ФКБ
Қабылдаған:Рысымбетова Ж.
Оңтүстік Қазақстан Медицина академиясы
Химиялық пәндер кафедрасы
Шымкент-2018

Жоспары:
І. Кіріспе
ІІ. Негізгі бөлім
1. Титриметриялық анализдің мәні.
2. Титриметриялық талдау әдісінің жіктелуі.
4. Титриметриялық анализ нәтижелерін есептеу.
ІІІ. Қорытынды
ІV. Пайдаланылған әдебиеттер

Титриметриялық талдау
Титриметриялық анализде тирленген ерітінділер қолданылады. Концентрациясы өте дәл анықталатын ерітінділерді титрленген (қалыпты) ерітінділер, жұмыс ерітіндісі немесе титранттар деп аталады.
Ерітіндінің бір куб сантиметріндегі (бір миллилитріндегі) еріген зат массасын титр дейді.

Стандартты ерітінділер
Оларға көтеген тұздар (натрий тетрабораты, натрий оксалаты, натрий хлориді, калий дихроматы), қымыздық қышқылы т. б. жатады. Оны даярлау үшін дәл өлшеніп алынған затты өлшеуіш колбаға салып ерітіп, суды белгіге жеткізеді. Еріген зат массасы (m, г) және өлшеуіш колбаға көлемі (V) бойынша ерітінді титрін Т есептейді:
Т= m/ V
Титрі бойынша ерітінді нормальдылығын табу үшін титрді 1000-ға көбейтіп, эквивалентке (Э) бөледі:
N =
Заттың дәл өлшенген мөлшерінен ерітілген титрленген ерітіндіні стандартты (даярлаған) дейді.
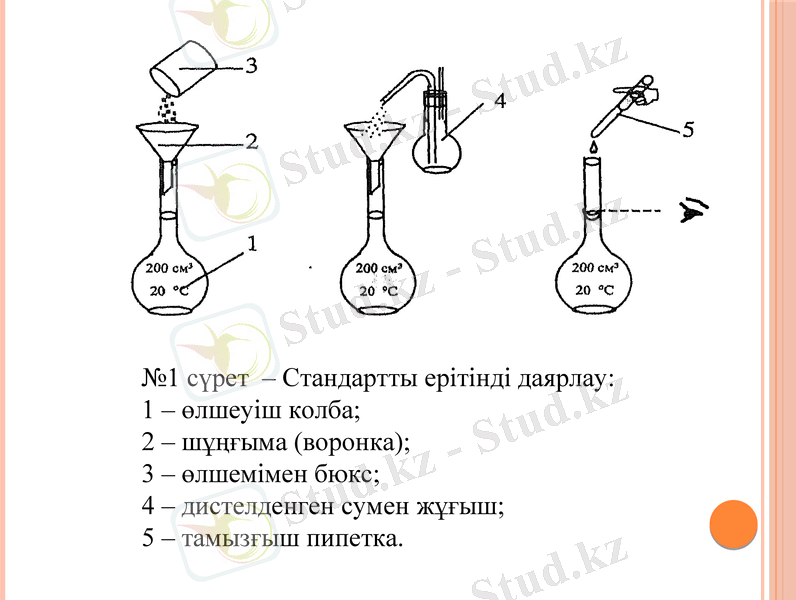
№1 сүрет - Стандартты ерітінді даярлау:
1 - өлшеуіш колба;
2 - шұңғыма (воронка) ;
3 - өлшемімен бюкс;
4 - дистелденген сумен жұғыш;
5 - тамызғыш пипетка.

Мысалы:
0, 5312 г натрий карбонатын Na2CO3 100мл-ге арналған өлшеуіш колбада ерітсек, түзілген ерітінді титрі:
Т=
N= болады.

Стандартталған ерітінділер
Дәл концентрациясы нақты өлшенген мөлшерінен емес, басқа стандартты ерітінді бойынша анықталатын титрант ерітіндісін стандартталған дейді.
Химиялық анализде ерітінділерді фиксаналдардан немесе стандарт-титрден даярлайды. Фиксанал-1л 0, 1н не 0, 01н ерітінді даярлауға арналған шыны ампула.

Титриметриялық талдаудағы есептеулер
Титриметриялық талдауда концентрациялар титр, анықталатын зат бойынша титр, түзету коэффициенті, массалық үлес, молярлы, нормальді түрде өрнектелген ерітінділерді пайдаланады.
1. Ерітіндінің массалық үлесін есептеу:
Мұндағы:
- еріген заттың массасы, г;
- ерітіндінің массасы, г.

2. Ерітіндінің молярлы концентрациясын есептеу:
немесе
Мұндағы:
- моль саны, моль;
V- ерітіндінің көлемі, см3;
- ерітіндінің тығыздығы, г/см3;
- ерітіндінің массалық үлесі, %;
М - заттың молярлы массасы, г/моль.

3. Ерітіндінің нормальді концентрациясын есептеу:
немесе
Мұндағы:
- моль саны, моль;
V- ерітіндінің көлемі, см3;
- ерітіндінің тығыздығы, г/см3;
- ерітіндінің массалық үлесі, %;
Э -эквивалентінің молярлы массасы, г/моль.
- эквиваленттік факторы;

4. Көлемі белгілі ерітінді дайындау үшін өлшендінің массасын есептеу:
Мұндағы:
- химиялық таза заттың өлшенді массасы, г;
N -ерітіндінің нормальді концентрациясы;
W - ерітіндінің көлемі, см3;
Э -эквивалентінің молярлы массасы, г/моль.

Егер зат лайланған болса келесі формуланы пайдаланамыз:
Мұндағы:
- химиялық таза заттың өлшенді массасы, г;
N -ерітіндінің нормальді концентрациясы;
W - ерітіндінің көлемі, см3;
Э -эквивалентінің молярлы массасы, г/моль.
С% - анықталатын компоненттің мөлшері, %.

Тығыздығы белгілі сұйық заттарды пайдаланған кезде өлшенді (см3) келесі формула бойынша есептеледі:
Мұндағы:
V -өлшендінің көлемі, см3;
N -ерітіндінің нормальді концентрациясы;
W - ерітіндінің көлемі, см3;
Э -эквивалентінің молярлы массасы, г/моль.
С% - анықталатын компоненттің мөлшері, %.
- ерітіндініңтығыздығы, г/см3;

5. Ерітіндінің титрін есептеу:
немесе
Мұндағы:
Т - ертіндінің титрі, г/см3;
- өлшендінің массасы, г;
W - ерітіндінің көлемі, см3;
N -ерітіндінің нормальді концентрациясы;
Э -эквивалентінің молярлы массасы, г/моль.

Анықталатын зат бойынша титрі келесі формуламен есептеледі:
Мұндағы:
ТВ/А - анықталатын зат бойынша титрі, г/см3;
NВ - титранттің нормальді концентрациясы;
ЭА- анықталатын заттыңэквивалентінің молярлы массасы, г/моль.

Титрлеу барысында эквиваленттік нүктеге дейін немесе эквиваленттік нүктеден кейін анықталатын заттың немесе титранттың концентрациялары келесі формула бойынша есептеледі:
Эквиваленттік нүктеге дейін артық мөлшерде анықталатын зат болады, эквиваленттік нүктеден кейінгі - титрант.

7. Зерттелетін ерітіндегі анықталатын заттың мөлшері келесі формулалар арқылы есептеуге болады:
(г, жеке өлшенділерді титрлеу әдісі)
(г, тамшылатуәдісінде)
(%, жеке өлшенділерді титрлеу әдісі)
(%, тамшылатуәдісінде)
Мұндағы:
gА - анықталатын зат, г;
NВ -титрантің нормальді концентрациясы;
VВ -титрантің көлемі, см3;
ЭА-анықталатын заттыңэквивалентінің молярлы массасы, г/моль;
WА -зерттелетін ерітіндінің көлемі, см3;
VА -зерттелетін ерітіндінің аликвоттік көлемі, см3;
-зерттелетін ерітінді дайындау үшін өлшендінің массасы, г.

Егер анықталатын зат бойынша титр қолданатын болса, онда келесі формулалар пайдаланамыз:
(г, жеке өлшенділерді титрлеу әдісі)
(%, жеке өлшенділерді титрлеу әдісі)
(г, тамшылату әдісінде)
(%, тамшылату әдісінде)

Кері титрлеу барасында екі титрант пайдаланады, сондықтан анықталатын заттың мөлшері келесі формулалар арқылы есептейді:
(г, жеке өлшенділерді титрлеу әдісі)
(%, жеке өлшенділерді титрлеу әдісі)
(г, тамшылату әдісінде)
(%, тамшылату әдісінде)

Кейде титранттың теориялық нормальдылығын ТВ/А алып, анықталатын заттың мөлшерін есептейді. Сол кезде титранттың теориялық нормальдылығының түзету коэффициентін білу керек және есептеулер келесі формулалар бойынша жүргізлеуді:
(г, жеке өлшенділерді титрлеу әдісі)
(%, жеке өлшенділерді титрлеу әдісі)
(г, тамшылату әдісінде)
(%, тамшылату әдісінде)

8. Титранттың түзету коэффициентін есептеу:
Мұндағы:
К -титранттыңтүзету коэффициенті;
- концентрациясы;
- титранттің теориялық нормальді концентрациясы.

Титриметриялық анализ әдістерінің жіктелуі
Титриметриялық анализ кезінде химиялық реакция типіне қарай үш топқа бөлінеді:
Иондар қосылу реакциясына негізделген әдістер;
Тотығу-тотықсыздану реакциясына негізделген әдістер;
Комплекс түзу реакциясына негізделген әдістер.
Титриметриялық талдау әдістері көрсетілген жіктеу ішінде қолданылатын титранты бойынша бөлінеді, мысалы ацидо- және алкалиметриялы, перманганато-, бромато-, иодо-, иодато-, цери-, комплексонометриялы және т. б.

Титриметриялық талдаудағы салыстырмалы қателігі ±0, 2%, ал макробюретканың көмегімен көлемдерін өлшеудің абсолюті қателігі ±0, 04 см3. Бұдан шығатын, қателігі ±0, 2% артық болмағанның минималді көлемін есептеуге болады:
Мұндағы:
- өлшеудің абсолютты қателігі, см3;
А - өлшеудің салыстырмалы қателігі, %.

Титрлеудің тәсілі бойынша титрлеу тура, кері және жанама (немесе орын басатын) деп бөлінеді.
Тура титрлеу кезінде анықтайтын компоненттің ерітіндісін тікелей стандартты ерітіндімен титрлейді.
Егер тура реакция қандай болса да бір себептен мүмкіндігі болмаса немесе қиындық келтірсе, онда кері немесе жанама жолмен титрлейді. Тура титрлеу үшін сәйкес индикатор іріктеп алуға болмаған жағдайда кері әдіспен титрлейді.
Кері титрлеу барысында екі титрант қолданады. Мұндай жағдайда зерттелетін ерітіндіге эквиваленттік мөлшерімен әрекеттесетін нақты өлшенген қосалқы титранттың артық мөлшерін қосады. Реакция аяқталған соң заттың артық мөлшерін екінші титранттың ерітіндісімен титрлейді.
Жанама немесе орын басу титрлеу барасында зерттелетін ерітіндіге қосалқы реагент қосады, нәтижесінде анықталатын мөлшердегі түзілген жана қосылысты стандартты титранттпен титрлейді.

Қышқылдық-негіздік титрлеу
Қышқылдық-негіздік титрлеу әдісі (бейтараптау) қышқыл мен негіз әрекеттесуіне, яғни бейтараптау реакциясына негізделген:
NaOH + HCI = NaCI + H2O
OH- + H+ = H2O
Бұл әдіс арқылы ерітіндідегі қышқыл мен негіз мөлшерін ғана емес, суда ерігенде гидролизге ұшырайтын тұздар мөлшерін де анықтауға болады.

Қышқылдық-негіздік титрлеудің екі түрі болады: ацидиметрия және алкалиметрия.
Ацидиметрия - титрлеу кезінде титрант ретінде қышқыл ерітінділері пайдаланылып, негіздердің не тұздардың мөлшерін анықтайды.
Алкалиметрия - титрлеу кезінде титрант ретінде сілті ерітінділері пайдаланылып, қышқылдардың не тұздардың мөлшерін анықтайды.

Комплексометриялық әдістер бойынша титрлеу
Зерттелетін затпен титранттын нашар иондалған кешендерді түзуге негізделген .
Комплексонометриялық титрлеуде -трилон Б- мен титрлеу
Na2H2Y · 2H2O:
Са2+ + Н2Y2- = CaH2Y Mg2+ + Н2Y2- = MgH2Y
Н2Y2- =
Титрлеудің соңғы нүктесін металлиндикатормен немесе патенциометриялау арқылы анықтайды.

Тұнбалы әдіспен титрлеу
Зерттелетін зат өзара титрантпен байланысқан кезде аз еритін қосылыстар түзеді.
Бұл әдістің кеңінен пайдаланатын түрі - аргентометриялық титрлреу болып табылады, ол өз алдында аниондардың концентрациясын анықтауға мүмкіндік береді (Hal-, CN-, PO43-, CrO42- и др. ), олар аз еритін заттармен байланысқа түседі:
Ag+ + Cl- = AgCl↓

Тотығу-тотықсыздану титрлеу әдісі
Перманганатометрия. Бихроматометрия. Иодометрия.
KMnO4 → K+ + MnO4-, MnO4- күшті тотықтырғыш, ол реакция ортасына байланысты тотықсызданады: қышқыл ортада
MnO4- + 5e + 8H+→ Mn2+ + 4H2 O E = 1. 51в, mэ = M(KMnO4) /5 = 31. 5г/моль. Негіздік, бейтарап ортада MnO4- + 3e + 3H2O→MnO(OH) 2 +4OH-
mэкв. = M( KMnO4) /3 = 52. 68г/моль, E = 0. 59в.
Бұл реакциялардан KMnO4 - тің қышқыл ортадағы тотықтырғыш қабілетінің жоғарылылығын көруге болады. Сонымен бірге түссіз Mn2+ - ионы түзіледі, сондықтан эквивалент нүктені анықтау қиындық туғызбайды.

- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz