Аниондардың жіктелуі, қасиеттері және медицинадағы қолданылуы



Презентация
Тақырыбы: Аниондардың жіктелуі
Орындаған: Аймахан Н. Ә.
Қабылдаған:
ОҢТҮСТІК ҚАЗАҚСТАН МЕДИЦИНА АКАДЕМИЯСЫ
Химиялық пәндер кафедрасы

Жоспар
І. Кіріспе
1. Аниондар
ІІ. Негізгі бөлім
Аниондардың жіктелуі
Тотықтыру - тотықсыздандыру қасиеттеріне орай аниондардың бөлінуі
Бақылау сұрақтары
ІІІ. Қорытынды
ІV. Пайдаланылған әдебиеттер

Анион - бір немесе бірнеше атомнан тұратын теріс зарядты бөлшектер . Аниондар химиялық реакцияларда катализатор рөлін атқарады, электр өрісінде электр тогын оң электродқа қарай тасымалдайды. Соңғы құбылыс ерітінділердің электролизі кезінде де байқалады. Аниондар геохимияда, технология және тірі организмде болатын процестерде үлкен маңыз атқарады. Анион - теріс зарядталған, сондықтан электролиз жағдайында оң зарядталған электрод не анод төңірегінде шоғырланатын ион.

Аниондар негізінен периодтық системадағы 4, 5, 6, 7 топтық элементтерін түзеді. Яғни бүл элементтерге: С, N, O, F, CI, J, Si, S, P, Cr, Mn, As, V, Se т. б. жатады. Жалпы және бейорганикалық химия курсынан бүл элементтердің периодтық системадағы түратын орнына, сыртқы электрон қабатының орналасуына, атом радиусын т. б. қасиеттеріне байланысты түрлі аниондар түзетіндігі белгілі.

Бір элементтің өзі бірнеше аниондар бере алады. Мысалы, күкірт элементі сульфид (S2-), сульфит(SO3 2-), сульфат (SO4 2-) аниондары түрінде кездеседі. Аниондар жай және күрделі аниондар болып бөлінеді. Мысалы, хлорид-ионы (CI- ) - жай анионға, ал гипохлорид (CIO- ), перхлорат (CIO4 - ), хлорат (CIO3 - ) аниондары күрделі аниондарға жатады.
Барлық аниондар қышкылдардың немесе түздардың қүрамына кіретіндіктен олардың қасиеттері әртүрлі болады.

Бір элементтің анионы белгілі жағдайдың өзгеруіне байланысты басқа анионға немесе қосылысқа айналуы мүмкін. Мысалы, сульфит-ион концентрлі минералды қышқылдардың ерітіндісіне тотығу-тотықсыздану реакциясы нәтижесінде күкірттің диоксидіне дейін тотықсызданады.

Кейбір аниондардың түрақтылғы ерітіндінің ортасына (рН) байланысты өзгереді. Мысалы, карбонаттарды сілтілерде ерітсе, оның қүрамындағы (CO3 2-) -анионы өзгермей сол күйінде қалады, ал қышқылдарда ерітсе, бүл анион қөміртегі диоксиді (CO2) түрінде бөлініп шығады
CO3 2- + 2H+ = CO2 + H2O

Аниондарды жіктеу барий мен күмістің олармен суда ерімейтін тұздар түзуіне негізделген. Осы жіктеу бойынша аниондарды үш топқа бөледі.

№
Аниондар
Топтық реагент
Тұнба құрамы және топтық қасиеттері
1
SO4 2- сульфатті-ион
SO3 2- сульфитті -ион
S2O3 2-тиосульфатті-ион
CO3 2- карбонатті -ион
PO4 3- фосфатті -ион SiO3 2- силикатті -ион
C2O4 2- оксалатті -ион
B4O7 2- тетраборат
AsO3 3- арсенит
AsO4 3- арсенат
CrO4 2- хромат
F- фторид
Cr2O7 2- дихромат
BaCI2 нейтрал, я болмаса әлсіз сілтілік ортада
Суда және қышкылда ерімейді. Барий түздары түнбаға түседі: BaSO4, BaSO3, BaCO3, BaS2O3, BaSiO3, Ba3(PO4) 2, BaC2O4
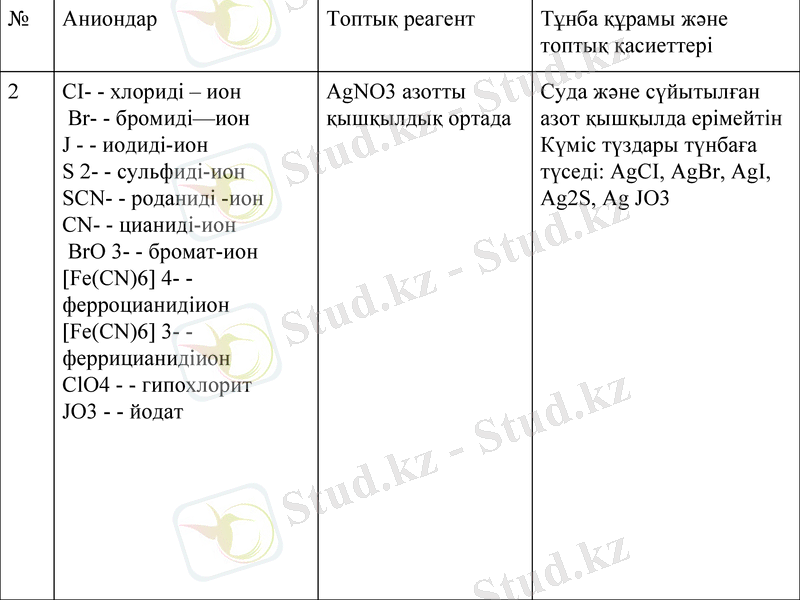
№
Аниондар
Топтық реагент
Тұнба құрамы және топтық қасиеттері
2
CI- хлориді - ион
Br- бромиді-ион
J - иодиді-ион
S 2- сульфиді-ион
SCN- роданиді -ион
CN- цианиді-ион
BrO 3- бромат-ион [Fe(CN) 6] 4- ферроцианидіион [Fe(CN) 6] 3- феррицианидіион
ClO4 - гипохлорит
JO3 - йодат
AgNO3 азотты қышқылдық ортада
Суда және сүйытылған азот қышқылда ерімейтін
Күміс түздары түнбаға түседі: AgCI, AgBr, AgI, Ag2S, Ag JO3
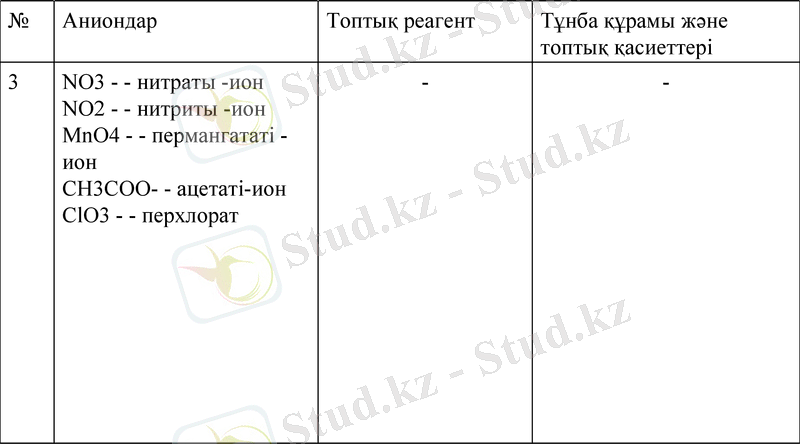
№
Аниондар
Топтық реагент
Тұнба құрамы және топтық қасиеттері
3
NO3 - нитраты -ион NO2 - нитриты -ион MnO4 - пермангататі -ион
CH3COO- ацетаті-ион
ClO3 - перхлорат
-
-

Бірінші топқа қышқылдарда ерімейтін барий сульфатын есепке алмағанда, суда барий тұздарының тұнбасын түзетін қышқылдар анионы кіреді. Сондықтан І ші топ аниондарының тұнбаға түсу реакциясы бейтарап немесе әлсіз сілтілік ортада жүргізіледі. Бұларға: күкірттің, көміртектің, кремнийдің, фосфордың, йодтың, мышьяктың, хромның, бордың оттекті қышқылдары мен органикалық қышқылдар жатады.

Екінші топ аниондарынан айырмашылығы -олардың бәрі(Ғ - тен басқа) азот қышқылында еритін күміс тұзы тұнбасын түзеді. Олардың қорғасын тұздары да суда ерімейді.
ІІІ топқа азот және галогендердің оттекті қышқылдарының аниондары енеді, олардың барий және күміс тұздары суда ерігіш. Бұл аниондардың топтық реактиві жоқ. ІІІ ші топ аниондары түссіз.


Бунзен барлық аниондардың жеті топқа бөлінуін ұсынған.


Аниондардың медицина мен фармацияда қолданылуы.
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz