11-сынып: Химия мен физика интеграциясы - Электролиздің теориясы, тәжірибесі және есептері



Электролиз
Кіріктірілген сабақ
(химия + физика)
11 сынып

А) білімділік: Оқушылардың тотығу дәрежесі және тотығу-тотықсыздану реакция жайындағы білімдерін жүйелеу және қорытындылау. «Электролиз» тақырыбы жайлы білімін эксперимент арқылы және есептер шығара отырып тереңдетіп жетілдіру.
Б) дамытушылық: экспериментті орындауда техникалық машықты қалыптастыру, ерітінді және балқыма электролиздеріне байланысты есепті шығара білу.
В) тәрбиелілік: пәнге деген ынтасын арттыру, өз бетімен жұмыс жасауды үйрету.
Сабақтың мақсаты:

Топтар
Химик-практик
Теоретик
Физик-практик

NaCl Na+ + Cl-
Электролиттік диссоциация

Na Cl
Na+
Cl-
Ас тұзының электролиттік диссоциациясы
NaCl Na+ + Cl-
Диссоциация других веществ:
CuSO4 Cu 2+ + SO42-
HCl H + + Cl-
H2SO4 H+ + H+ + SO42-
CaCl2 Ca 2+ + Cl- + Cl-
Диссоциация кезінде металл және сутек иондары үнемі оң зарядталады, ал қышқыл қалдықтары радикалдары мен ОН тобы - теріс зарядталады
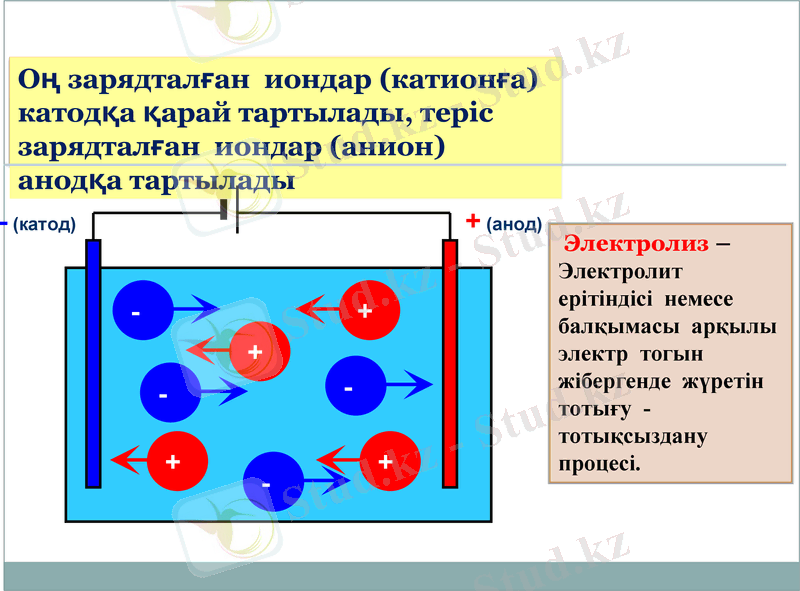
+ (анод)
- (катод)
+
+
+
-
-
-
+
-
Электролиз - Электролит ерітіндісі немесе балқымасы арқылы электр тогын жібергенде жүретін тотығу - тотықсыздану процесі.

Блиц сұрақтар
1. Электролиттік диссоциация дегеніміз не?

Жауабы:
Ерітінділер мен балқымаларда заттардың иондарға ыдырауы. Кері процесс рекомбинациялану деп аталады) . Электролиттер еріген кезде электр тогының әсерінен судың полярлы молекуласының әсерінен электролит молекулаларының иондарға ыдырауы байқалады.

2 сұрақ
Электролизге анықтама беріңіз?

Жауабы:
Электролиз - тотығу - тотықсыздану реакциясының әсерінен электродтарда таза заттардың алыну процесі.

Сұрақ
Электродтарда бөлінетін заттың
массасын анықтауға байланысты
есептер шығардық. Бұл қандай заңдылық ?

Фарадей заңы
Электролиз кезінде электродта бөлінген заттың массасы электролит арқылы өткен зарядтың мәніне тура пропорционал болады.
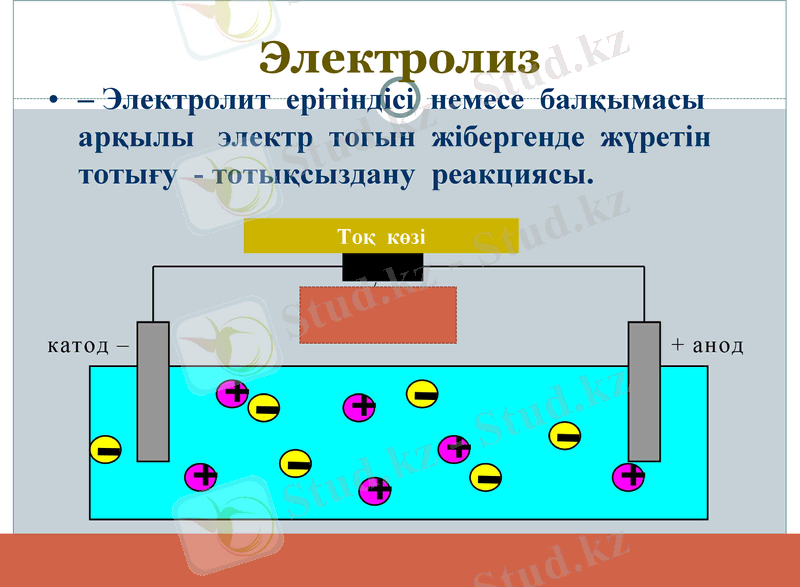
Электролиз
- Электролит ерітіндісі немесе балқымасы арқылы электр тогын жібергенде жүретін тотығу - тотықсыздану реакциясы.
Тоқ көзі

1834 жылы ағылшын ғалымы Майкл Фарадей электролиз зерттеп, оның заңдылықтарын ашты.
Майкл Фарадей (1791 - 1867)
Электролиздің бірінші заңы
Электролиз кезінде электродта бөлінген заттың массасы электролит арқылы өткен зарядтың мәніне тура пропорционал
k - заттың электрохимиялық эквиваленті
(электролит арқылы 1Кл заряд өткен кезде бөлініп шыққан заттың массасына тең
«Электролит», «электрод», «анод», «катод» терминдерін енгізді.

Ғылымға үлесі
1820 ж. - магнетизмді зерттеді. 1821 ж. - электродвигательдің физикалық негізін түсіндірді.
1831 ж. - тәжірибе арқылы электр күштерін, индуктивті электр тоғын зерттеді.
1832 ж. - химиялық және электрохимиялық құбылыстар арасындағы байланысты зерттеді.
1837 ж. - индукция құбылысын ашты. 1845 ж. - тоқтың әсерінен электрленген сұйықтыққа полярланған жарықтың әсерін түсіндірді

Электролиздің екінші заңы
Электр тогының бірдей мөлшерінде (электролит арқылы өткен электр заряды) электролиз кезінде бөлінген заттардың массасы, заттардың молярлы массасының валенттілігі қатынасына пропорционалды болады.
M - бөлінген заттың массасы
k - электрохимиялық эквивалент М - заттың молярлық массасы
z -заттың валенттілігі
Барлық электролиттер үшін бірдей 1 моль затты бөлуге арналған заряд. Ол F Фарадей саны деп аталады.
Электрохимиялық эквивалент пен Фарадей саны қатынаспен байланысты
Практикалық бөлім

Күміс нитратының сулы ерітіндісінің электролизі кезінде анодта 6 г оттек газы бөлінетін болса, катодта бөлінген күмістің массасын есептеңдер.

Зауытта массасы 468 кг натрий хлоридінің ерітіндісін электролизге ұшыратты. Алынған газдар хлорсутектің синтезі үшін қолданылады. Алынған хлорсутек газын 708 л суда ерітті. Алынған ерітіндідегі тұз қышқылының массалық үлесін есептеңдер.

Бейнетаспа
Алюминийдің алынуы


Гальваностегия
Бұйымды коррозиядан қорғап, ұзақ бойы қолдану үшін асыл металдан жасалған қорғаныш (жұқа қабықпен) қабықпен қаптайды. Гальваникалық цехтар көптеген металлургиялық және басқа зауыттарда бар.

Бұйымдарды асыл металдан жасалған қорғаныш қабықпен қаптау



ГАЛЬВАНОПЛАСТИКА
Электрлік әдіспен қалың қабатты (бірнеше миллиметрге дейін) көшірмелер алу.
Гальванопластика әдісімен алынған барельефа, көшірмесі

Медаль мен тиындар жасау үшін қолданылады

Қысқы сарай

Үлкен театр

Типографияға қажетті бұйымдар

Пресс-формы из пластмассы, резины, металла

Пластмасса, резеңке, металдан жасалған пресс-формалар

Алюминийдің алыну жолы
(бейнефильм)

Жаттығу
Сулы ерітінділер электролизында инертті электродтарды қолданған кезде анодта бөлінетін өнім мен электролизге ұшырайтын заттың арасындағы сәйкестікті көрсетіңіз:
Заттың формуласы Анодтағы өнімдер
А) NaCl 1) Cl2
B) NaClO4 2) Cl2, O2
C) NaOH 3) O2
D) NaBr 4) H2, Br2
5) O2, Br2
6) Br2

Жауабы:
Сулы ерітінділер электролизында инертті электродтарды қолданған кезде анодта бөлінетін өнім мен электролизге ұшырайтын заттың арасындағы сәйкестікті көрсетіңіз:
Заттың формуласы Анодтағы өнімдер
А) NaCl 1) Cl2
B) NaClO4 2) Cl2, O2
C) NaOH 3) O2
D) NaBr 4) H2, Br2
5) O2, Br2
6) Br2

Жаттығу :
Сулы ерітінділер электролизында инертті электродтарды қолданған кезде анодта бөлінетін өнім мен электролизге ұшырайтын заттың арасындағы сәйкестікті көрсетіңіз:
Заттың формуласы Анодтағы өнімдер
А) HgSO4 1) F2
B) KF 2) O2
C) HgCl2 3) Hg
D) RbOH 4) H2
5) Cl2
6) H2, O2

Жаттығу :
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz