Химиялық реакция жылдамдығына әсер ететін факторлар және әрекеттесуші массалар заңы



§4. 2. химиялық реакцияның жылдамдығына әр түрлі факторлардың әсері

Сабақ мақсаты:
химиялық реакциялардың жылдамдығы туралы білімді тереңдету және жүйелеу; химиялық реакциялардың жылдамдығына әсер ететін факторларды түсіндру; әрекетесуші массалар заңы тұжырымдау.

Сабақтың барысы:
үйымдастыру (2минут)
үй тапсырмасын тексеру. (5минут)
Жаңа сабақ. (30минут)
Жаңа сабақты бекіту. (5минут)
Үй тапсырмасы. (1минут)
Білімді бағалау. (1минут)
Сабақты қортыу. (1минут)

үй тапсырмасын тексеру:
Гомогенді және гетерогенді реакцияларға бірнеше мысалдар келтіріңдер. Химиялық реакциялардың теңдеулерін жазыңдар.
Гомогенді реакцияның жылдамдығын сипаттайтын математикалық өрнекті жазыңдар.
Гетерогенді реакцияның жылдамдығын сипаттайтын математикалық өрнекті жазыңдар.
Гетрогенді жүйеде әрекеттесу қандай негізгі сатылардан тұрады? химиялық реакцияның жылдамдығын лимиттеуші сатысы деген не?

Жаңа сабақ:

Әрекеттесуші заттар табиғатының әсері
Оттекттің сутекпен әрекетесуі тез өтеді, оттек молекуласындағы байланысын бүзу үшін 494 кДж/моль қажет.
азоттың сутекпен әрекеттесуі өте баяу жүреді. Азот молекуласындағы байланысты бүзу үшін 942 кДж/моль энергия, Беріктеу азот молекуласы реакцияға қиын түседі, мұндай реакцияның жылдамдығы төмендеу болады.

Концентрацияның әсері.

Тәжірибе: аз мөлшерде ас содасы салынған екі сынауыққа жеке- жеке 1моль/л срке қышқылынан 10мл және 0, 1 моль/л срке қышқылынан 10мл құйып, пайда болған құбылысты бақылайық.
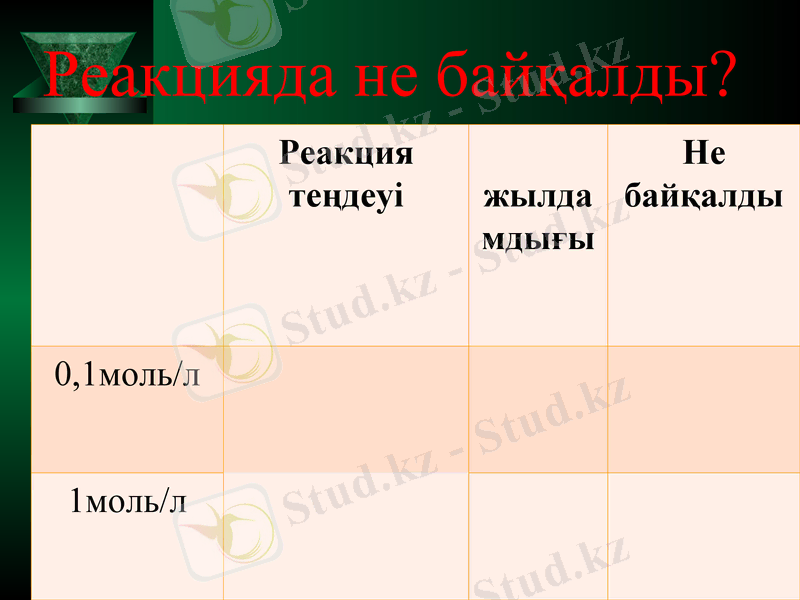
Реакцияда не байқалды?
Реакция теңдеуі
жылдамдығы
Не байқалды
0, 1моль/л
1моль/л

Температура мен қысым тұрақты болған жағдайда заттың концентрациясы артса реакция жылдамдығыда артады
Химиялық реакция барысы - реакцияға қатысақан заттар молекуласындағы атомдардың қайтадан бірігіп түзілген зат молекуласына айналыу барысы.
реакцияласудың алғы шарты- реакцияға қатысқан зат молекуллалар арасындағы соқтығысу .
реакция тудыратын соқтығысу өнімді соқтығысу деп аталады
өнімді соқтығуды тудыратын молекулаларды активті молекулалар деп аталады. Энергиясы мен бағыты болады.

мысалы:

Химялық реакция жылдамдығы әрекеттесуші заттардың концентрацияларының көбейтіндісіне пропорционал.
Жалпы А + В = С + Б тендеуі бойынша жүретін реакциялар үшін бұл заң мынадай теңдеумен өрнектеледі:
мұндағы сА және св - А және В заттарының концентрациясы, моль/л

Химиялық кинетиканың негізгі заңын көбінесе әрекеттесуші массалар заңы деп атайды.
Тек карапайым реакциялар әрекеттесуі массалар заңына бағынады.
Реакцияға қатысқан заттың концентрациясы артса, бірлік көлемдегі молекула саны көбейеді, активті молекула саныда сайкес артады.
Гетерогенді реакциялардың кинетикалық теңдеуіне қатты күйде болатын әрекеттесуші заттардың концентрациясы кірмейді, өйткені олардың концентрациясы түрақты.

Температураның әсері

Тәжірибе: Мырыш тұйіршігін фосфор қышқылмен әрекеттескенде қандай құбылыс пайда болады? егер температураны артырсақ реакция жылдамдығы қалай өзгереді?

Реакция теңдеуі
Реакция жылдамдығы
Байқалған құбылыс
Қалыпты
температурада
Температураны жоғарлатқанда

Температура реакция жылдамдығына қалай әсері етеді?

Жаңа сабақты бекіту:

суретте көрсетілген бірнеше соқтығысыу болыуы мүмкін, суретте молекуланың соқтығысуын түсіндіріп беріңдер. НI молекуласының ыдырау реакциясы 2HI = H2 +I2

2. Әрекеттесуші массалар заңы қандай реакциялар үшін орындалады.
3. А + В = С + Б тендеуі бойынша жүретін реакциялар үшін А заттың концентрациясын артырсақ реакция жылдамдығы қалай өзгереді?
4. SO2 + O2 =SO3 егер SO2 ның концентрациясы 2минутта 6 моль/л ден 2 моль/л ге өзгерген химиялық реакция жылдамдығын анықта?

Үйге тапсырма:
§ 4. 2. №1, 2, 3, 4 сұрақтар мен №5есеп


Сабақты қортындылау.
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz