Күкірт және оның қосылыстары: орта мектеп химия сабағының жоспары



Батыс Қазақстан облысы Зеленов ауданы Махамбет ауылы Махамбет ЖОББМ Химия пәнінің мұғалімі Лекерова Эльмира Қайратқызы

Күкірт және оның қосылыстары

Сабақтың мақсаты:
1. Оқушыларды күкірт және оның қосылыстарымен, химиялық қасиеттерімен таныстыру
2. Жоспарды пайдалана отырып, өз бетінше жауап беру біліктілігін қалыптастыру, негізгі ойды бөліп қорытындылап, салыстыра білуге үйрету
3. Уақытты бағалауға, өз бетінше жұмыс істеп, қорытындылай білуге үйрету

Сабақ жоспары:
І. Ұйымдастыру
ІІ. Үй тапсырмасын пысықтау. (тест)
ІІІ. Сабақтың мақсатымен таныстыру
ІV. Топқа бөлу
Слайдпен жұмысты қорғау
VІ. Өздік жұмыс
VІІ. Қорытындылау
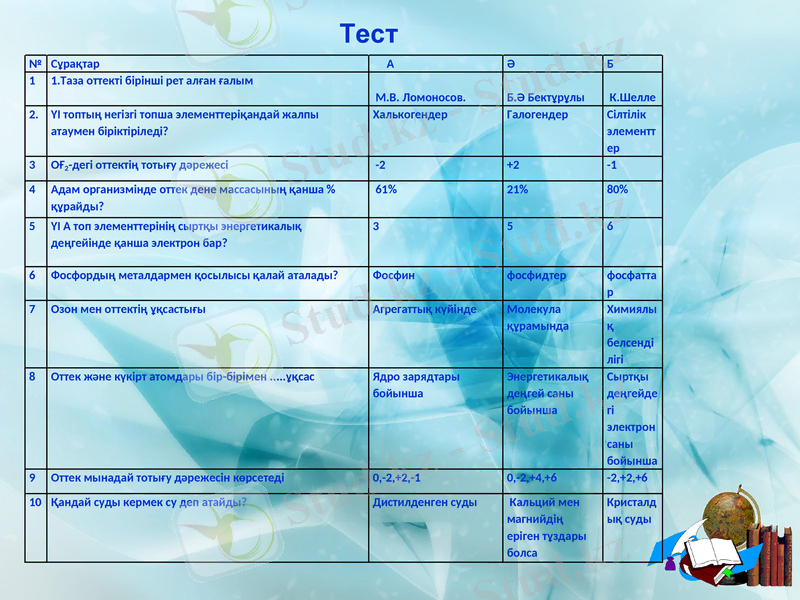
№
Сұрақтар
А
Ә
Б
1
1. Таза оттекті бірінші рет алған ғалым
М. В. Ломоносов.
Б. Ә Бектұрұлы
К. Шелле
2.
ҮІ топтың негізгі топша элементтеріқандай жалпы атаумен біріктіріледі?
Халькогендер
Галогендер
Сілтілік элементтер
3
ОҒ2-дегі оттектің тотығу дәрежесі
-2
+2
-1
4
Адам организмінде оттек дене массасының қанша % құрайды?
61%
21%
80%
5
ҮІ А топ элементтерінің сыртқы энергетикалық деңгейінде қанша электрон бар?
3
5
6
6
Фосфордың металдармен қосылысы қалай аталады?
Фосфин
фосфидтер
фосфаттар
7
Озон мен оттектің ұқсастығы
Агрегаттық күйінде
Молекула құрамында
Химиялық белсенділігі
8
Оттек және күкірт атомдары бір-бірімен . . . ұқсас
Ядро зарядтары бойынша
Энергетикалық деңгей саны бойынша
Сыртқы деңгейдегі электрон саны бойынша
9
Оттек мынадай тотығу дәрежесін көрсетеді
0, -2, +2, -1
0, -2, +4, +6
-2, +2, +6
10
Қандай суды кермек су деп атайды?
Дистилденген суды
Кальций мен магнийдің еріген тұздары болса
Кристалдық суды
Тест

Осы затпен ескі үйді аластайды, түсіне қарасаң алтынға ұқсайды
бұл не деп ойлайсыңдар, балалар?
Иә, бұл күкірт.
Ендеше бүгінгі сабағымызда «Күкірт және оның қосылыстары»
туралы әңгімелейтін боламыз.
Сыныпты 4 топқа бөлу.
«Күкірт және оның қосылыстары» тақырыбы бойынша оқушылардың
слайд бойынша жұмыстарын қорғауы.
І топ «Күкірт»
ІІ топ «Күкіртсутек»
ІІІ топ «Күкірттің (ІV, VІ ) оксидтері
ІҮ топ « Күкірт қышқылы»

Күкірт және оның қосылыстары
Күкіртсутек
Күкірт қышқылы
Күкірт
Күкірт оксиді

Күкіртсутек
Н2S

Табиғатта таралуы және физикалық қасиеттері
Күкіртсутек -шіріген жұмыртқа йісті, түссіз газ.
-60°с-та сұйық күйге ауысады. ал -86° с-та қатады.
Күкіртсутек табиғатта жанартау атқылағандағы газдардың құрамында, емдік қасиеті бар минерал суларда кездеседі(Алма-Арасан т. б)
Күкіртсутек өте улы, оның өте аз мөлшерімен тыныс алғанда адам есінен танып, тіпті өліп те кетуі мүмкін.
Күкіртсутек тыныс алғанда гемоглобинмен байланысып, сал ауруын туғызады.
Күкіртсутекпен уланған адамды тез арада таза ауаға шығару керек.

Химиялық қасиеттері
Күкіртсутеке тотықсыздандырғыш қасиет тән.
2Н2S +O2→2S+2H2O S- тот-с-ш, O2- т-т-ш
Металдармен әрекеттесіп сутек бөледі, активтік қатарында сутекке дейін тұрған металдармен:
Н2S+Mg → Mg S+ Н2↑
Галогендермен әрекеттескенде сәйкес галогенсутек қышқылдарын түзеді: Br2 + Н2S →2HBr+S
Күкіртсутек екі негізді қышқыл болғандықтан, орта(сульфидтер) және қышқыл тұздар(гидросульфаттар) түзеді. Н2S+КОН →КНS+H2O

Алынуы:
Зертханада:
Н2S Кипп аппаратында алынады:
ҒеS+ 2HCI → Н2S↑ + ҒеCI2

Қолданылуы:
Күкіртсутек емдік қасиеті бар, буын ауруларын емдеуде күкіртті сутек ванналарында қолданылады
Күкірттісутектің тұздарымен түсі әр түрлі тұнба түзуі аналитикалық химияда ерітіндіден сәйкес металл катиондарын бөлуде және анықтауда қолданылады

SO2
SO3

Физикалық қасиеттері
Күкірт екі түрлі оксид түзеді:S(ІҮ) оксиді-SO2(күкіртті газ немесе күкірттің диоксиді), бұл-өткір тұншықтырғыш иісі бар, түссіз газ
S(ҮІ) оксиді-күкірт ангидриді- SO3, ұшқыш, түссіз сұйықтық; олар суда жақсы ериді, нәтижесінде күкіртті қышқыл Н2SO3 және күкірт қышқылы Н2SO4 түзіледі, олай болса бұлар қышқылдық оксидтер

Алынуы
Зертханада: Күкіртті ауада жағу арқылы 2S+O2→ SO2
Өндірісте: 2ZnS+3O2 → 2ZnO+ 2SO2
2SO2+O2 → 2SO3

Химиялық қасиеттері
Негіздік оксидпен әрекеттесіп тұз түзеді:
SO2+Na2O→Na2SO3
Негізбен әрекеттескенде тұз және су түзе жүреді
SO2+2 NaOH →Na2SO3+H2O

Қолданылуы
SO2-қантты, маталарды, сабынды ағарту үшін, қоймаларды аластау үшін қолданылады.

КҮКІРТ ҚЫШҚЫЛЫ
Н2SO4

Физикалық қасиеттері
Күкірт қышқылы-түссіз, ұшқыштығы төмен, тығыздығы 1, 84г\мл майлы сұйықтық
Кейде оны “купорос майы” деп атайды.
Ылғал тартқыш
Күкірт қышқылы суда жақсы ериді. Еру кезінде көп мөлшерде жылу бөлінеді
Ауадан және басқа газдардан су буын жақсы тартады

Химиялық қасиеттері
Күкірт қышқылы күшті және белгілі минералды қышқылдар ішіндегі тұрақтысы
Сұйылтылған күкірт қышқылына күшті қышқылдың барлық қасиеттері тән. Олар негіздік оксидтермен, негіздермен және тұздармен әрекеттеседі.
Кернеу қатарындағы сутектің оң жағындағы металдар сұйылтылған күкірт қышқылында ерімейді.

Сульфат иондарына сапалық реакция
Күкірт қышқылына және оның тұздарына барий тұздарының ерітіндісі реактив болып табылады. Ва2 катионы SО4 анионымен іс жүзінде ерімейтін ақ тұнба түзеді:
Ba2 + SO4 = BaSO4

Қолданылуы
Күкірт қышқылымен тікелей немесе жанама байланыспаған химиялық өндіріс салаларын айту қиын. Күкірт қышқылы жан-жақты қолданылуы бойынша бірінші орында тұр. Оны химия өнеркәсібінің “наны” деп санайды, себебі басқа қышқылдарды алуда, мұнай өнімдерін тазалауда, қант өндірісінде, өсімдік майын тазалауда, газдарды құрғатуда, сода, бояу, жасанды талшық өндірісінде, органикалық синтез және т. б. қолданылады
Негізгі химиялық өнеркәсіпте күкірт қышқылы тыңайтқыштар алуда қолданылады

Сульфаттар
Күкірт қышқылының тұздарын сульфаттар деп атайды. Күкірт қышқылы екінегізді болғандықтан, ол тұздарды екі қатарына түзеді: орта-сульфаттар және қышқыл-гидросульфаттар
Күкірт қышқылының тұздары да өте көп қолданылады. Күкірт қышқылы тұздарының ішіндегі тұздарына маңыздыларына мыналар жатады:
Кальций сульфатыCASO4 кристалгидрат түрінде кездеседі:гипс, алебастр. Гипсті кыздырганда ол алебастрга айналады. Алебастрды медицинада сынақтың сыртынан орап таңуда және тіс протезін дайындауда қоолданады

Күкірт
S

Периодтық жүйедегі орны және атом құрылысы

Физикалық қасиеттері
Күкірт -сары түсті, қатты кристалды зат
Оның үш аллотропиялық түр өзгерісі болады: ромбтық, моноклинді, пластикалық
Қалыпты жағдайда күкірт молекуласы сақина түріндетұйықталған сегіз атомнан тұрады
Суда күкірт ерімейді, спирт пен эфирде нашар ериді; бензолда, күкіртті көміртекте және т. б. жақсы ериді

Химиялық қасиеттері
Күкірт химиялық реакцияларда тотықтырғыш та, тотықсыздандырғыш та бола алады
күкірттің жай заттармен әрекеттесуі
күкірт жоғары температурада сутекпен әрекеттеседі
Жоғары температурада күкірт фтормен және оттекпен әрекеттеседі(жанады)

Табиғатта таралуы
Күкірттің табиғи қосылыстары
Балқаш, Шығыс Қазақстан облысында сульфидтер( ZnS, PbS, FeS, т. б) күйінде болса, сульфаттары
(СаSO4. 2 H2 O, Na2 SO4 . 10H2 O, MgSO4 . 7H2 O) т. б болады
Күкірт қосылыстары мұнайда және тас көмірде де кездеседі
Бос күйіндегі күкіртті тау жыныстарынан балқыту арқылы алады

ҮІ. Өздік жұмыс.
І топ
1. Күкірттің химиялық таңбасы
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz