Хлор: ашылу тарихы, периодтық жүйедегі орны, химиялық қасиеттері және қолданылуы



Хлор

1. Хлордың ашылу тарихы
2. Периодтық жүйедегі орналасуы
3. Химиялық қасиеттері
4. Қолданылуы
5. Білімін тексеру
ХЛОР
6 Қорытындылау

Хлордың ашылу тарихы
Хлор

1774 жылы Швед ғалымы К. Шееле хлорды алғаш рет алды. Ол бұл затты күрделі затқа санап, «флогистиндірілмеген» тұз қышқылы деп атады.
1807 жылы ағылшын химигі Гемфри Дэви дәл осы газды алды. Ол бұл элементті «хлорин» деп атады. Мағынасы «хлорос» - сары-жасыл деген мағынаны білдіреді.
1812 жылы Гей-Люссак газға хлор деген атау берді.
Хлордың ашылу тарихы
Карл Вильгельм Шееле
(1742 - 1786)
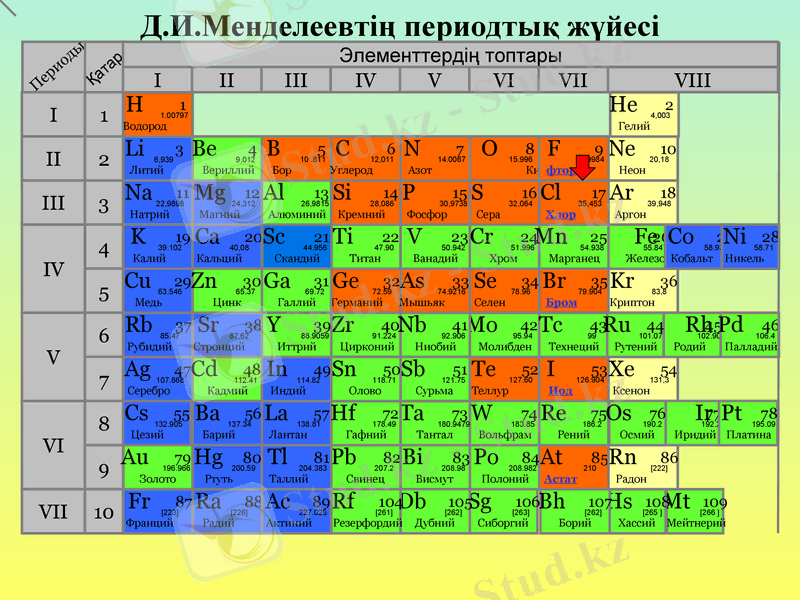
Д. И. Менделеевтің периодтық жүйесі
Элементтердің топтары
I
III
II
VIII
IV
V
VI
VII
II
I
III
VII
VI
V
IV
2
1
3
4
5
6
7
10
F
фтор
9
18. 9984
Br
Бром
35
79. 904
I
Иод
53
126. 904
Cl
Хлор
17
35, 453
At
Астат
85
210
9
8

Хлордың сипаттамасы
Элементтер топтары
I
III
II
VIII
IV
V
VI
VII
II
I
III
VII
VI
V
IV
2
1
3
4
5
6
7
9
8
Cl
35
17
0
10
Хлор / Chlorum (Cl)
Заттың сыртқы сипаты
Өткір иісті сары-жасыл түсті газ. улы
Электрондық конфигурациясы
[Сl] 3s2 3p5
Электртерістігі
(Полинг бойынша)
3. 16
Тотығу дәрежесі
7, 6, 5, 4, 3, 1, −1
Тығыздығы
(−33. 6 °C-та)
1, 56 г/см ³
Балқу температурасы
172. 2 К
Қайнау температурасы
238. 6 К

Химиялық қасиеттері Cl2 - реакцияға белсенді түрде қатысады (C, O2, N2 және т. б басқа)
Металдармен: Na + Cl2 =
Fe + Cl 2 =
Сутекпен: H2 +Cl2 =
Cумен: H2O + Cl2 =
Сілтімен: NaOH + Cl2 =
Тексеру
Темірдің хлорда жануы
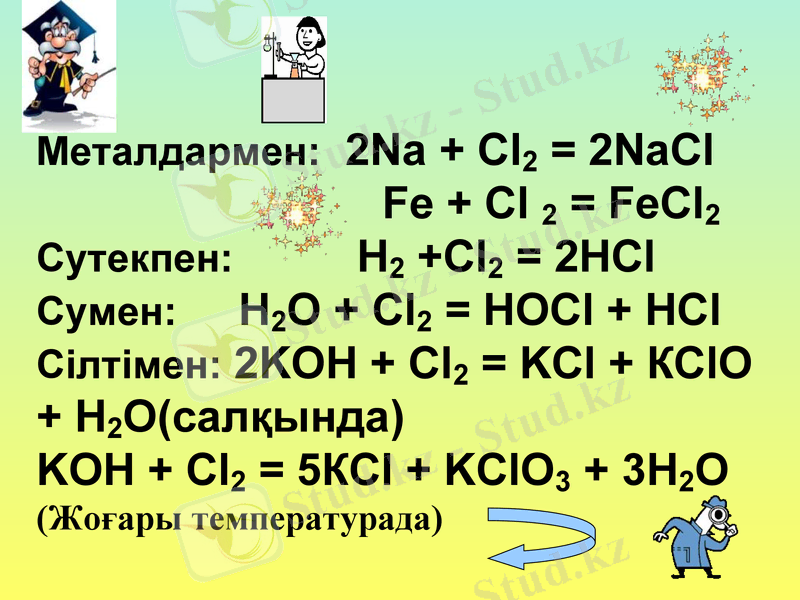
Металдармен: 2Na + Cl2 = 2NaCl
Fe + Cl 2 = FeCl2
Сутекпен: H2 +Cl2 = 2HCl
Cумен: H2O + Cl2 = HOCl + HCl
Сілтімен: 2KOH + Cl2 = KCl + КClO + H2O(салқында)
KOH + Cl2 = 5КCl + KClO3 + 3H2O
(Жоғары температурада)

Сl
Ол сілекейде, қарын сөлінде,
өтте және лимфада болады.
Биологиялық
маңызы
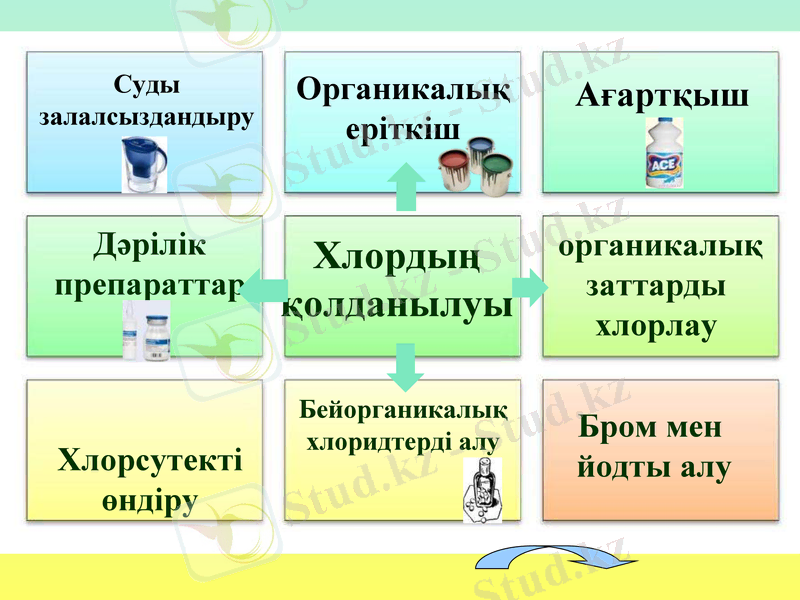
Хлордың
қолданылуы
Ағартқыш
Хлорсутекті
өндіру
Бром мен
йодты алу
Суды залалсыздандыру
Органикалық еріткіш
Дәрілік
препараттар
органикалық заттарды хлорлау
Бейорганикалық
хлоридтерді алу

Айыпталушы сіздерге қандай әсер қалдырды?
Ол есте қалатындай қандай қырынан көріне білді?
Ол жазалансын дегендеріңіз қолдарыңызды көтеріңіздер.
Сіз не үшін хлорды жазалауды жақтайсыз?
Хлорды жазадан босату үшін келтірілген фактілерді атаңыздар.
Осы залда болып жатқан жағдайларға қандай баға берсіздер?
(Cұрақ сабаққа қатысып отырған қонақтарға қойылады. )
7. Кімде сотталушыға деген аяныш сезімі бар? Сіз оны неге жақтайсыз?
8. Сіз осы сот процесіне қатысып отырған- соттың, прокурордың,
куәлардың және қорғаушылрдың іс-қимылына қандай баға бересіз?
Олар өз рольдерін қалай орындап шықты?
9. Сіздер келешекте де осындай іске қатысқыларыңыз келе ме?
Тілшілер
сұрақтары

Сот куәлардың, айыпталушының,
сараптаушылар мен қорғаушыларды тыңдап,
сараптап мынадай қорытындыға келді:
Хлордың арқасында бірнеше түрлі практикалық маңызы зор химиялық заттар алынады.
Хлор суды залалсыздандырып, адамдарды түрлі инфекциялардан сақтап, денсаулықтарын қорғайды.
Сот хлорды жазықсыз деп табуды қажет санайды. Өйткені ол табиғатта бос күйінде кездеспейді.
Сот адамдарды өлтіретін заттар шығарып, технологияны бұзып, қоршаған ортаны ластап, оған жете мән бермегені үшін адамзатты айыптайды.

Бүгінгі сабақта мен . . . үйрендім.
Бүгінгі сабақта мен . . . білдім.
Бүгінгі сабақтан кейін мен қоршаған ортаға . . .
Рефлексия
сөйлемді толықтыру
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz