Көміртектің қосылыстары және аллотропиясы: қасиеттері мен қолданылуы



Қазақстанда 2011 химия жылы
50 жыл


20 жыл тәуелсіздік ырысымыз
Болашаққа бастайды әр ісіміз
Егемен елімізді көркейтетін
Білім шыңына шығу парызымыз

С
Сабақтың жүрісі
Көміртек
1
2
Үй тапсыр-
масын
сұрау
Жаңа
сабақ
3
4
5
Сабақты
бекіту
Үйге
тапсырма
Бағалау

С
Көміртек
Үй тапсырмасын сұрау:
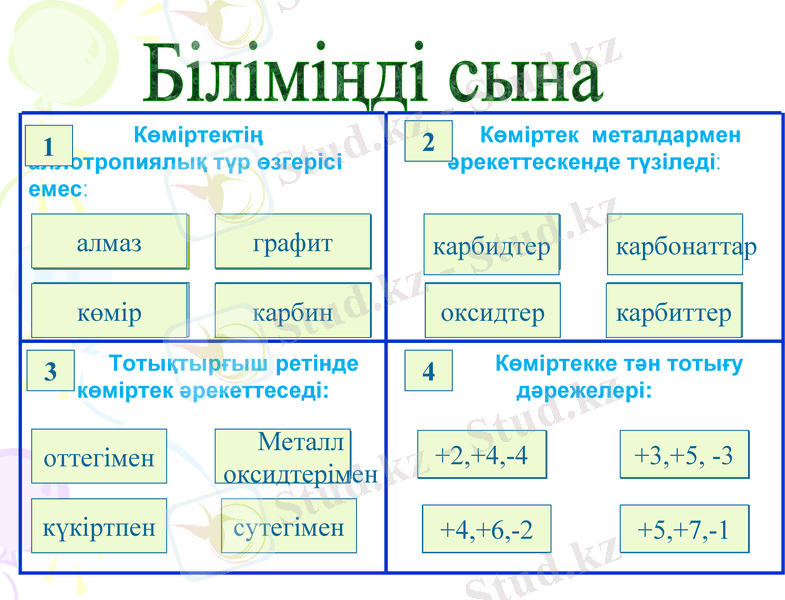
Көміртектің аллотропиялық түр өзгерісі емес:
Көміртек металдармен әрекеттескенде түзіледі:
Тотықтырғыш ретінде көміртек әрекеттеседі:
Көміртекке тән тотығу дәрежелері:
1
қате
дұрыс
қате
қате
алмаз
графит
карбин
көмір
2
дұрыс
қате
қате
қате
карбидтер
карбонаттар
карбиттер
оксидтер
3
қате
қате
қате
дұрыс
сутегімен
оттегімен
Металл
оксидтерімен
күкіртпен
4
дұрыс
қате
қате
қате
+2, +4, -4
+3, +5, -3
+4, +6, -2
+5, +7, -1
Біліміңді сына

Периодтық жүйедегі орны
12С
С
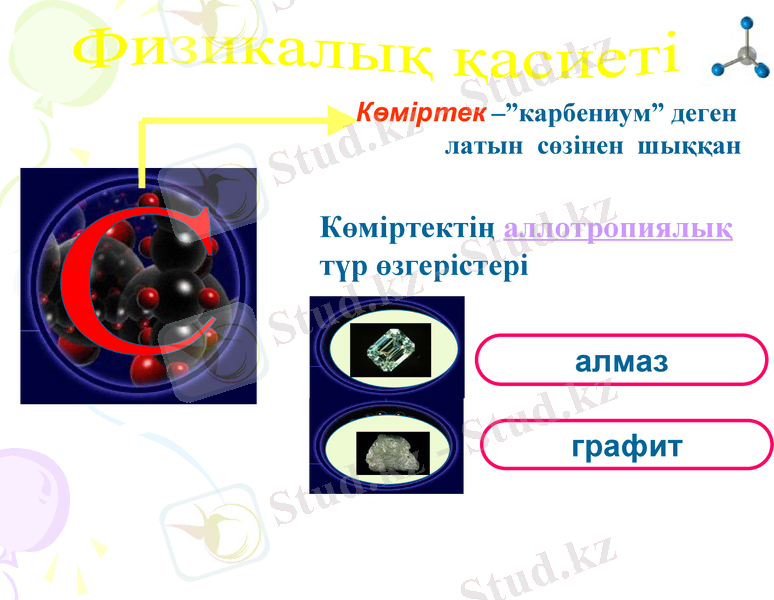
Көміртек -”карбениум” деген
латын сөзінен шыққан
Физикалық қасиеті
Көміртектің аллотропиялық
түр өзгерістері
алмаз
графит

Аллотропия - (грекше allos - өзге және
troops - бұрылыс, қасиет ) химиялық
Элементтердің бірнеше жай заттар
түрінде болуы.
Қазақша тұрпаттастық деп аталады.

Алмаздың түссіз, мөлдіреген түрін - бриллиант деп аталынады.
Ол ең әдемі бағалы тастар, әшекейлі заттар әзірленеді.
А л м а з

Графит - карандаш өзегін және электрод өндіруде қолданылады.
Г р а ф и т

К ө м і р
Көмірдің түрлері
көміртектің 90%
тас көмірді құрайды
көмртектің 70%
өндірістегі көмірді құрайды
көмртектің 92 -95%
ерте кездегі көмірді құрайды
көмртектің 80%
ағаш көмірді құрайды

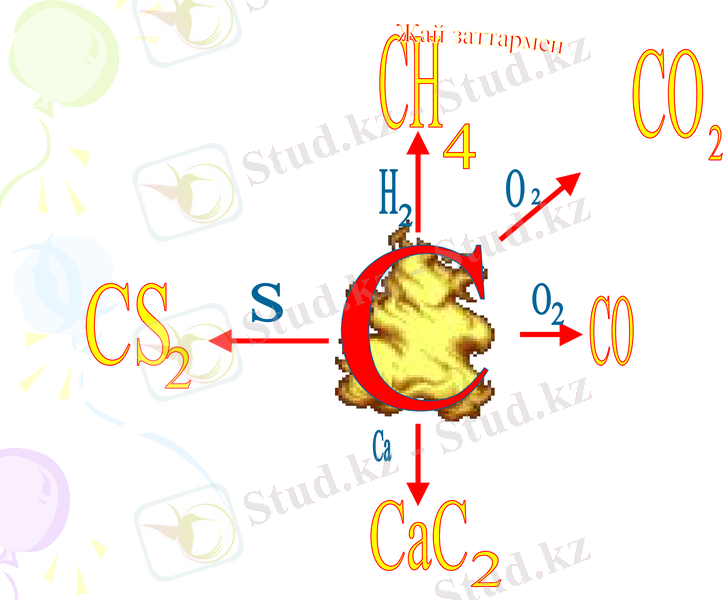
Химиялық қасиеті
Жай заттармен
Күрделі заттармен
С
С
С
СН
4
Н
2
СO
СO
2
O
2
O
2
СaC
2
CS
2
S
Ca
Жай заттармен

Көмірді жағу
Жану реакциясы 2C+O2 =2CO С+О2 = CO2

С
ЖАҢА САБАҚ
Көміртектің қосылыстары

Білімділік: Көміртек қосылыстарының табиғатта таралуын, алынуын, физикалық қасиеттерін, химиялық қасиеттерін, қосылыстарын және қолданылуын өткен сабақпен байланыстыра отырып түсіндіру.
Дамытушылық: Оқушыларды өз бетімен жұмыс істеуге, өзін-өзі тексеруге, химиялық теңдеулерді ұқыпты жазып, теңестіре білуге баулу.
Тәрбиелік: Тұрмыстық химияда кездесетін заттармен ұқыпты жұмыс жасауға, сабырлы болуға тәрбиелеу.
Сабақтың мақсаты:

Көміртектің қосылыстары: Көміртек (ІІ) оксиді Көмірқышқыл газы Көмір қышқылы Карбонаттар

СО - түссіз, иіссіз, улы газ. Суда нашар ериді, басқа заттармен реакцияға түспейді. Оны иіс газы деп те атайды. Отын шала жанғандағы иіс газымен адам дем алса, уланады. Өйткені иіс газы организмде гемоглобиннің оттекті тасымалдауына мүмкіндік бермейді. Мұндай жағдайда адамды тез таза ауаға шығару керек, сонда гемоглобин өз қалпына келеді. Ал иіс газы көмірқышқыл газына айналып тотығады да тыныс алғанда өкпеден шығады.

-көмірқышқыл газы.
Химиялық қасиеттері

Зертханада алынуы

Көмір қышқылы
Н2СО3
Н2 СО3 <=>Н ++НС О3- гидрокарбонат ионы
НСО 3 - <=> Н ++СО3 2- карбонат ионы
ά =0, 17 %

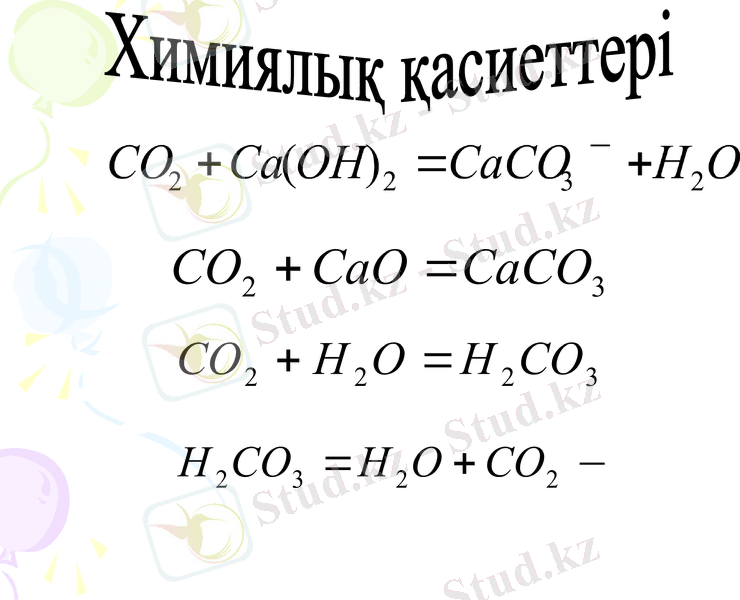
химиялық қасиеттері
Сілтілермен әрекеттесіп екі қатар тұздар түзеді:
Н 2СО 3 + 2NаОН=Nа 2 СО 3 +2Н 2О
натрий карбонаты
Н 2СО3 + NаОН=Nа НСО 3+Н 2О
натрий гидрокарбонаты
Nа НСО 3+ NаОН=Nа2 СО3 +Н 2О

Көмір қышқылының тұздары
Қыздырғанда ыдырайды:
СаСО 3 =СаО+СО 2↑
2NаНСО3 =Nа 2СО3 +СО 2 ↑+Н 2О
Гидролизге ұшырайды:
Nа2 СО 3+НОН=NаОН+NаНСО 3
Сапалық реакциясы:
Nа 2СО 3+2НСl=2NaCl+СО 2 ↑+Н 2О
СО 2↑+Са(ОН) 2 = Са СО 3 ↓+Н 2О
ақ тұнба
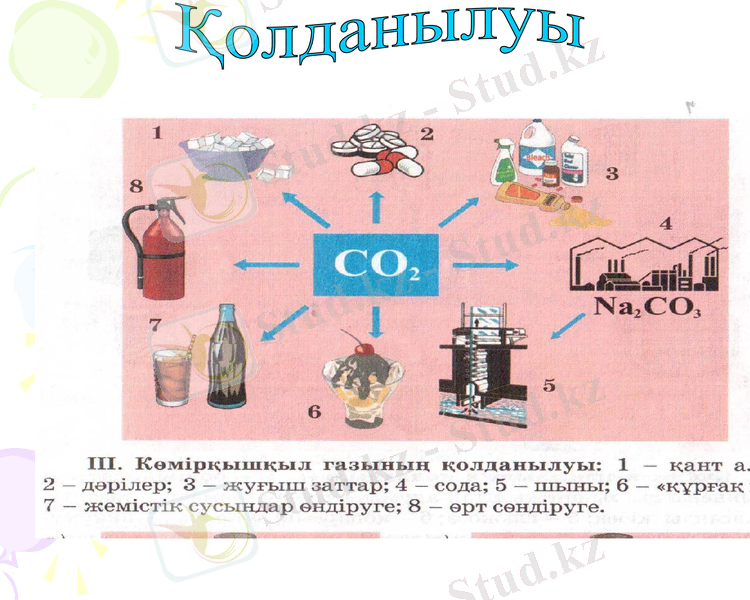
Қолданылуы

Есіңде сақта! Иіс газының қауіпті шамасы-2%, ол қанның гемоглобинімен мықтап байланысып алғанда өлім қаупі туады. Аздап уланудың белгілері:қан ашық қызыл түсті болады, бас қатты ауырып, кейде естен танып қалуға да жеткізеді. Иіс газымен уланған адамды дереу таза ауаға шығару керек.

Табиғаттағы айналымы

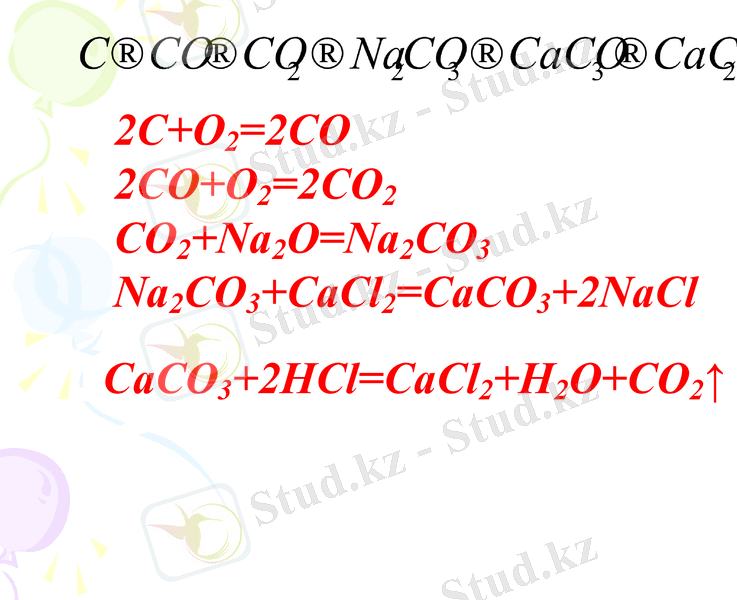
2С+О2=2СО
2СО+О2=2СО2
СО2+Na2O=Na2CO3
Na2CO3+CaCl2=CaCO3+2NaCl
CaCO3+2HCl=CaCl2+H2O+CO2↑

Бекіту
Тренинг ойындары
№1. “Жоғалған формулалар”
№2 “Сәйкесін тап”
№3 “Жұмбақ сөз”

Кім шапшаң? (Сәйкестендіру тесті )
Реттік санмен көміртектің, көміртек (ІІ) және (ІV) оксидтерінің химиялық қасиеттерінің жартылай теңдеулері берілген. Әріппен реакция нәтижесінде түзілетін заттарды жұптап, сәйкестендіріңіздер.
1. С+О2 → …. . +402 кДж а) СН4
2. 2С+ О2 → . . . ә) СО2
3. C+Cu O → …… б) СаС2
4. С+2 Н2→ в) 2СО
5. 2С+Са → г) Al4C3
6. 3С+4Аl ғ) СО+Сu
7. 2CО + О2 →……+577 кДж д) Сu+ CO2
8. СО+Cu O →……+ ж) H2CO3
9. CО2 + Н2 CO →…. . +……. з) 2СО2
10. СО2 +2Na OH →……+…… и) Na2CO3 +H2
11. CO+Ca O →…… к) CaCO3+H
12. CO2+Ca(OH) 2 →……. л) СaCO3
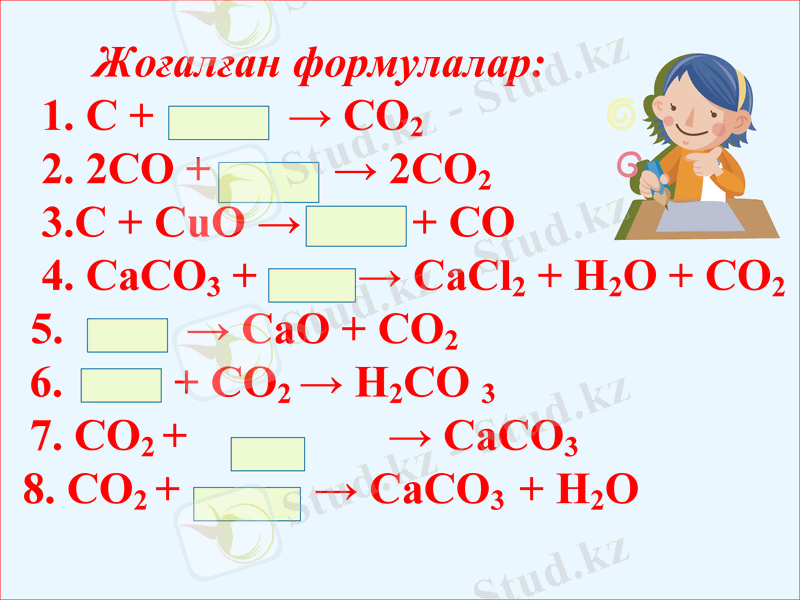
Жоғалған формулалар: 1. С + → СО2 2. 2СО + → 2СО2 3. С + СuО → + СО 4. СаСО3 + → СаСl2 + Н2О + СО2 5. → СаО + СО2 6. + СО2 → Н2СО 3 7. СО2 + → СаСО3 8. СО2 + → СаСО3 + Н2О

1. О2
2. О2
3. Cu
4. HCl
5. CaCO3
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz