Тотығу дәрежесі және тотығу-тотықсыздану реакцияларын электрондық баланс әдісімен теңестіру




Сабақтың тақырыбы: § 64 Тотығу дәрежесі. Тотығу-тотықсыздану реакциялары.
Сабақтың мақсаты:
а) білімділік. «Тотығу дәрежесі» ұғымын бекіту, тотығу -тотықсыздану ұғымдарын түсіндіру, тотығу-тотықсыздану реакциясын электрон- баланс әдісімен теңестіру дағдысын қалыптастыру.
ә) дамытушылық: Оқушылардың ойлау қабілетін дамыту, бақылап, анализ жасау, салыстыру, себеп-салдарлы байланыстарды табу, қорытынды жасау, алгоритммен жұмыс жасау дағдасын дамыту, пәнге қызығушылығын қалыптастыру.
б) тәрбиелік. Оқушылардың ғылыми дүниетанымын қалыптастыру, еңбек ету дағдысын жетілдіру, оларды логикалық ойлауға, ізденімпаздыққа тәрбиелеу.
Сабақтың типі: Дәстүрлі сабақ. Жаңа сабақты топтастыру.
Сабақтың түрі: Панорамалық сабақ.
Сабақты ұйымдастыру формалары: Жеке, топтық, жалпылама.
Сабақты өту әдісі: СТО әдісі.
Сабақтың көрнекілігі: Интерактивті тақта, слайдтар, тірек-хабарлар, қосымша материалдар.
Пәнаралық байланыс: Физика, математика.

Сабақтың жоспары: І. Ұйымдастыру кезеңі.
ІІ. Үй тапсырмасын сұрау.
а) «ой толғау»
б) «кім жылдам»
в) «кім алғыр»
г) қатесін тап
ІІІ. Жаңа сабақты түсіндіру.
а) кіріспе (презентация)
б) мәтінмен жұмыс
ІV. Бекіту.
а) “Кім тапқыр!”
б) Ойлан тап!
в) №5 жаттығу.
V. Оқушыларды бағалау.
VІ. Үйге тапсырма беру.

«Ой толғау»:
1. Электртерістілік деген не?
2. Тотығу дәрежесі деген не ?
3. Тотығу дәрежесін қалай анықтайды.
Оның сандық мәні неге байланысты ?
4. Полюсті және ионды байланыстардағы
металдар қандай тотығу дәрежесін
көрсетеді?
5. Күрделі қосылыстағы элементтердің
белгісіз тотығу дәрежесін қалай есептеп
шығарады ?
ІІ. Үй тапсырмасын сұрау.

«Кім жылдам?»
1. Тотығу дәрежесі +4 ке тең
а) CO2 ә) K2O б) HF в) H2O
2. Қай қосылыста элементтің тотығу дәрежесі нольге тең ?
а) FeS ә) F2 б) CaF2 в) Ca3(PO4) 2
3. Қосылыстардағы хлордың +7 тотығу дәрежесін анықта
а) KClO3 ә) HClO4 б) HCl в) Cl2
4. Қосылыстағы металл атомдарының тотығу дәрежесі
а) үнемі оң б) бірде оң, бірде теріс
ә) үнемі теріс в) нольге тең
5. Күкірттің төменгі тотығу дәрежесі неге тең?
а) -6 ә) -4 б) -2 в) 0

Жауаптары: 1. а, 2. ә, 3ә, 4. а, 5. б.

«Кім алғыр»
№1 Мына қосылыстарды қай элементтің тотығу дәрежесі нольге тең және басқалары қандай тотығу дәрежесін көрсетеді ?
H2S, N2, HJ, H2, NaF, Cl2, CaF2
№2 K2Cr2O7 қосылысындағы хромның тотығу дәрежесін есептеп шығар.

Қатесін тап
а) ?-3 H3+1
ә) Ca3+2 P?-3
б) Ca? F2-1
в) N2?
г) Na+1 F?

Сабақтың тақырыбы: § 64 Тотығу дәрежесі. Тотығу-тотықсыздану реакциялары.
ІІІ. Жаңа сабақты түсіндіру
1. Валенттілік электрондары электртерістілігі кіші атомдардан электр терістілігі үлкен атомдарға ауысатын немесе ығысатын процестер тотығу-тотықсыздану реакциялары деп аталады.

тотықсыздандырғыш
(тотығады)
тотықтырғыш
(тотықсызданады)
4ē
2ē
тотықсыздандырғыш
(тотығады)
тотықтырғыш
(тотықсызданады)
2ē
тотықсыздандырғыш
(тотығады)
тотықтырғыш
(тотықсызданады)

Электрондар беру процесі - тотығу, ал қосып алу процесі тотықсыздану деп аталады.
Электрондарды қосып алатын атомдар немесе иондар тотықтырғыш, ал беретіндері тотықсыздандырғыш болады.

ТТР екі реакциядан (жарты реакциялар) : тотығу және тотықсыздану үрдістерінен тұрады.
Тотығу - атом немесе ионның электрон беруі, мысалы:
Na0-ē=Na+
I-ē=I0
N-3-5 ē=N+2
Тотықсыздану - атом немесе ионның электрон қосып алуы, мысалы:
Cr+6+3ē=r+3,
S0+2ē=S-2,
Mn+7+5 ē=Mn+2,
Тотықтырғыш - электрон алушы атом немесе ион, ал тотықсыздандырғыш - электрон беруші атом немесе ион.
Тотықтырғыш
Тотықсыздандырғыш
+nē
- nē
тотығу дәрежесі төмендейді
тотығу дәрежесі артады
тотықсызданады
тотығады
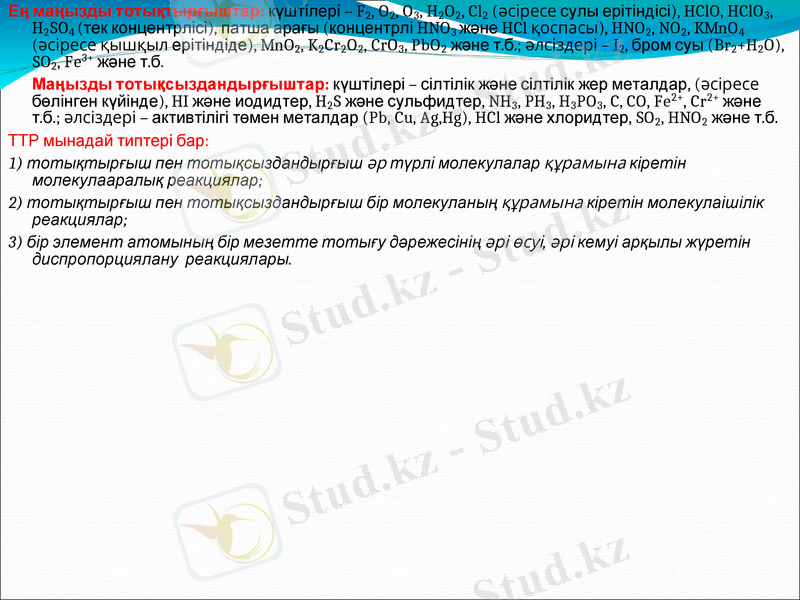
Ең маңызды тотықтырғыштар: күштілері - F2, O2, O3, H2O2, Cl2 (әсіресе сулы ерітіндісі), HClO, HClO3, H2SO4 (тек концентрлісі), патша арағы (концентрлі HNO3 және HCl қоспасы), HNO2, NO2, KMnO4 (әсіресе қышқыл ерітіндіде), MnO2, K2Cr2O2, CrO3, PbO2 және т. б. ; әлсіздері - I2, бром суы (Br2+H2O), SO2, Fe3+ және т. б.
Маңызды тотықсыздандырғыштар: күштілері - сілтілік және сілтілік жер металдар, (әсіресе бөлінген күйінде), HI және иодидтер, H2S және сульфидтер, NH3, PH3, H3PO3, C, CO, Fe2+, Cr2+ және т. б. ; әлсіздері - активтілігі төмен металдар (Pb, Cu, Ag, Hg), HCl және хлоридтер, SO2, HNO2 және т. б.
ТТР мынадай типтері бар:
1) тотықтырғыш пен тотықсыздандырғыш әр түрлі молекулалар құрамына кіретін молекулааралық реакциялар;
2) тотықтырғыш пен тотықсыздандырғыш бір молекуланың құрамына кіретін молекулаішілік реакциялар;
3) бір элемент атомының бір мезетте тотығу дәрежесінің әрі өсуі, әрі кемуі арқылы жүретін диспропорциялану реакциялары.

ТТР теңдеулерін құрастыру, яғни реакция өнімдерін анықтау және стехиометриялық коэффициенттерді табу үшін келесі алгоритмді ұстанған жөн:
1) Тотықтырғыш пен тотықсыздандырғыш анықтап алу керек. Ол үшін типті тотықтырғыш пен тотықсыздандырғыштың тізімін пайдалану керек.
2) Реакциядан кейін тотықтырғыш пен тотықсыздандырғыш қандай тотығу дәрежелеріне ие болатынын анықтау керек. Реакцияға неғұрлым күшті тотықтырғыш қатысса, соғұрлым тотықсыздандырғыштың тотығу дәрежесі өседі. Мысалы, H2S әлсіз тотықтырғыштың әсерінен S0(S-2→ S0) -ке айналады, ал күшті тотықтырғыш әсер етсе, H2SO4-ке (S-2→ S+6) айналады.
Осыған ұқсас неғұрлым күшті тотықсыздандырғыш тотықтырғышпен әрекеттесе, соғұрлым тотықтырғыштың тотығу дәрежесі төмендейді.
Мысалы, H2SO4 әлсіз тотықсыздандырғыш әсерінен SO2-ге (S+6→ S+4), ал күшті тотықсыздандырғыш әсерінен H2S-ке (S+6→ S-2) айналады.
3) Берілген ортада (қышқыл, сілтілі және бейтарап) тотыққан және тотықсызданған элементтер қандай қосылыс күйінде болатынын анықтайды. Мысалы, Fe+3 қышқыл ортада Fe(III) тұзы күйінде, ал сілтілі ортада Fe(OH) 3 күйінде болады.
4) ТТР теңдеуіндегі коэффициенттер электрондық және электронды-иондық баланс арқылы анықталады.

ТТР-сы теңдеулерін теңестіру реті төмендегідей: 1. Химиялық реакция теңдеулерін жазу.
Al+H2SO4 Al2(SO4) 3+H2
2. Теңдеулердің оң және сол бөлігіндегі барлық әлементтердің тотығу дәрежелерін тауып, таңбасының үстіне жазу. 0 +1+ 6 -2 +3 +6 -2 0 Al+H2SO4Al2(SO4) 3+H2
3. Реакция нәтижесінде тотығу дәрежесі өзгерген элементтердің астын сызу.
0 +1+6-2 +3 +6 -2 0 Al + H2SO4 Al2(SO4) 3 + H2

4. Электрондық баланс теңдеуін құру. (ағылшынша balance-
теңдестіру, тепе-теңдік) :
Al - 3ē Al0 +3 3 2 2H+1 + 2ē = H2 2 3
5. Таңдалған коэффиценттерді реакция теңдеуіне жазу.
2Al+3H2+1S+6O4-2 =Al2+3(S+6O4-2) 3+3H2
6. Оттек атомдарының санын есептеу арқылы
коэффиценттердің дұрыс екендігін тексеру.
2 2Al+3H2+1S+6O4-2 =Al2+3(S+6O4-2) 3+3H2

ТТР теңдеулері күрделірек болғанда мына реттілікті қолдану.
1 Тотығу дәрежесі өзгергендерінің астын сызу
K+1Mn+7O4-2 + H+1Cl-1 → K+1Cl-1 + Mn+2Cl2 + Cl20 + H2+1O-2
2 Тотығу дәрежесі өзгерген атомдарды немесе иондарды бөліп
жазу.
Mn+7 → Mn+2
Cl-1 → Cl0
3. Атомдар немесе иондар қанша электрон беріп не қосып алатын санмен көрсетіп жазу.
Mn+7 +5ē = Mn+2
Cl-1 -ē = Cl0
Мұнда, Cl атомдарының молекула түзетінің ескеру керек.
2Cl-1 -2ē = Cl20

4. Электрондық теңдеудің қасына тік сызық сызып, оның сыртына электрондардың алдында тұрған коэффициенттердің орнын ауыстырып жазу.
Mn+7 +5e = Mn+2 2 ТТШ
2Cl-1 -2ē = Cl20 5 ТСШ
осы коэффициенттерді формуладағы атомдардың алдына жазу.
2KMnO4 +10HCl → KCl +2MnCl2 +5Cl2+H2O
5. Атомдар санын санап, коэффициенттерді койып, бағдаршаны теңдік белгісіне ауыстыру.
2KMnO4+16HCl = 2KCl+2MnCl2+5Cl2+8H2O

ТТР-ның маңызы:
ТТР өндірісте, тұрмыста жүзеге асып жататын процестер: газ пеште газдың жануы, тамақ пісіру, кір жуу, үй заттарын тазарту, аяқ-киім, парфюмериялық заттар дайындау, тоқыма бұйымдарын тазалау т. с. с.
Сіріңке жақсақ, аспанға фейерверк атсақ - бәрі де тотығу тотықсыздану процестері. Ағартуға, дезинфекциялауға, сатек асқын тотығының, калий перманганатының, хлор немесе хлорлы ағартқыш ізбесттің тотығу қасиеттері қолданылады. Заттың бетін тазартуға сутегі асқын тотығы қолданылады. Ол, сонымен қатар, жібекті, жүнді ағарта алады. Ескі картиналарды қалпына келтіреді. Ағзаға зиянсыз болғандықтан тамақ өнеркәсібінде шоколадты, сосиска дайындайтын етті ағартуға қолданылады. Калий перманганатының дезинфекциялағыш қасиеті де тотықтырғыш қасиетіне негізделген. Хлорды күшті тотықтырғыш ретінде таза суды стерильдеуге және ағын суларды
залалсыздандыруға қолданады. Хлор көптеген бояуларды түссіздендіріп, ағартады. Сондықтан оны мата мен қағазды ағартуға қолданады. Табиғатта ТТР кеңінен таралған. Ол биохимиялық процестерде: тыныс алу, зат алмасу, жануарлар мен адамдардың жүйке қызметінде маңызды роль атқарады. ТТР нәтижесінде біздің ағзамыз тамақтан алатын энергияны жұмсау арқылы адамның іс-әрекеттері жүзеге асырылып жатады.

Мәтінмен жұмыс
Сұрақтар:
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz