Күкірт қосылыстары және күкіртсутектің химиялық қасиеттері: сабақ жоспары



1 - кезең. Ұйымдастыру
2 - кезең. «Үй тапсырмасын тексеру»
3 - кезең. «Жаңа сабақты түсіндіру»
4 - кезең. «Жаңа сабақты бекіту»
5 - кезең. «Топтастыру кластер»
6 - кезең. «Ойлан, тап!»
7 - кезең. « Өзгерісті жүзеге асыру»
9 - кезең. «Бағалау»
10 - кезең. «Үйге тапсырма беру»
11 - кезең. «Қорытындылау»
8 - кезең. «Венн диаграммасы»

Үй тапсырмасын тексеру


(ПС орны бойынша белгілерді анықтап айту)
А) Ой қозғау
3
3
32S16
R+4O2
VIA
зр4
S+6O3
H2R-2

1. Аллотропия
дегеніміз не?
2. Күкірттің
қандай
аллотропиялық
түр өзгерістері бар?

3. Сынаптың
ұсақ
тамшыларын
қалай
бейтараптауға
болады?
4. Эбонит
деген
не?

5. Күкірттің
қосылыстарындағы
тотығу
дәрежесі қандай?

“ Жаңа сабақ ”

Күкірттің қосылыстары. Күкіртсутек.


Аралас сабақ.
Т
үр
І
Сұрақ - жауап әдісімен жаңа білімді меңгерту.
ә
ді
с
і
Д. И. Менделеев кестесі, слайдтар, тірек - сызбалар,
ВЕНН диаграммасы, карточкалар, суреттер.
көрнкілі
к
С А Б А Қ Т Ы Ң

1. Табиғатта кездесуі
Мұнай газдарында
Жанартау атқылағанда
Минералды суларда
Табиғи
газдарда
Белокты заттар шірігенде
H2S

2. Алынуы
Зертханада → H2 + S = H2S ↑
(КИПП аппаратында)
↓
FeS + 2HCl → H2S ↑ +FeCl2
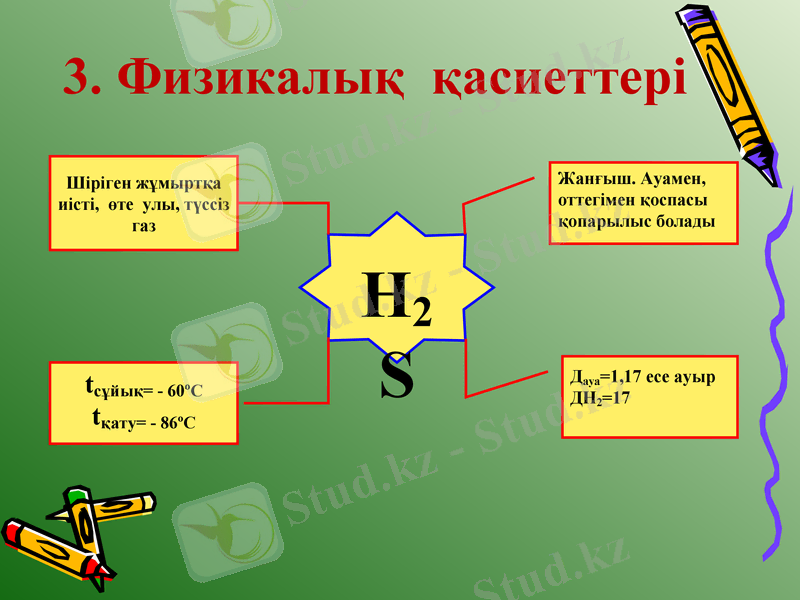
3. Физикалық қасиеттері
H2S
Жанғыш. Ауамен, оттегімен қоспасы қопарылыс болады
Дауа=1, 17 есе ауыр
ДH2=17
Шіріген жұмыртқа иісті, өте улы, түссіз газ
tсұйық= - 60ºC
tқату= - 86ºC

Электрондық құрылысы
· ·
Н · · S · · Н
· ·

4. Химиялық қасиеттері
Жай заттармен
1. H2S + Br2 = 2HBr +S
2. 2H2S +3O 2 = 2H 2 O+2SO 2
Ауада көгілдір жалынмен жанады
3. 2H2S +O 2 = 2H 2 O+2S ↓
Бос күкіртке дейін тотығады (өндірісте)
Күрделі заттармен
1. H2S +2NaOH = Na 2S +2H2O
2. H2S +HNO3 = S +2 NO2 + 2H2O
Екі негізді әлсіз қышқыл сатылы диссоциацияланады
1. H2S = H+ + НS -
2. HS - = H+ + S 2-
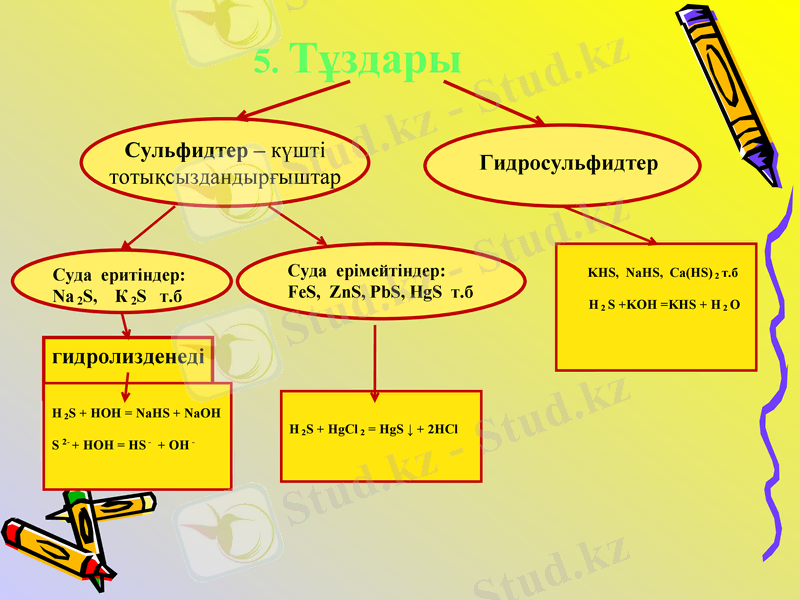
5. Тұздары
Сульфидтер - күшті тотықсыздандырғыштар
Гидросульфидтер
Суда еритіндер:
Na 2S, К 2S т. б
Суда ерімейтіндер:
FeS, ZnS, PbS, HgS т. б
гидролизденеді
Н 2S + НОН = NaHS + NaOH
S 2- + НОН = HS - + OH -
Н 2S + НgCl 2 = HgS ↓ + 2HCl
KHS, NaHS, Ca(HS) 2 т. б
H 2 S +KOH =KHS + H 2 O

S-2 ионын анықтау үшін
Рb2+ ионы реактив болады.
Н 2S + Рb(NO3) 2 = PbS↓ + 2HNO3
Na 2S + Рb(NO3) 2 = PbS↓ + 2NaNO3
S-2 + Рb 2+ PbS↓
қара

Организмге әсері.
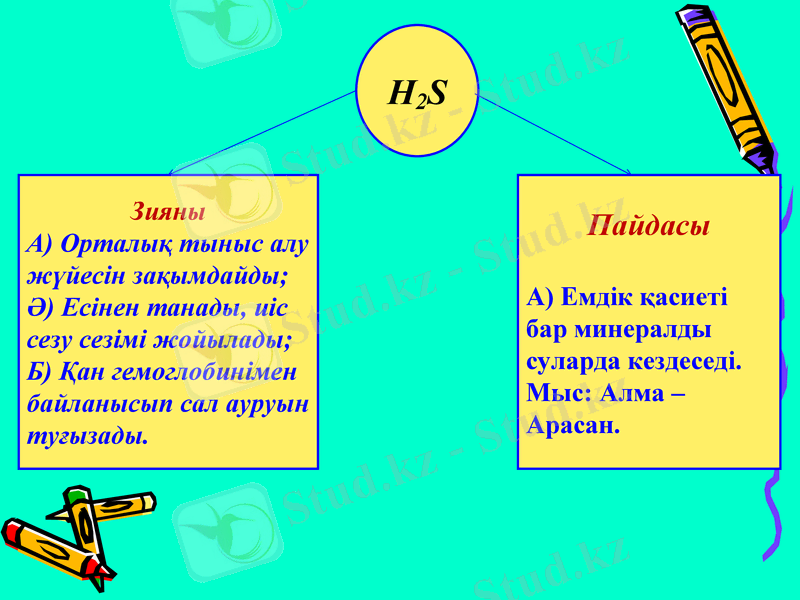
Зияны
А) Орталық тыныс алу жүйесін зақымдайды;
Ә) Есінен танады, иіс сезу сезімі жойылады;
Б) Қан гемоглобинімен байланысып сал ауруын туғызады.
Пайдасы
А) Емдік қасиеті бар минералды суларда кездеседі.
Мыс: Алма - Арасан.
H2S

“Қолданылуы”
Аналитикалық химияда ерітіндіден әртүрлі металл катиондарын бөлуде және анықтауда қолданылады.

Жаңа сабақты бекіту
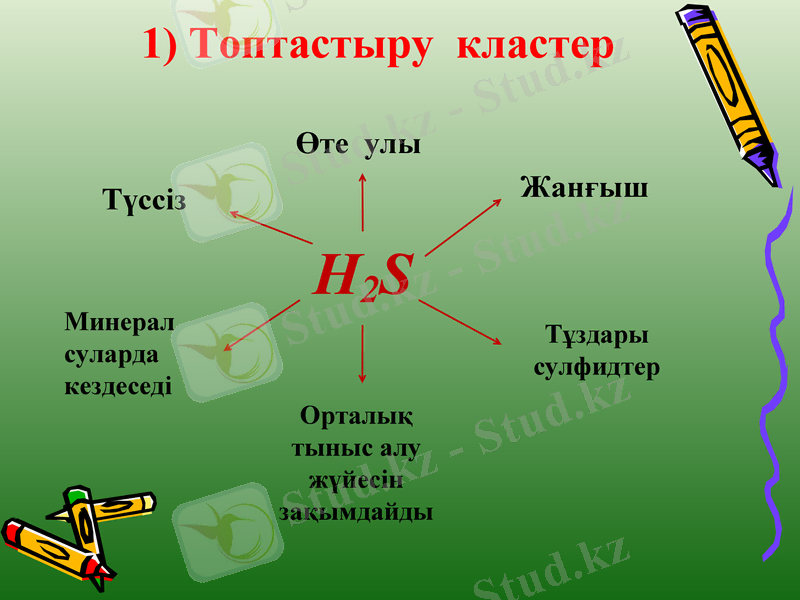
1) Топтастыру кластер
H2S
Өте улы
Жанғыш
Түссіз
Минерал суларда кездеседі
Тұздары сулфидтер
Орталық тыныс алу жүйесін зақымдайды
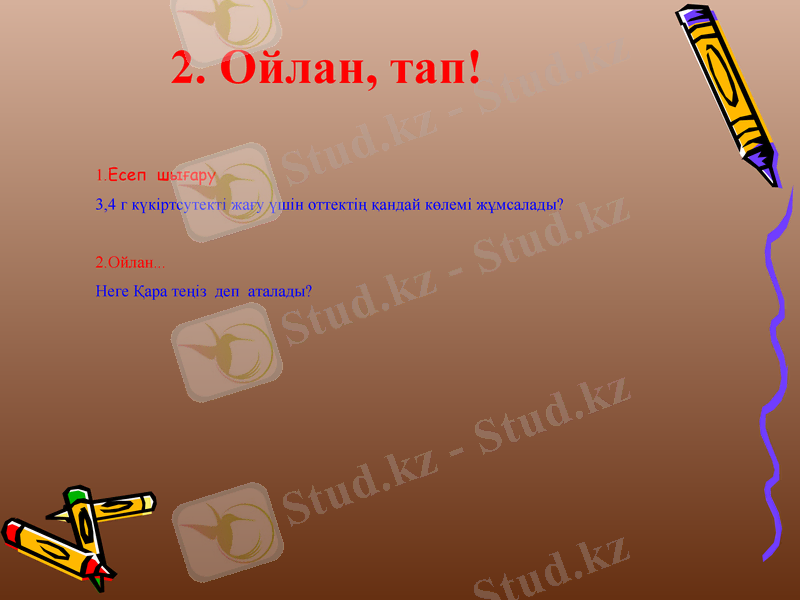
1. Есеп шығару
3, 4 г күкіртсутекті жағу үшін оттектің қандай көлемі жұмсалады?
2. Ойлан . . .
Неге Қара теңіз деп аталады?
2. Ойлан, тап!

3) Өзгерісті жүзеге асыру
А) Fe → FeS → H2S → Na2S
Ә) FeS → H2S →S → SО2→ SО3 → Na2SО4
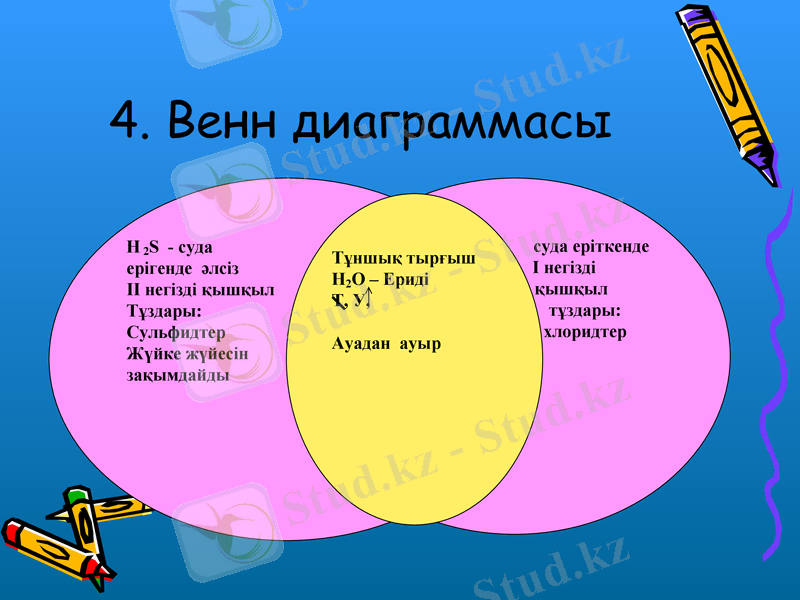
4. Венн диаграммасы
“Үйге тапсырма”

“Бағалау”
“Қорытындылау”

Сау
болыңыздар!
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz