Фосфор элементі: қасиеттері, аллотропиясы және қолданылуы - 9-сыныпқа арналған конференция сабақ жоспары



Туған жылы: 1989жыл. 15- шілде
Ұлты: Қазақ.
Білімі: Жоғарғы
Бітірген оқу орны: М. Өтемісұлы атындағы Батыс Қазақстан мемлекеттік университеті, 2010
Мамандығы: Химия пәнінің мұғалімі
Жұмыс орны: Қоғалытүбек негізіг орта мектебі.
Санаты: -
Педагогикалық еңбек өтілі: 3- жыл.
Султашова Жанар
Касымовна

Тақырыбы:
Фосфор
9-сынып

Мақсаты: Фосфор, оның периодтық жүйедегі орнына сипаттама беру,
ашылу тарихымен таныстыру, физикалық, химиялық қасиеттері,
қолданылуы жайлы білім алуға жағдай туғызу.
Күтілетін нәтиже: 1. Фосфордың периодтық жүйедегі орнына сипаттама бере
алады.
2. Фосфордың ашылу тарихы мен таралуы туралы танысады.
3. Қасиеттері мен қолданылуы жайында біледі.
4. Фосфордың адам ағзасы үшін маңызын айта алады.
5. Тақырыпқа сәйкес тапсырмалар, есептер орындай алады.
Көрнекілігі: Д. И. Менделеевтің периодтық жүйесі, сызба−суреттер.
Сабақтың түрі: конференция сабақ
Сабақтың әдісі: сұрақ-жауап, ізденіс, есеп шығару, ой-қозғау, ойтүрткі.
Пәнаралық байланыс: медицина, биология, тарих, география, математика,
физика
Тренинг ойнату
«Көршілер».
І Қызығушылықты ояту
Өткен білімді
тексеру үшін
«Сенесің бе,
сенбейсің бе?»
ойынын ойнату.
Конференцияға
қатысушылармен
таныстыру.

Конференцияға қатысушылар:
Химик, физик, биолог, дәрігер, агроном, тарихшы, геграф, ізденуші
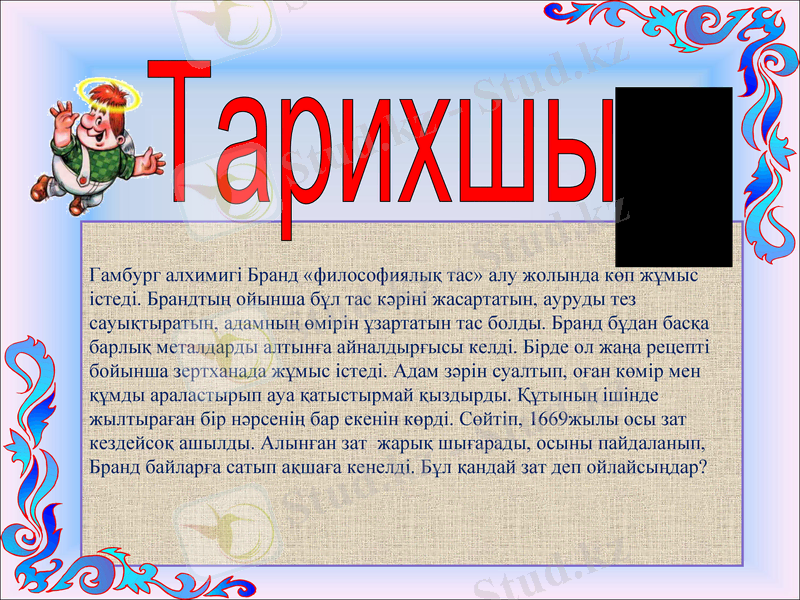
Гамбург алхимигі Бранд «философиялық тас» алу жолында көп жұмыс істеді. Брандтың ойынша бұл тас кәріні жасартатын, ауруды тез сауықтыратын, адамның өмірін ұзартатын тас болды. Бранд бұдан басқа барлық металдарды алтынға айналдырғысы келді. Бірде ол жаңа рецепті бойынша зертханада жұмыс істеді. Адам зәрін суалтып, оған көмір мен құмды араластырып ауа қатыстырмай қыздырды. Құтының ішінде жылтыраған бір нәрсенің бар екенін көрді. Сөйтіп, 1669жылы осы зат кездейсоқ ашылды. Алынған зат жарық шығарады, осыны пайдаланып, Бранд байларға сатып ақшаға кенелді. Бұл қандай зат деп ойлайсыңдар?

Фосфор химиялық элементтердің Д. И. Менделеевтің ашқан периодтық жүйесінің элементі. Ол үшінші период пен бесінші топтың қиылысқан жеріндегі он бесінші тор көзге орналасқан және реттік нөмірі он бес, атомдық масса салмағы 31. Фосфор - бейметалл.
Оның ядросында 15протон, 16нейтрон бар. Электрондардың жалпы саны да 15-ке тең. Электрондық құрылысы:
Р 1s22s2 2p6 3s2 3p3
Фосфор қосылыстарында ІІІ, Ү - валенттілік көрсетеді, тотығу дәрежелері -3, 0, +3, +5.
Алынуы: Са3 (РО4) 3 + SіО2 + 5С → 3СаSіО3 + 5СО↑ + 2Р

Географ:
Фосфордың жер қыртысындағы массалық үлесі 0, 12%. Фосфор табиғатта тек қосылыс күйінде 190-дай минералдардың құрамында кездеседі. Қазақстанда фосфорға жбай кен орындары бар. ХХғ 30жылдарында Ақтөбе облысында фосфорит кені табылған. Ақтөбе кен орындарының негізгі артықшылығы - олардың қабаттары жер бетіне жақын орналасқан және пайдалы қазбаны ешқандай кедергісіз өндіруге болады. Мұнда жалпы қоры жүздеген миллион тоннаға жететін ондаған ірі кен орындары бар.
30-жылдардың аяғында (1938-1940) Қаратау бассейні ашылды. Бассейнде 26кен орны бар. Бассейннің ең бай шикізатында 28-34% Р2О5 бар. Фосфордың табиғи қосылыстары фосфорит Са3(РО4) 2 пен апатит Са5(РО4) 3ОН Қаратауда кездеседі. Оңтүстік Қазақстанда, Аят және Лисаковск кен орындарындағы қоңыр тас көмірдің құрамында фосфордың едәуір қоры бар. Жаңатас, Шымкент пен Таразда фосфор зауытары жұмыс
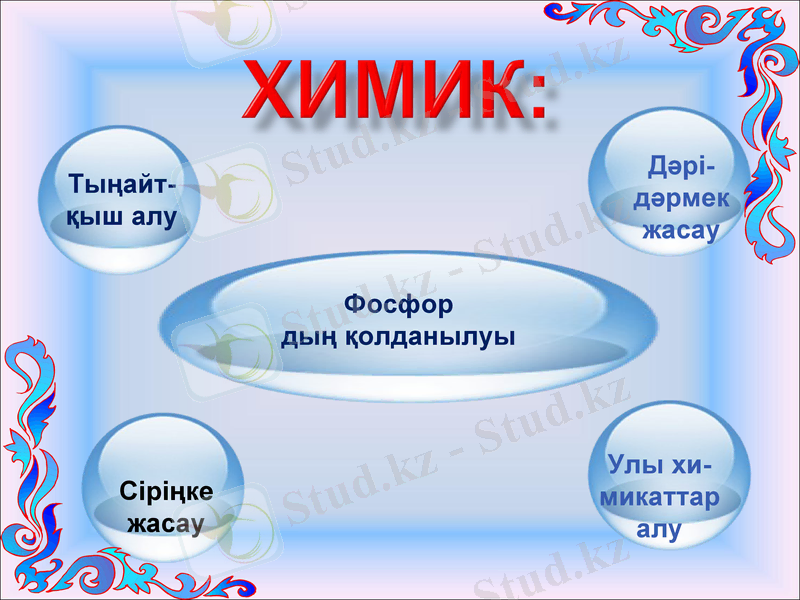
істейді. Фосфор сіріңке және улы химикаттар өндірісінде пайдаланылады.

ФОСФОРДЫҢ АЛЛОТРОПИЯЛЫҚ ТҮР ӨЗГЕРІСІ
Ақ
фосфор
Қызыл
фосфор
Қара
фосфор

Физик:
Ақ фосфор -өте белсенді, улы зат, түнде жарықырап сәуле шығарады. Суда ерімейді, сондықтан оны су астында сақтайды.
Ауасыз ортада қыздырғанда ақ фосфор қызыл фосфорға айналады, ал жоғарғы қысымда қара фосфорға айналады.
Қара фосфор-2000°С өте жоғары қысымда қыздырғанда түзіледі. Түсі графитке ұқсас, қолға майдай сезіледі. Активтігі нашар, жартылай өткізгіш, улы емес, 5000°С-де от алады.
Қызыл фосфор -түсі қоңыр-қызыл, улы емес, суда нашар ериді, ұшпайды, 2500°С-де от алады.
Фосфор

Сіріңкені 1831жылы 19жасар Шарл Сориа алғаш ойлап тапқан. Бірақ ол сіріңкеге патент ала алмады, себебі ол қымбат болатын. 1832 жылы неміс мұғалімі Камерер сіріңкеге патент алып, оны өндіре бастады. Бірақ оның сіріңкесі ақ фосфордан жасалғандықтан өте қауіпті болды. Қауіпсіз сіріңкені 1848 жылы швед химигі Бетгер алды. Бұл өзіміздің кәдімгі сіріңкеміз, ол қызыл фосфордан жасалады.

Биолог:
Фосфор адам және басқа тірі ағзалар тіршілігі үшін қажет элемент. Кальций ортофосфаты қаңқаға беріктік қасиет береді. Ол бұлшықет, жүйке, кемік ұлпаларының құрамына кіреді. Ол туралы атақты геохимик, ақадемик А. Е. Ферсман «фосфор-тіршілік пен ақыл-ой элементі» деген болатын. Себебі, мидың қызмет, бұлшықеттің қимылы фосфор қосылыстарының химиялық өзгерістеріне байланысты. Фосфор ет ұлпасында 56грамм кездеседі. Адам сүйегінде 600грамм фосфор бар. Адам мен жануарлар фосфорды өсімдіктен алады.

Фосфор тыңайтқыштары егіс дақылдарында зерттелінді. Қаратау фосфоритінен жасалған поли және ортофосфаттар тұзды топырақтарға қолданғанда, тұздылық әсерін азайтатын және ауыр металдардың қозғалысын тежеп, өсімдік тамырына зиянсыз жағдайға жеткізетін механизмдерінің бары және олардың тиімді тыңайтқыштар екені дәлелденді. Фосфор элементі азоттан кейін керекті екінші элемент болғанымен, тұзды топырақта өсімдікке қорек ретінде жетіспесе, биохимиялық реакцияларға қуат беру көзі кеміп, қиындықтар туындайды. Яғни, өсу, даму процестерін жеделдету үшін жүретін реакцияларға қуат жетіспейді де, даму жағдайы күйзеліске ұшырап, өнімге өнім сапасына кері әсерін тигізеді.

Фосфор жай және күрделі заттармен әрекеттеседі.
Оттегімен оксид түзеді: 4Р+5О2 → 2Р2О5
Галогендермен галогенидтер береді: 2Р+3СІ2 → 2РСІ3
Күкіртпен сульфид түзеді: 2Р+3S → Р2S3
Металмен фосфид түзеді: 3Са + 2Р →Са3Р2

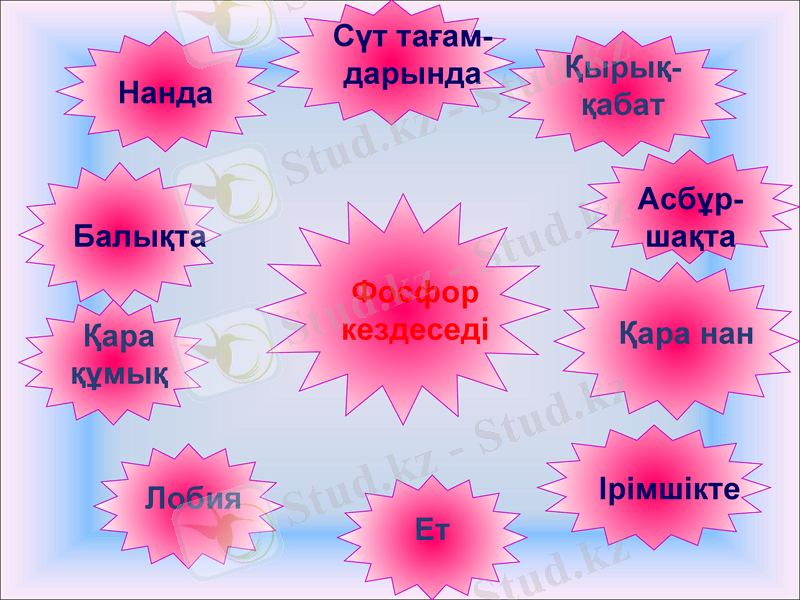
Фосфор жануар мен адам сүйегінде, бұлшықетте, ми ұлпаларында болатыны анықталды. Фосфор адамның жадын жақсартады, оны біз наннан, ас бұршақтан, балықтан, ірімшіктен аламыз. Массасы 70кг адамның денесінде шамамен 800г фосфор болады. Сондықан балық пен сүт тағамдарын ас мәзіріне күнделікті кіргізіп отыру керек.
Фосфор
кездеседі
Сүт тағам-
дарында
Асбұр-
шақта
Ірімшікте
Балықта
Нанда
Қырық-
қабат
Қара нан
Ет
Лобия
Қара
құмық

Есептер шығару
№1-есеп. Массасы 7, 1г фосфор (V) оксиді судың артық мөлшері-мен әрекеттескенде түзілген фосфор қышқы-лының массасын есепте.

Есептер шығару
№2-есеп. 15, 5г Са3(РО4) 2 ыды-рағанда түзілетін фосфор (V) оксидінің массасын есепте.

Химиялық диктант
1. Фосфорды . . . жылы . . . ашты.
2. Фосфор қосылыстарда . . . тотығу дәрежелерін көрсетеді.
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz