Фосфор элементі: периодтық орны, қасиеттері, алынуы және қолданылуы



Фосфор
Ақтөбе облысы
Алға қаласы
№1 Алға мектеп-бақшаның
Химия пәні мұғалімі
Избасарова Жанар Азатовна

Үй тапсырмасын
қайталау

Қайталау- оқу анасы
1. Формула тап
NH3 .
NO2 .
HNO3 . .
N2
NH4OH . .
NaNO3
NH4Cl .
NH4NO3 . . .
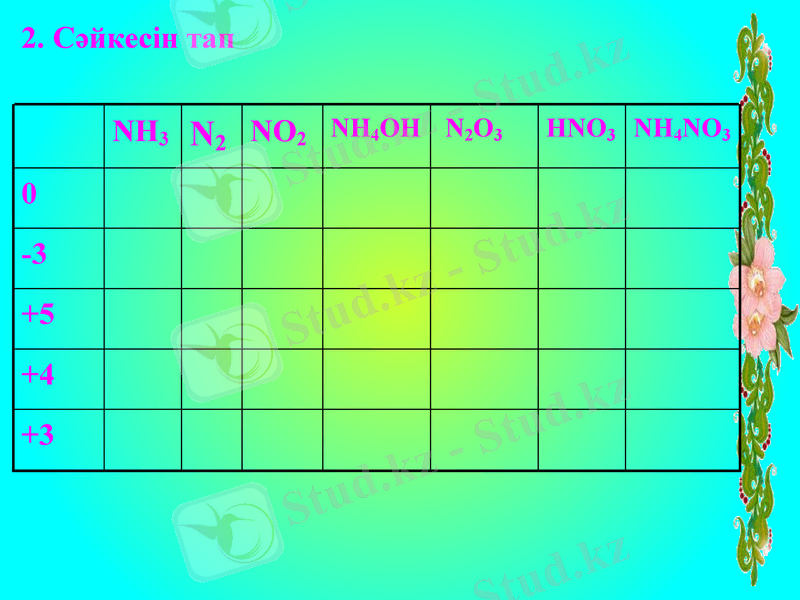
2. Сәйкесін тап
NH3
N2
NO2
NH4OH
N2O3
HNO3
NH4NO3
0
-3
+5
+4
+3

3. Орнын тап
Өткір иісті газ NH3 Аммиак алуда
Қоңыр-қызыл түсті газ NH4OH Тыңайтқыш ретінде
Ауада түтінденеді, N2 Дәрі-дәрмек ретінде
сарғыш тартады
Түссіз, иіссіз газ HNO3 Қышқыл алуда
Әлсіз негіздік сұйықтық NO2 Бояу, қағаз алуда
Ақ түсті кристалдар NH4NO3 Сутек синтезінде

Фосфор және
оның қасиеті
Жаңа сабақ

Қызығушылықты ояту
Жаңа сабаққа кіріспес бұрын, оқушыларға шағын фосфор жайында сұрақтар қойылады.
1. “Фосфор” деген қандай мағына береді?
2. Фосфорды алғаш ашқан кім?
3. Фосфорды біз тұрмыста қайда кездестіреміз?
4. Фосфор қандай тағамдардың құрамында болады?
5. Фосфор жетіспесе қандай ауру болуы мүмкін?
6. Фосфорды қай жануар ұнатады?
7. Фосфор жайында айтылған теңеуді білесіз бе?

Фосфордың атом құрылысы
Периодтық жүйедегі орны
Р
15
31
)
3
5е
ТОП
Период
3s 3p
2
3
-3, 0, +3, +5 тотығу дәрежесі тән
орын
1669 жыл неміс алхимигі Бранд ашқан
)
)
2
2
8
1
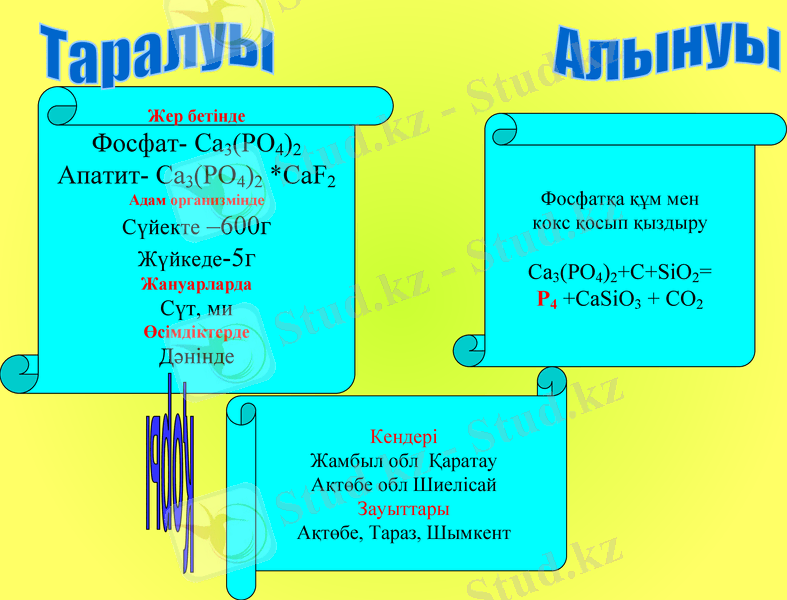
Алынуы
Жер бетінде
Фосфат- Ca3(PO4) 2
Апатит- Ca3(PO4) 2 *CaF2
Адам организмінде
Сүйекте -600г
Жүйкеде-5г
Жануарларда
Сүт, ми
Өсімдіктерде
Дәнінде
Таралуы
Фосфатқа құм мен
кокс қосып қыздыру
Ca3(PO4) 2+C+SiO2=
P4 +CaSiO3 + CO2
Кендері
Жамбыл обл Қаратау
Ақтөбе обл Шиелісай
Зауыттары
Ақтөбе, Тараз, Шымкент
Қоры


Р
Р
Р
Ақ түсті кристалл зат ρ=1, 83г/см3
Қараңғыда жарқырайды
Кәдімгі жағдайда тотығады
От алғыш, су астында сақтайды
Суда ерімейді, CS2 ериді
Өте қауіпті, улы
t қай=280°С, tб=44°С
Аморфты зат ρ=2, 20г/см3
Қараңғыда жарқырамайды
260°С-та тотығады
Отқа қауіпті емес, қыздырғанда от алады
Судада, CS2 де ерімейді
Улы емес
tб=400°С
Қара түсті, металдық жылтыры бар, кристалл зат
Сирек кездеседі
t
t
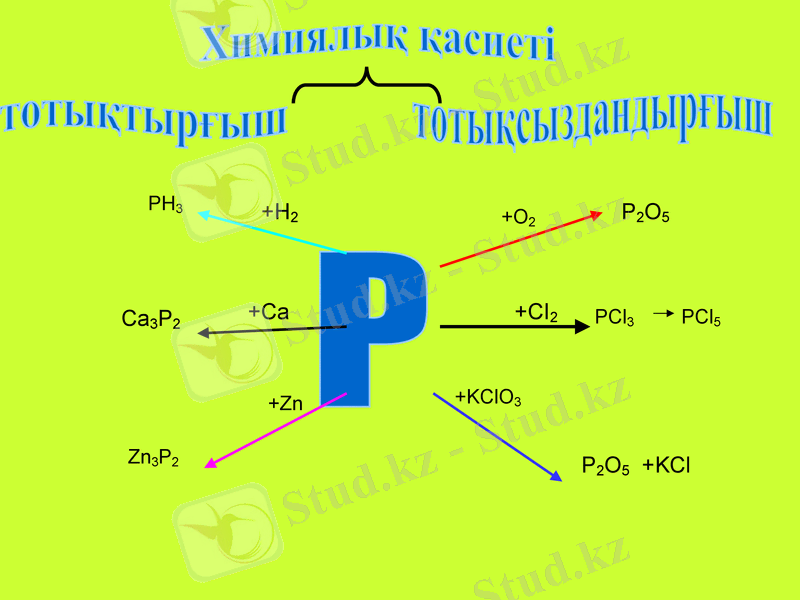
Химиялық қасиеті
тотықтырғыш
тотықсыздандырғыш
Р
+Н2
+СІ2
+Са
+О2
+Zn
+KClO3
PH3
Ca3P2
Zn3P2
P2O5
PCl3
PCl5
P2O5 +KCl

Биологиялық рөлі
Қолданылуы
Сүйекке беріктілік береді
Зат алмасуды реттейді
Зиянкес кемірушілермен күресуде Zn3P2
Шырпы (қызыл) өндірісінде
Пиротехникада
Фосфор қышқылын өндіуде
Дәрі-дәрмек өндірісінде
Тыңайтқыштар алуда

Сергіту сәті
Сандарды сөйлетейік
15
31
1669
5
44
400
280

Реакцияны аяқта
P + …. = PI3
P+ S = ….
P + K = …
Р + СІ2(артық) = . . .

Бекіту
Тест орындау
1. Фосфордың периодтық жүйедегі орны қандай?
А) 2период, ІІІ топ Ә) 3период, Vтоп Б) 5период, V топ
2. Фосфордың электрондық формуласы?
А) 2s22p3 Ә) 3s23p3 Б) 2s22p5
3. Қауіпті, улы! Қараңғыда жарық шығарады. Қай фосфор туралы айтылған?
А) ақ Ә) қара Б) қызыл
4. Қай қосылыста фосфордың тотығу дәрежесі -3-ті көрсетеді?
А) P2O5 Ә) PH3 Б) H3PO4
5. Фосфорды алғаш анықтаған кім?
А) 1772ж Резерфорд Ә) 1669ж Бранд Б) 1807ж Дэви

Дұрыс жауаптары
1-Ә
2-Ә
3-А
4-Ә
5-Ә

Есеп шығару
1. Фосфордың пайыздық мөлшері қай қосылысында жоғары екенін есептеп табыңдар?
P2O5, PH3, H3PO4, P2O3
2. 3, 1г кальций фосфатынан қанша фосфор алуға болады? 0, 62г

Қорытындылау
Қорытындылау үшін Венн диаграммасын пайдаланамыз. Азот пен Фосфордың ұқсас қасиеттері мен айырмашылығын жазу қажет.
Азот
фосфор

Үйге тапсырма
§18 оқу, қайталау
№5 тапсырма бойынша қосымша мағлұматтар іздеп келу
№6-8 тапсырмалар(есеп)
Бағалау
Қолданылған әдебиеттер
9 сынып оқулығы : Н. Нұрахметов, К. Сарманова, К. Жексембина авторлығындағы, 2009ж
2. “Как ты знаешь химию” В. Сорокин, Э. Злотников авторлығындағы жаттығулар мен есептер кітабы
3. Интернет сайттары

Тыңдағандарыңызға
рахмет
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz