Аммиак және оның қосылыстары: молекулалық құрылым, алынуы, қасиеттері және қолданылуы



№ 3 Хромтау орта мектебі
Мусина Гүлжанат Абдісадыққызы
Химия пәні мұғалімі

«Аммиак және оның
қосылыстары»

Сабақтың мақсаты:
1) Аммиак және оның
қосылыстарының
молекулалық құрылысы, алынуы, негізгі қасиеттері, аммиакты өндірісте өндіру жөніндегі білімдерін тереңдету.
2) Жеке- дара жұмыс істеу біліктерін, таным-дық, шығармашылық қабілеттерін дамыту.
3) Экологиялық және экономикалық тәрбие бере отырып, белсенділік, іскерлік икем -дағдысын жетілдіру.

Сабақ барысы:
I кезең. Жаңа білімді меңгертуге
даярлық
II кезең. Жаңа білімді меңгерту
III кезең. Деңгейлік тапсырмалар
IV кезең. Қорытынды.

1. Азот топшасының валенттілік
электрондарының формуласы қандай?
2. Азоттың қандай қосылыстарын
білесіңдер?
3. Азот не себепті инертті болады?
4. Азот оттекпен және сутекпен
қандай жағдайда әрекеттеседі?
Лездік сұрақтар
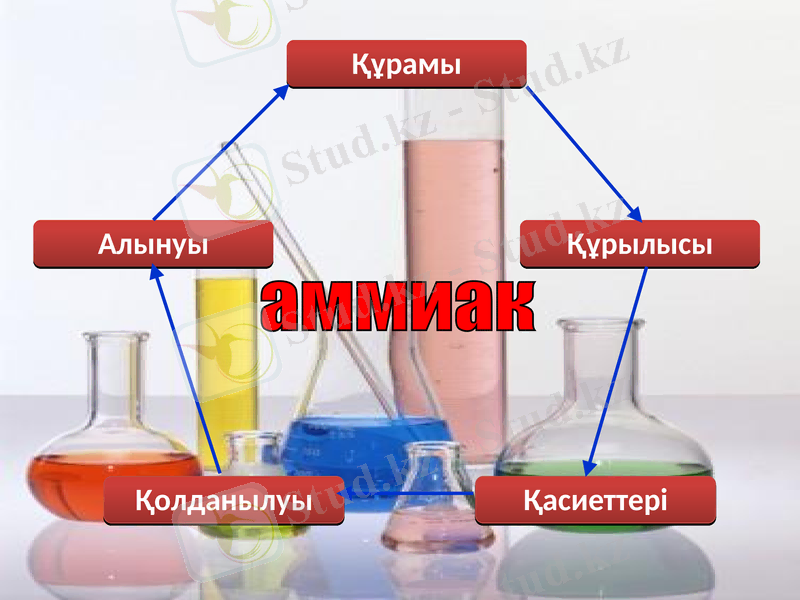
Құрамы
Құрылысы
Қасиеттері
Қолданылуы
Алынуы
аммиак
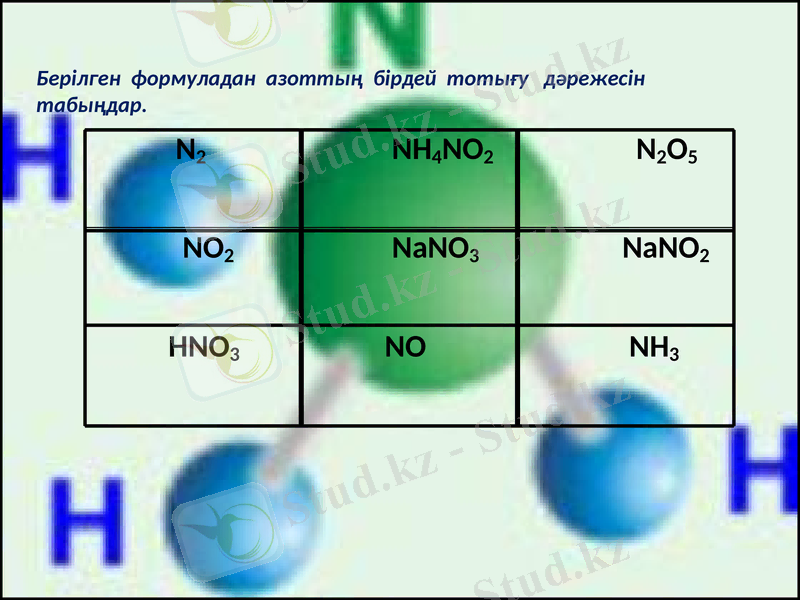
N2
NH4NO2
N2O5
NO2
NaNO3
NaNO2
HNO3
NO
NH3
Берілген формуладан азоттың бірдей тотығу дәрежесін табыңдар.
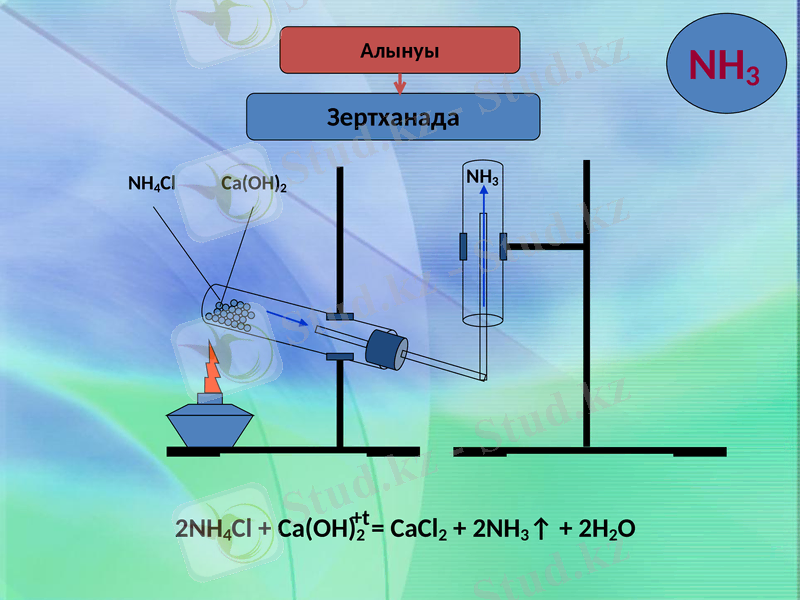
Алынуы
Зертханада
NH4Cl
Ca(OH) 2
NH3
9
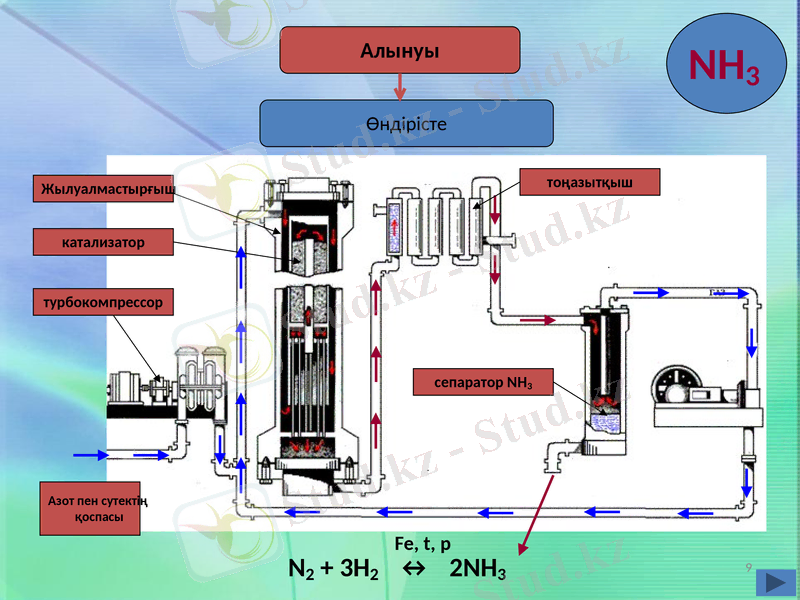
Өндірісте
Алынуы
Азот пен сутектің
қоспасы
турбокомпрессор
катализатор
Жылуалмастырғыш
тоңазытқыш
сепаратор NH3
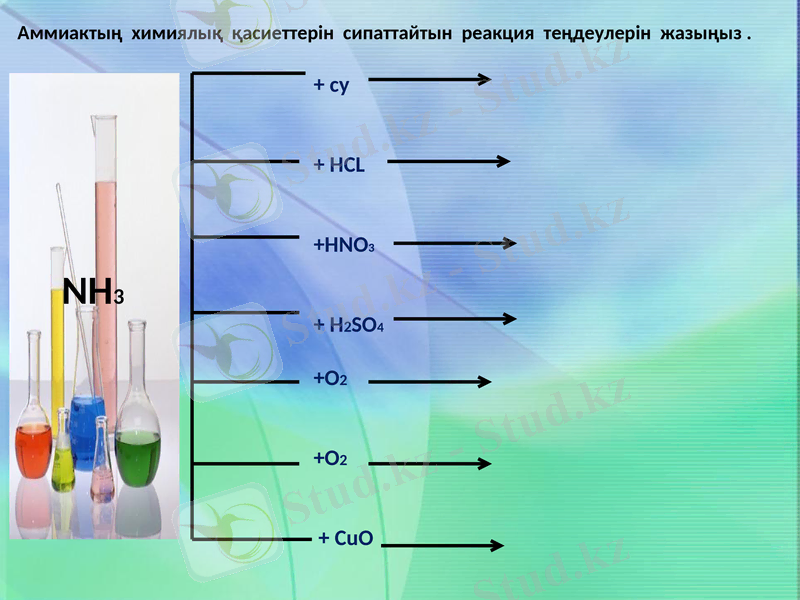
Аммиактың химиялық қасиеттерін сипаттайтын реакция теңдеулерін жазыңыз .
+ су
+ HCL
+HNO3
+ H2SO4
+O2
+O2
+ CuO
NH3
NH3
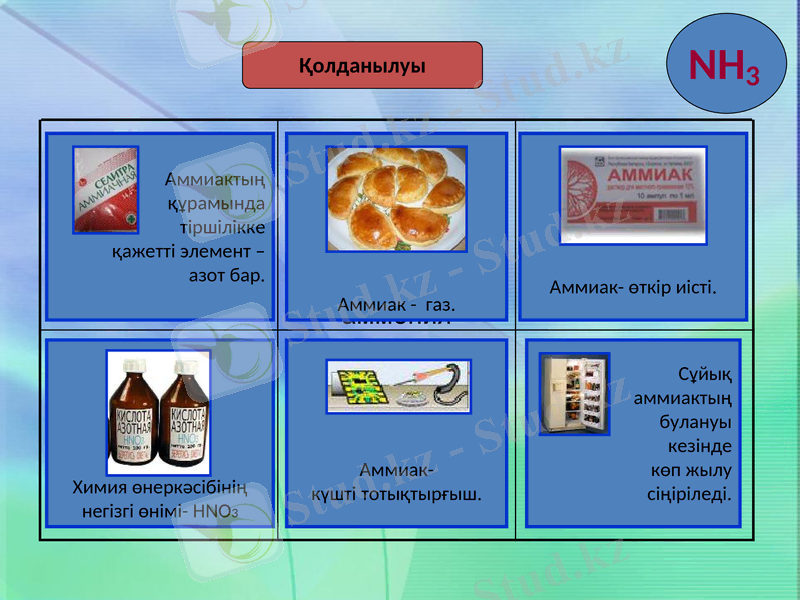
Қолданылуы
Рассчитайте массовую долю азота в аммиачной селитре
Запишите уравнение реакции разложения гидрокарбоната аммония
Рассчитайте объем аммиака для приготовления 50г 5% - ного нашатырного спирта (при н. у. )
Как осуществить превращения?
NH3 → NO → NO2 HNO3
Составьте окислительно-восстановительную реакцию взаимодействия хлорида аммония с оксидом меди.
Какой объем при нормальных условиях будет занимать 1 кг жидкого аммиака.

Аммиак өндіретін қондырғыдағы технологиялық процестің мәні: азотсутек қоспасынан реакция жылуын жылуалмастырғышта барынша тиімді пайдалану арқылы өршіткі салынған қорапшада жанасу әдісімен аммиак алу.
Аммиак өндірісінде мынадай
ғылыми принциптер
сақталады: жылу алмасу, қарама-қарсы ағыс, үздіксіз процесс, циркуляциялық процесс,
т. б.

1-деңгей. (5 ұпай)
Аммиактың құрылымдық және электрондық формуласын жазыңыз.
Аммоний тұздарына мысал келтіріңіз.
Аммиактың физикалық қасиетіне сипаттама беріңіз.
2-деңгей. (10 ұпай)
Алгоритімдік
Аммиакты зертханада және өрдірісте алу реакциясының теңдеуін жазыңыз.
Азоттың оттегімен, хлормен, сутегімен салыстырмалы тығыздығы қандай?
Мына формулаларда берілген заттардың қайсысы аммиакпен әрекеттеседі?
Реакция теңдеулерін жазыңыз.
a) O2 ; ә) Cl2 ; б) CuO ; в) H2SO4 ; г) F2
Деңгейлік тапсырмалар

3-деңгей (15 ұпай)
Эвристикалық
1) Іс жүзінде жүретін реакциялардың молекулалық, толық иондық және қысқартылған иондық түрінде жазыңыз.
a) NH4Cl+AgNO3 ә) (NH4) 2CO3+BaCl2
б) NH3+HNO3
в) N2+H2
Не істелді?
Не байқалды?
Қорытынды
2. Төменде берілген аммоний тұздарының қайсысында азот мөлшері көп екенін
есептеңіз. Ca (NO3) 2, NaNO3, NH3 .
4-деңгей (20 ұпай)
Шығармашылық
Зертханалық жұмыс. Аммоний тұзына сілті қосып, NH3 сапалық реакциясын тәжірибе арқылы байқап, кестеге толтырыңыздар.
Күкірт қышқылы өндірісінде қандай ғылыми принциптері қолданылғанын естеріңе түсіріп, оларды аммиак өндірісімен салыстырыңыздар.

Үйге тапсырма:
§22, № 6 - 8 есеп
Аммиактың маңызды қосылыстары
туралы хабарлама дайындау.
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz