Кальцийдің қасиеттері мен қосылыстары және судың кермектігі мен оны жою әдістері



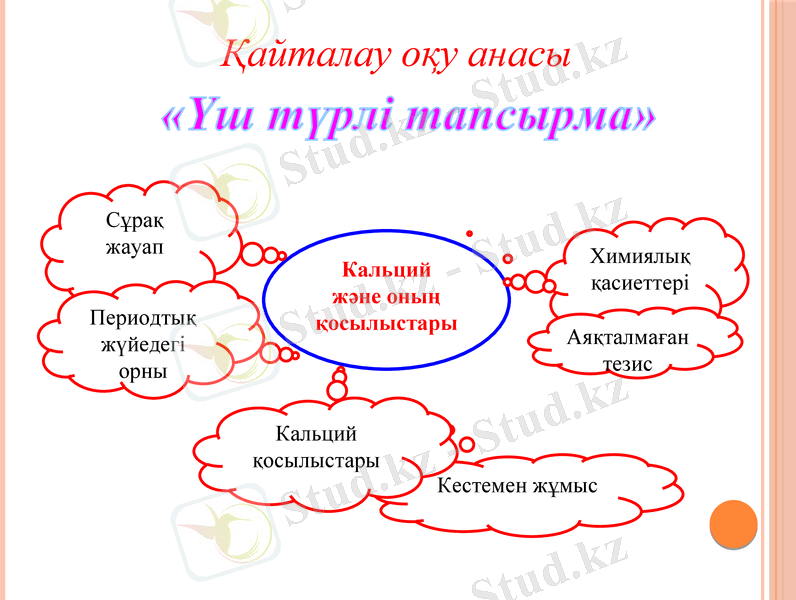
«Үш түрлі тапсырма»
Кальций
және оның қосылыстары
Сұрақ жауап
Химиялық қасиеттері
Кестемен жұмыс
Қайталау оқу анасы
Аяқталмаған тезис
Кальций қосылыстары
Периодтық жүйедегі орны

І топ. Периодтық жүйедегі орны
1. Химиялық таңбасы -
2. Реттік нөмірі -
3. Ar(Са) -
4. Период нөмірі-, топ нөмірі-
5. Кальцийдің электрондық формуласы-
6. Валенттілігі -
7. Протон саны-
8. Нейтрон саны -
9. Энергетикалық деңгей саны - 4 ) 2) 8) 8) 2

І топ. Периодтық жүйедегі орны
1. Химиялық таңбасы - Са
2. Реттік нөмірі - 20
3. Ar(Са) - 40
4. Период нөмірі- ІV (үлкен)
5. Топ нөмірі-ІІ (негізгі)
6. Кальцийдің электрондық формуласы 1s22s2 2p6 3s23p64s2,
7. Валенттілігі ІІ
8. Протон саны- 13
9. Нейтрон саны -14
10. Энергетикалық деңгей саны - 4 ) 2) 8) 8) 2

ІІ топ. Аяқталмаған тезис
1. Жай заттармен
Са + О2= . . .
Са + . . . = CaС
Ca + CI2= . . .
3Ca + . . . = Ca3 N2
. . . + H2= CaH2
2. Күрделі заттармен
Ca + 2H2 O = . . . + H2↑
Ca + . . . = CaCI2+ . . .

ІІ топ. Химиялық қасиеттері
1. Жай заттармен
2Са + О2 = 2СаО
Са + С = CaС
Ca + CI2= CaCI2
3Ca + N2 = Ca3 N2
Са + H2 = CaH2
2. Күрделі заттармен
Ca + 2H2 O = Ca(OH) 2 + H2↑
Ca + 2HCl = CaCI2+ H2↑
Ca + НNO3 = Ca(NO3) 2 + H2↑
Ca + H2 SO4 = Ca SO4+ H2↑
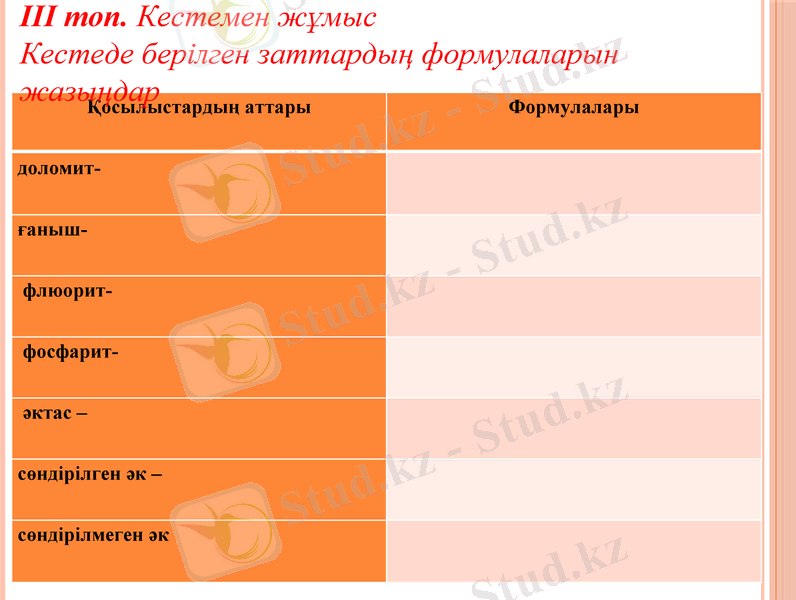
Қосылыстардың аттары
Формулалары
доломит-
ғаныш-
флюорит-
фосфарит-
әктас -
сөндірілген әк -
сөндірілмеген әк
ІІІ топ. Кестемен жұмыс
Кестеде берілген заттардың формулаларын жазыңдар

ІІІ топ.
Кальцийдің қосылыстары
1. Доломит - CaCO3*МgCO3
2. Ғаныш - СаSO4*2Н2О
3. Флюорит - СаF2
4. Фосфарит - Са3(РО4) 2
5. Әктас - СаСО3
6. Сөндірілген әк - Са(ОН) 2
7. Сөндірілмеген әк - СаО

Судың кермектігі және оны жою жолдары

Судың кермектігі және оны жою жолдары мен зияндылығын біле отырып, өмірдегі судың маңыздылығын бағалау.
Сабақтың мақсаты

152 бетті ашыңыздар, §34. 3 минут оқу
Өздеріңе тақырыптан алған жаңа мәліметтерді қара карандашпен бояп қойыңыздар.
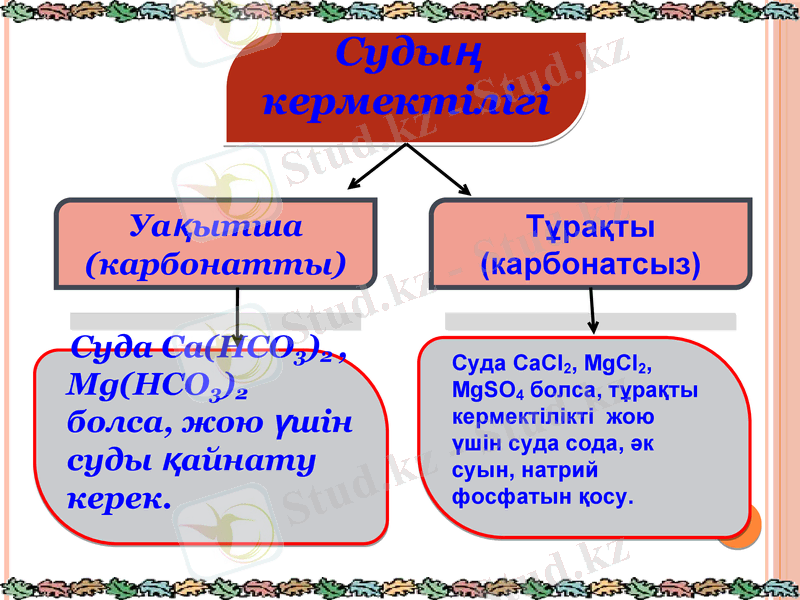
Судың кермектілігі
Уақытша (карбонатты)
Тұрақты (карбонатсыз)
Суда Ca(HCO3) 2, Mg(HCO3) 2 болса, жою үшін суды қайнату керек.
Суда CaCІ2, MgCl2, MgSO4 болса, тұрақты кермектілікті жою үшін суда сода, әк суын, натрий фосфатын қосу.
Notes: Судың кермектілігі
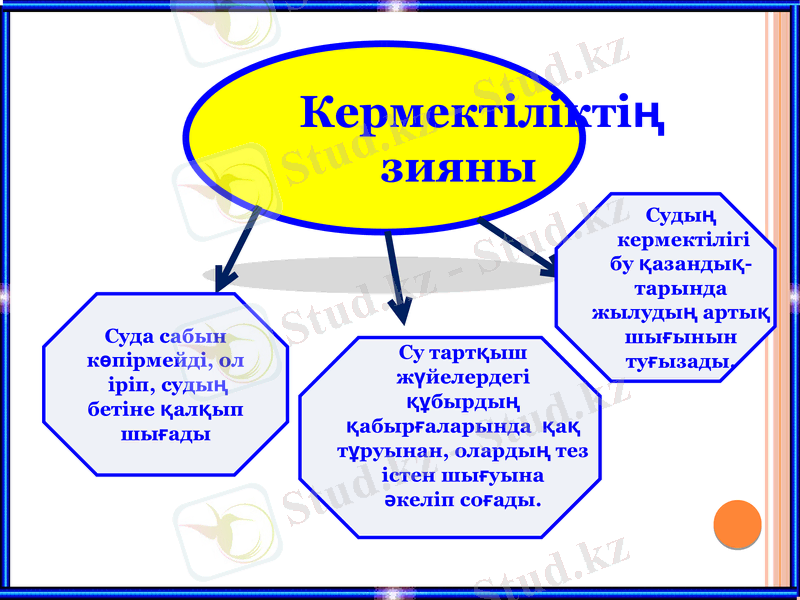
Кермектіліктің
зияны
Суда сабын
көпірмейді, ол
іріп, судың
бетіне қалқып
шығады
Су тартқыш
жүйелердегі
құбырдың
қабырғаларында қақ
тұруынан, олардың тез
істен шығуына
әкеліп соғады.
Судың
кермектілігі
бу қазандық-
тарында
жылудың артық
шығынын
туғызады.

Суды тазарту әдістері
Хлорлау
сүзу
хлорлау

Са(НСО3) 2
СаО + Н2О + СО2
Mg(НСО3) 2
Mg(OH) 2 + 2СО2
Са(НСО3) 2 + Са(ОН) 2
2CaCO3
Mg(OH) 2
+ 2CaCO3
+ 2H2O
Mg(НСО3) 2 + 2Са(ОН) 2
Уақытша кермектікті жою әдістері:
+ 2H2O

CaCl2 + Na2CO3
+ 2NaCl
CaCO3
MgSO4 + Na2CO3
MgCO3
+ Na2SO4
Тұрақты кермектікті жою әдістері:

Қазіргі таңда су кермектігін жоюдың құралдары

“Топтық жұмыс” - жаңа сабақты меңгерту

І топқа.
Кермек судың пайда болуы, оның зиянылығы.
ІІ топқа.
Судың кермектілігінің түрлері, оны жою жолдары.
ІІІ топқа.
Уақытша, тұрақты кермектіктің құрамындағы тұздар, оларды жұмсарту.

Жұп карточкалар
1 жұп. Кермек суды жұмсарту үшін, мына заттардың қайсысын қолданады.
2 жұп. Уақытша кермектік судың құрамында қандай тұздар болады, оны жою жолдарына мысал келтір.
3 жұп. Тұрақты кермектік судың құрамында қандай тұздар болады, оны жою жолдарына мысал келтір
4 жұп. Мына айнымалыны орында. СаСО3 А Са(ОН) 2
5 жұп. Төмендегі айнымалыны орында Са(NO3) 2 Б СаСI2
6 жұп. Төменде берілген иондар ішінен кермек суда болатын иондар мен суды жұмсарту үшін қолданатын иондарды теріп жаз.
Өзара бағалау

Дұрыс жауаптар
1 жұп. CaCI2, CaSO4, Mg(HCO3) 2, Ca(HCO3) 2,
2 жұп. Ca(HCO3) 2 карбонатты тұздар.
Оны жою жолдары қайнату, сода қосу арқылы.
Ca(HCO3) 2 → СаСО3 + СО2 + Н2О
Ca(HCO3) 2 + Са(ОН) 2 = СаСО3 + Н2О
3 жұп. CaCI2, CaSO4 бейкарбонатты тұздар. Оны химиялық әдіс - тәсілдер арқылы жояды.
СаSO4+ Na2CO3 = CaCO3 + Na2SO4
4 жұп.
1. СаСО3=CaO + CO2
2. CaO + H2O =Са(ОН) 2
5 жұп. Са(NO3) 2+ NaOH =Ca(OH) 2 +NaNO3
Ca(OH) 2 + HCI = СаСI2 + H2O
6 жұп. K+, Ca2+, Na+, Mg2+, H+,

Зертеу жұмысы
І тапсырма
А5, В6 заттардың атын атаңдар.
А5, В6, молекулалық массасын есептеңдер
ІІ тапсырма
А5 пен B6, айырылғанда жүретін реакция теңдеуін жаз
ІІІ тапсырма
8г Б1 мен Д3 әрекеттескенде түзілетін тұздың массасы қанша
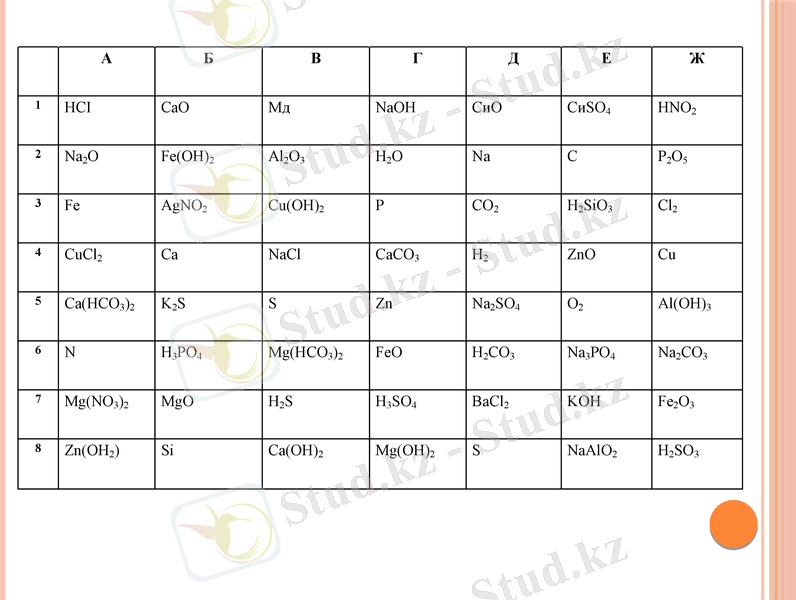
А
Б
В
Г
Д
Е
Ж
1
НСІ
СаО
Мд
NаОН
СиО
СиSО4
HNO2
2
Na2O
Fe(OH) 2
Al2O3
H2O
Na
C
P2O5
3
Fe
AgNO2
Cu(OH) 2
P
CО2
H2SiO3
Cl2
4
CuCl2
Ca
NaCl
CaCO3
H2
ZnO
Cu
5
Са(НСО3) 2
K2S
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz