Фармацевтикалық химия: карбонилді қосылыстар, спирттер, күрделі эфирлер, дәрумендер және фенолдар



Фармацевтикалық химия

Жоспар:
Карбонилді қосылыстар
Спирттер
Күрделі эфирлер
Дәрумендер
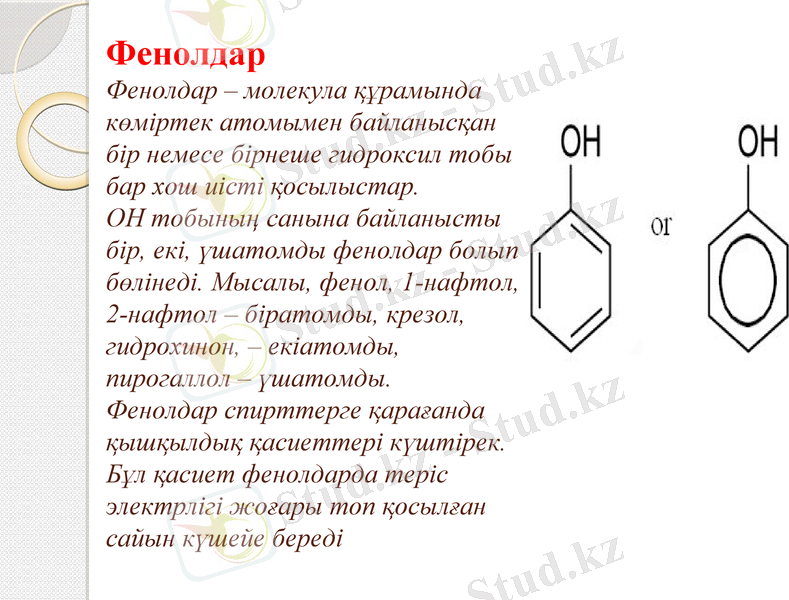
Фенолдар
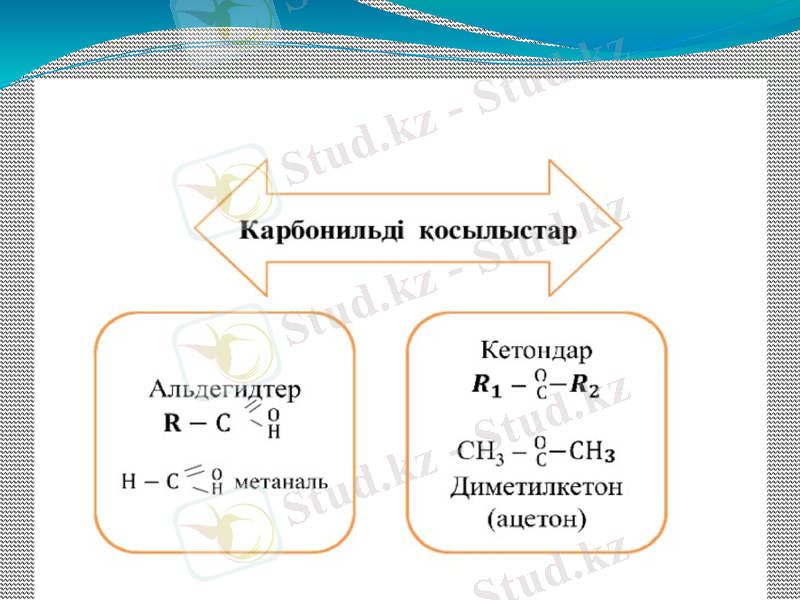
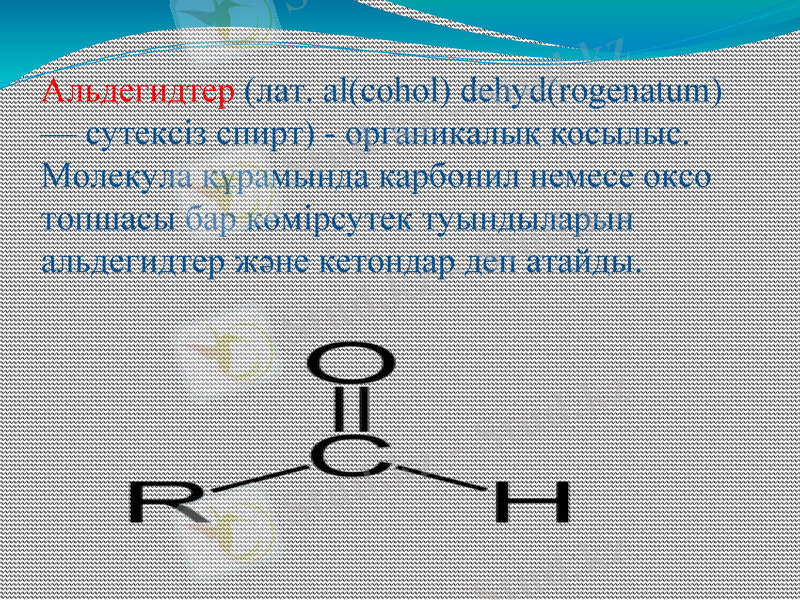
Альдегидтер (лат. al(cohol) dehyd(rogenatum) - сутексiз спирт) - органикалық қосылыс. Молекула құрамында карбонил немесе оксо топшасы бар көмірсутек туындыларын альдегидтер және кетондар деп атайды.

Кетондар - құрамында екі көмірсутек радикалымен байланысқан карбонил тобы >C=O бар органикалық қосылыстар класы. Жалпы формуласы RCOR^1. Кетондар алифатты, алициклді, ароматты немесе гетероциклді қатарларға бөлінеді. Алифатты қатардағы ең қарапайым кетондар - ацетон CH3COCH3, ароматты қатарда - бензофенон C6H5COC6H5. Кетондар органикалық еріткіштерде жақсы ериді.


Кетонның химиялық касиеттері

Физикалық қасиеттері.
Ең қарапайым альдегид ол кұмырска альдегиді-өткір иісті газ. Метанальдің 35 - 40%-тік судағы ерітіндісі формалин деп аталады. Ол өте улы. Қалғандары сұйык, ал жоғары молекулалы қосылыстары - қатты заттар. Карбонилді косылыстардың қайнау температуралары сәйкес біріншілік және екіншілік спирттерден төмен болады. Мысалы, пропанол 97°С-та, ал ацетон 56°С-та кайнайды.
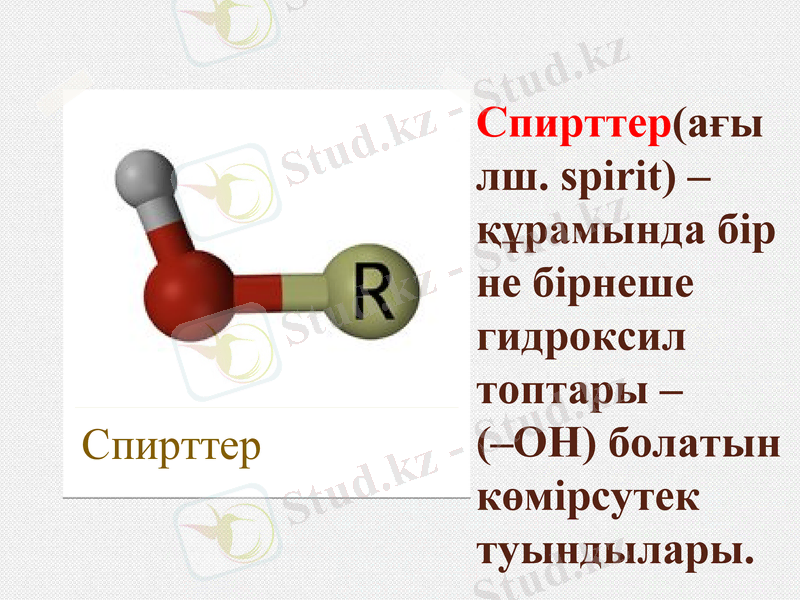
Спирттер(ағылш. spіrіt) - құрамында бір не бірнеше гидроксил топтары - (-ОН) болатын көмірсутек туындылары.
Спирттер

Химиялық қасиеттері.
Спирттердің химиялық қасиеттерін анықтайтын гидроксил тобы және ол байланысқан радикалдардың құрылысы. Гидроксил тобы қатысында өтетін реакциялар О-Н немесе С-ОН байланыстарын үзу арқылы жүреді. Спирттер (алканолдар) полюсті косылыстар, көміртек пен оттек және оттек пен сутек атомдарының арасында екі полюсті байланысы бар: С -» О жәнө 0 <- Н . О <- Н байланысының полюстігі С -> О байланысының полюстігіне қарағанда жоғары. Оттектің жұп электрондары спирттерге электрондонорлық қасиет береді.


Күрделі эфирлер
R мен R' - бірдей немесе әр түрлі көмірсутек радикалдары.
Күрделі эфирлер кіші және үлкен молекулалы, қаныққан, қанықпаған, ароматты қышқылдар мен спирттерден түзілуі мүмкін. Күрделі эфирлерді спирттер мен бейорганикалық қышқылдарды әрекеттестіріп те алады.


Алу әдістері
1. Күрделі эфирлер көбіне табиғи өнімдерден алынады.
2. Этерификация реакциясында карбон қышқылдары мен спирттерді минерал қышқылдар қатысында әрекеттестіріп, нәтижесінде, күрделі эфир мен су түзіледі. Эфирлену реакциясы кезінде карбоксил тобының гидроксилі мен спирт молекуласындағы сутектен су молекуласы түзілетіні реакцияға изотоптар енгізу арқылы анықталды.
Химиялық қасиеттері


Дәрумен - адам мен жануарлардың тіршілігіне, олардың ағзасындағы зат алмасудың бірқалыпты болуы үшін аз мөлшерде өте қажетті биологиялық активті органикалық қоспалар. Дәрумен (латынша vіta - тіршілік және амин) туралы ілімнің негізін 1880 жылы орыс дәрігері Николай Лунин салды. 1912 жылы поляк дәрігері Казимеж Функ сол кезге дейін жасалған тәжірибелер нәтижесін қорытындылап, ғылымға дәрумен терминін енгізді.
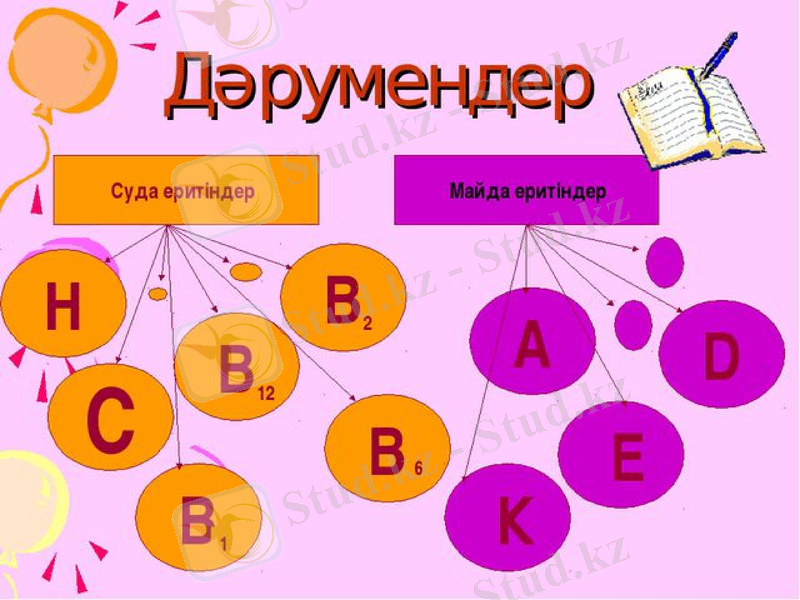


С дәрумені - Аскорбин қышқылы
С дәрумені балғын жемістерде, әсіресе цитрусты жемістерде және көккөністерде кездеседі. С дәрумені коллагеннің түзілуі үшін қажет және тері мен қоысылс тінінің, сүйектердің, қан тамырларының және дентиннің тұтастығын сақтауға көмектеседі. Ол жараның бітуі үшін қажет және күйіктен кейін қалыпқа келуге септігін тигізеді. Сондай-ақ, темірді және құрамында темір бар кейбір заттарды сіңіруге ықпал етеді.

А дәрумені көру үшін қажетті болып табылады, және ретин қышқылына түрленген кезде, терінің денсаулығы мен сүйектің өсуі үшін қажет болып табылады. А дәруменінің тапшылығы әлемнің кедей жерлерінде көптеп кездеседі және ақшам соқырлықты, инфекцияларға деген жоғары бейімділікті, әсіресе қызылша мен диареяны тудырады. А дәрумені сары немесе қызыл жемістер мен көкөністерде, әсіресе сәбізде (каротин) кездеседі.

Д дәрумені - Кальциферол
Д дәруменінің тапшылығы балаларда мешелді, ал ересектерде - сүйек жұмсаруын тудырады. Д дәруменінің қайнар көзі - күн сәулесі әсер еткен тері. Теріде Д дәруменінің тапшылығы күн сәулесі аз түсетін климатта тұратын, және күндізгі уақытта орынжайда қалып, жұмыс істейтін адамдарда кездесуі мүмкін. Өнімдердің көбінің құрамында Д дәрумені жоқ, немесе балық майын қоспағанда, тым көп мөлшері бар. Дегенмен де, маргарин, кейбір жармалар, және балаларға арналған сүт қоспалары тәрізді кейбір өнімдер Д дәруменімен байытылады.
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz