Фосфор және оның қосылыстары: құрылымы, физика-химиялық қасиеттері, алынуы және қолданылуы



Тақырып:Фосфор және оның қосылыстары.

Жоспар: 1. Фосфордың жалпы сипаттамасы. 2. Фосфордың физикалық және химиялық қасиеті. 3. Фосфорды алу және қолдану. 4. Фосфорлық тыңайтқыштар.

Фосфор (лат. Phosphorus), P - элементтердің периодтық жүйесінің V тобындағы химиялық элемент, реттік нөмірі - 15, атомдық массасы 30, 97. Бірнеше түрі бар:
ақ фосфор - тығыздығы 1, 828 г/см3;
балқу температурасы - 44, 14°С;
қызыл фосфор - тығыздығы 2, 31 г/см3;
балқу температурасы - 593°С.
Химиялық элементтердің периодтық жүйесінде фосфор III периодта, V топтың негізгі топшасында орналасқан. Салыстырмалы атомдық массасы 31, реттік нөмірі (ядро заряды) 15.

Тарихы.
Фосфорды 1669 неміс неміс алхимигі Х. Бранд ашқан(химия тарихында элемент ашылуының алғашқы белгіленуі) . Бранд құм мен көмір араласқан зәрдің құрғақ қалдығын күйдіргенде, қараңғыда жарықтнатын ақ ұнтақ алған(фосфоресценция құбылысы), нәтижесінде ол ақ фосфорды ашқан.

Атом құрылысы.
Фосфордың соңғы энергетикалық қабатында бес электрон бар, оның үшеуі жұптаспаған. Фосфор атомындағы электрондардың орналасуы:
Электрондық формуласы:
1s22s22р63s23f
Фосфор косылыстарында -3, +3, +5 тотығу дәрежесін көрсетеді.
Фосфордың ұшқыш сутектікетеді. қосылысы фосфин РН3 мен аммиак NH3 молекулалары формасы жағынан ұқсас болғанмен, фосфин молекуласы берік емес, улы, тұрақсыз газ, тез тотығып

Физикалық қасиеттері.
Фосфор элементі жай зат ретінде бірнеше аллотропиялық түр өзгерісін түзеді. Оның маңыздылары - ақ және қызыл фосфор. Ақ фосфор улы жөне тез тұтанатын болғандықтан аса ұқыптылықты қажет етеді. Оның буымен демалуға болмайды. Ақ фосфорды шыны ыдыста, су астында, сыртынан құм салынған металл банкаға орналастырып сақтайды. Ақ фосфор ауасыз кеңістікте қыздырғанда қызыл фосфорға, ал жоғары қысымда қара фосфорға айналады. Қара фосфор аз кездеседі.

Химиялық қасиеттері.
Фосфор тотыктырғыш (азоттан темен) және тотықсыздандырғыш қасиет көрсетеді.
Тотыксыздандырғыш ретінде оттекпен және белсенді бейметалдармен реакцияға түседі.
Фосфор оттекте жанып, пентаоксид түзеді.
Фосфордың металлдармен әрекеттесуі фосфидтердің түзілуіне әкеледі, мысалы Mg3P2 және Na3P. Оларды фосфордың сутектік қосылыстары фосфиннің PH3 туындылары деп есептеуге болады. Фосфинде және фосфоридтерде фосфордың тотығу дәрежесі -III. Фосфоридтер қайтымсызгидролизге ұшырайды.
Mg3P2+6H2O=2PH3+3Mg(OH) 2
Фосфин және фосфидтер күшті тотықсыздандырғыштар:
PH3+2O2=H3PO4
Na3P+10HNO3(конц) =NaH2PO4+8NO2+4H2O+2NaNO3

Ақ фосфор
Қызыл фосфор
Ақ түсті кристалл зат, тығыздығы 1, 83 г/см3.
Қараңғыда жарқырайды.
Кәдімгі жағдайда 30 - 40°С температурада ауадағы оттекпен тотығады.
От алғыш кауіптілігіне байланысты су астында сақтайды.
Суда ерімейді, күкірткөміртекте ериді.
Өте қауіпті, улы!
44°С-та балқиды, 280°С-та қайнайды
Аморфты зат, кристалды емес, тығыздығы 2, 20 г/см3.
Қараңғыда жарқырамайды.
Ауада оттекпен 260°С-та тотығады.
Отқа қауіпті емес. Қыздырғанда оталады.
Суда да, күкірткөміртекте де ерімейді.
Улы емес.
400°С-та балқиды.

Фосфордың негізгі қызметтері:
Газдық қызмет: фотосинтезге және азоттұрақтандыру нәтижесінде газдардың биогендік орын ауыструы.
Концентрациялық қызмет:тірі ағзалардың сыртқы ортаға шашыраған химиялық элементтерді жинауы.
Тотығу-тотықсыздандыру қызмтеті: заттар күйінің өзгеруі.
Биохимиялық қызмет: сан алуан заттардың ағзаларындағы күрделірек өзгерістер жасайды
Егістікте тыңайтқыш ретінде қолданылады.

Қолданылуы
Қызыл фосфор сіріңке өндірісінде, пиротехникада және фосфор кышкылын алуға пайдаланылады. Фосфор ауыл- шаруашылык зиянкестерімен күресу үшін кажет улы химикаттар алу үшін қолданылады.
Фосфордың ақ және қызыл түрөзгерісі бар. Ақ фосфор химиялық белсенді болып келеді. Сондықтан ақ фосфорды қараңғыда су астында сақтайды. Ақ фосфорды ауасыз ортада қыздырса, қызыл фосфор алынады. Қызыл фосфор сіріңке өндіруде, пиротехникада қолданылады. Фосфор жай және күрделі заттармен өрекеттеседі. Қазақстанда фосфор шикізатының қоры Жамбыл (Қаратау) және Ақтөбе (Шилісай) облыстарында бар.
Фосфор сіріңке және улы химикаттар өндірісінде пайдаланылады.
Ақ, қызыл фосфор Н3РО4 алуда, жанғыш қоспалар дайындау үшін қолданылады.
P+5HNО3конц = Н3РО4+5NО2↑ +Н2О

ФОСФОР ҚЫШҚЫЛЫ ҚОЛДАНЫЛАДЫ.
ТЫҢАЙТҚЫШТАР ӨНДІРУДЕ
АЛКОГОЛЬСІЗ СУСЫНДАР
НАН ПІСІРУДЕ
ДӘРІ ЖАСАУДА
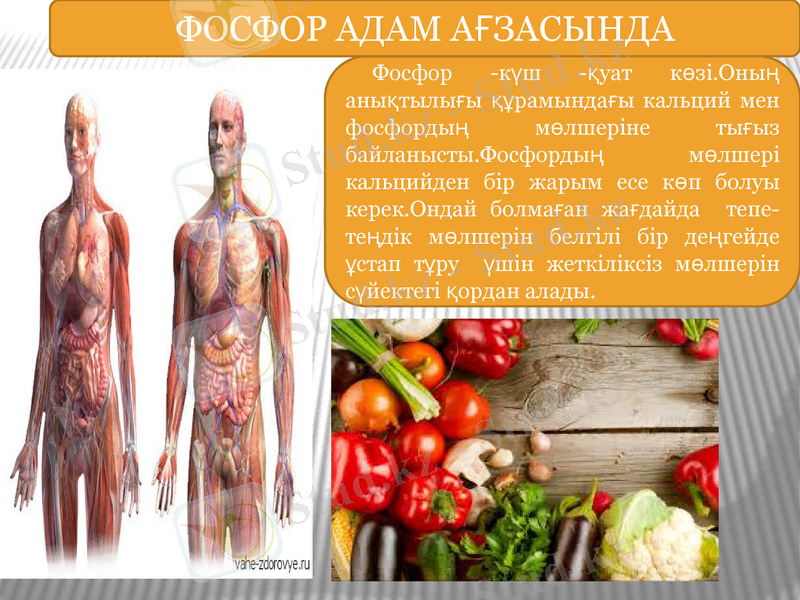
Фосфор -күш -қуат көзі. Оның анықтылығы құрамындағы кальций мен фосфордың мөлшеріне тығыз байланысты. Фосфордың мөлшері кальцийден бір жарым есе көп болуы керек. Ондай болмаған жағдайда тепе- теңдік мөлшерін белгілі бір деңгейде ұстап тұру үшін жеткіліксіз мөлшерін сүйектегі қордан алады.
ФОСФОР АДАМ АҒЗАСЫНДА

Алынуы:Бос күйіндегі фосфорды алу үшін табиғи фосфатты электр пеште кремний (IV) оксиді мен көмірді косып қыздырады. Бөлінген фосфордың буын су астында ақ фосфор Р түрінде бөліп алады. Реакция теңдеуі:
Са3(РО4) 2+ 3SiО2 + 5С = 3CaSiО3+ 5CО↑ + 2Р
Фосфор буын суытып, қатты ақ фосфоралады. Қызыл
фосфорды ақ фосфордан алады, полимерлену
дәрежесі n(Pn) әр түрлі болуы мүмкін. Өнеркәсіпте
фосфорды фосфор қышқылынан алуға
қолданылады, органикалық синтездерде, құймаларды
қышқылсыздандыруға, қыздырғыш шамдарды
толтыруға, тұтатқыш құралды және шырпылар басын
жасауда қолданылады.

- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz