Химиялық байланыс: теориялары мен негізгі түрлері




Химиялық байланыс дегеніміз молекулаларда және кристалдық торларда атомдар арасындағы электрлік тартылыс күштерінің әсерінен атомдардың өзара тартылып байланысуы.

Бірінші рет электронды бұлттың құрылысын түсіндірген Бор жасаған атом моделінің пайда болуы химиялық байланыс және оның электронды құрылысы туралы түсініктің қалыптасуына әсер етті. Бор моделі бойынша электрондар атомда белгілі бір энергетикалық күйде, яғни энергетикалық деңгейде болады.
1915 жылы неміс физигі Коссель тұздардағы химиялық байланысқа түсінік берді
.
1916 жылы американ ғалымы Льюис молекулалардағы химиялық байланысқа анықтама берді
Коссель мен Льюис түсініктері валенттіліктің электрондық теориясы деген ат алды.

Химиялық
байланыс
Байланысатын атомдар
Элементтер
қасиеттері
Электронды бұлттағы
үрдіс
Түзілетін
бөлшектер
Кристаллдық
тор
Заттардың
қасиеттері
Мысалдар
Иондық
Металл атомы және бейметалл
атомы
Оң және теріс зарядты
Валентті электрондардың ауысуы
Оң және теріс зарядты иондар
Иондық
Тұз түзетіндер
NaCl
CaO
NaOH
Ковалентті
Бейметалл
атомдары
(сирек жағдайда-металл атомдары)
Теріс зарядты, сирек жағдайда оң зарядты
Ортақ электрон жұбын түзу, молекулалық орбиталдарды толтыру
Молекулалар
Молекулалық
Ұшқыш және
Ұшқыш емес
Br2
CO2
C6H6
Атомдық
Алмазтәрізділер
Алмаз
Si SiC
Металлдық
Металл атомдары
Оң зарядты
Валентті электрондарын беру
Оң зарядты иондар және электронды газ
Металдық
Металдық
Металдар
және
құймалар
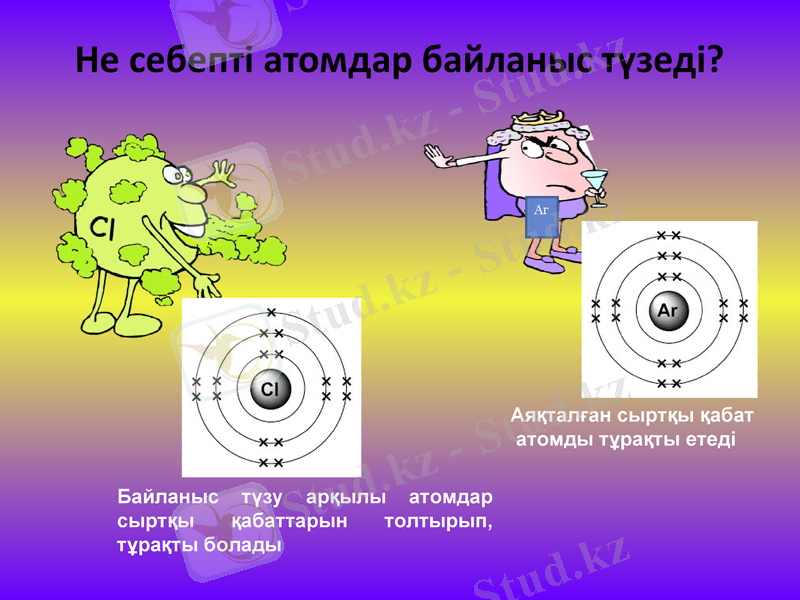
Аяқталған сыртқы қабат
атомды тұрақты етеді
Ar
Байланыс түзу арқылы атомдар сыртқы қабаттарын толтырып, тұрақты болады
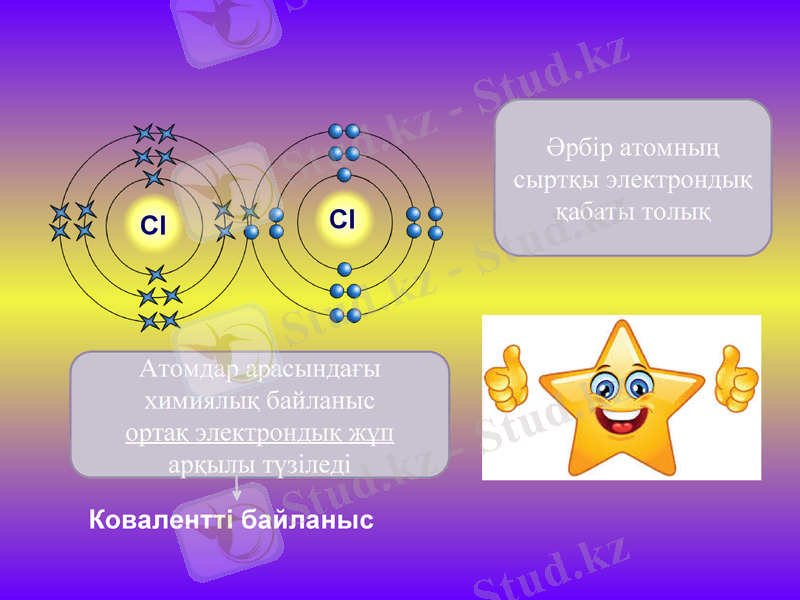
Атомдар арасындағы химиялық байланыс ортақ электрондық жұп арқылы түзіледі
Әрбір атомның сыртқы электрондық қабаты толық
Cl
Cl
Ковалентті байланыс
Notes: Deconstruction:
Students copy down diagram


Екі атом арасында химиялық байланыс электрон жұбы ортақтасуы арқылы түзілсе, ол ковалентті байланыс деп аталады.

∙∙ ∙∙
∙H + ∙Cl ∙∙ → H ∙∙Cl∙∙
∙∙ ∙∙
Полюсті молекуладағы электрондар ығысқан кезде атомдар қосымша зарядқа ие бола бастайды. Молекуланың бір жағы оң, бір жағы теріс зарядталады. Мұндай молекулалар полюсті деп аталады. Коваленттік полюсті байланыс көбіне қышқылдар арасында болады. Мысалы HF, H2S, HNO3, H2SO4, т. с. с


бейМе
бейМе
Ковалентті полюссіз байланыс
бейМе
бейМе
бейМе
Ковалентті полюсті байланыс
Ме
Ионды байланыс
?
?
?
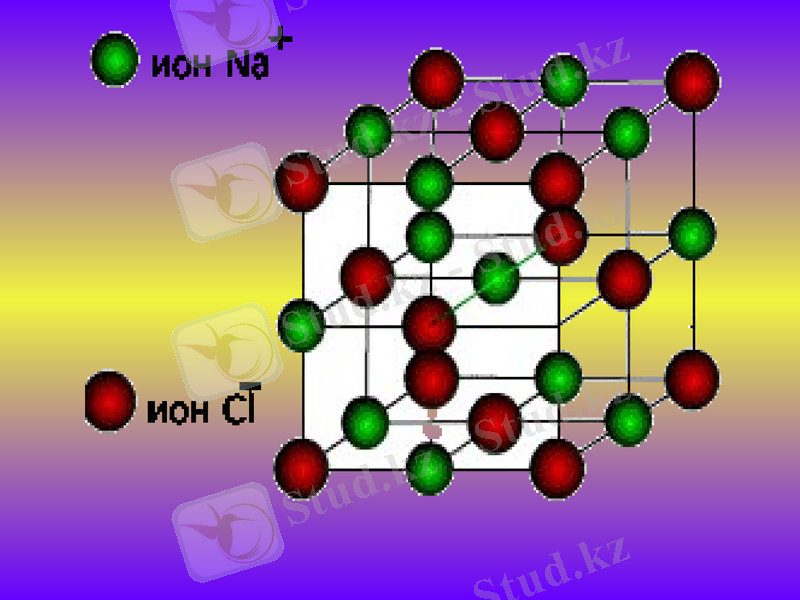
Ионды байланыс - бұл иондар арасындағы байланыс.
Металдар мен бейметалдар арасында түзіледі.
ИОНДЫҚ БАЙЛАНЫС
Notes: Автор Гальцева Ольга Николаевна. Учитель МОУ Аннинская СОШ №1 п. г. т. Анна Воронежской области

Ион - бұл электрон беру немесе алу нәтижесінде түзілетін зарядталған бөлшек.
Мысалы:
NaCl - натрий хлориді (ас тұзы)
+
1e
Notes: Использован слайд из презентации Баженова А. А. «Ионы и ионная связь» в исправленном виде http://www. alekseibazhenov. narod. ru/proektor8chem. html

Электрондарын беретін бөлшек
оң ионға айналады (катион)
Электрондарын қосып алған бөлшек
теріс ионға (анион) айналады.
Notes: Использован слайд из презентации Баженова А. А. «Ионы и ионная связь» в исправленном виде http://www. alekseibazhenov. narod. ru/proektor8chem. html

Na0 + F 0 → Na + F-
Na0 + Cl02 → Na+ + Cl -
K 0 + Cl20 → K +Cl-
Zn0 + S0 → Zn +S-
Қарама-қарсы зарядталған иондар арасындағы байланысты иондық байланыс деп атайды. 1916 жылы неміс ғалымы Коссель ұсынды. Өзінің сыртқы валенттік электрондарына сай электрон бұлтын берген атомдар оң зарядты катиондарға, ал осы электрондарға сай бұлтты қосып алған атомдар теріс зарядты анионындарға айналады. Түзілген иондар біріне-бірі Кулон заңы бойынша тартылысып иондық байланыс түзіледі
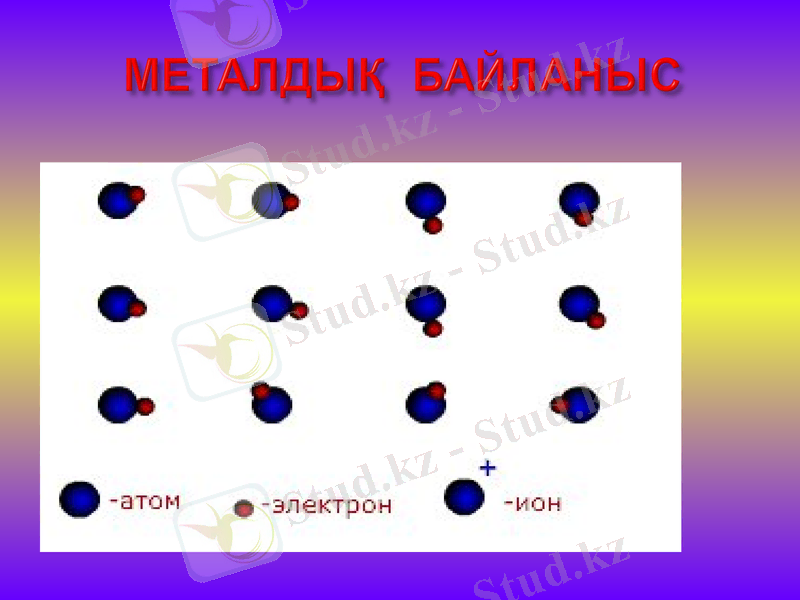

Металдар мен олардың балқымалары металдық тор түрінде кристалданады. Металдық тор түйінінде оң зарядты металл иондары орналасады. Металл атомдарынан және кристалдық тор түйінінде қалған иондардан алыстаған электрондар катиондар арасында біршама еркін қозғалуға мүмкіндік алады. Осылайша металдардың электр өткізгіштігін қамтамасыз етеді. Иондар мен бос электрондардың арасында электростатикалық әсерлесу пайда болады да, металдық байланыстың түзілуіне себеп болады.

Сутектік байланыстар - бір молекуладағы сутегі атомдары мен екінші молекуладағы электртерістілігі күшті элементтер (O, N, F) арасындағы байланыс.
Молекулааралық сутектік байланыстарға мысалдар:
… О - Н + … О - Н + …
H + H + вода
… О - Н + … О - Н + …
+
С2H5 + С2H5 этил спирті

Байланыстың түзілу механизмі :
Бір молекуланың протоны екінші молекуладағы атомның бөлінбеген электрон жұбына тартылады.
Мысалы :
F, O, N (сирек жағдайда Cl және S) сутекті қосылыстары, спирт. Нәруыздар, нуклеин қышқылдары және басқалар.

- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz