Электролиз арқылы мыс сульфатынан мыс алу және радиоэлектрондық қалдықтардан бағалы металдарды бөліп алу


Қазақстан республикасы Алматы облысы
Еңбекшіқазақ аудандық білім бөлімінің
«Рахат ауылдық округі №1 орта мектебі»
коммуналдық мемлекеттік мекемесі
Ғылыми жоба:
«Мыс купросынан
Мыс алу процессін зерттеу және оны радиоқалдықтардан бағалы металдарды бөліп алу үшін пайдалану »
Дайындаған: 9«A» сынып оқушысы Исқақбай Бексұлтан Мұхтарұлы
8«Б» сыынып оқушысы
Бақатай Жанель Ерқанатқызы
Ғылыми жетекшісі: химия ғылымдарының магистірі, химия пәнінің мұғалімі Нұртай Ерназар
2017-20178оқу жылы

Зерттеу мақсаты:
Электролиз жүргізуге арналған, қарапайым әрі қолайлы құрылғы құрастыру.
Оны практикада пайдаланып, мыс купросынан мысты алу процесі кезіндегі РН мәні мен концентрацияның өзгерісін зерттеу . Электролиз процесін зерттеу арқылы, Электролиз әдісін басқа әдістермен қоса пайдаланып, радиодеталдардан алтын, күміс, платина секілді бағалы металдарды бөліп алу. бағалы металдарды ескі электротехникалық құрылғылардың қалдығынан бөлу .
Ғылыми болжамы: Мыс купросынан судағы ертіндісінің РН мәні бірқалыпты азаяды, ерітіндідегі мыс иондарының концентрациясының артқан сайын шығым уақытқа байланысты бір қалыпты өзгереді. Радиоэлектронды қалдықтардан бағалы металдарды бөліп алуға болады.
Зерттеу жаңашылдығы: Электролиз арқылы мысты бөліп алғанда, ортаның РН пен концентрацияның мәнін бақылап отыру және алған білімді практикада қолдана біліп алтынды Радиоэлектронды қалдықтардан электролиз әдісімен бөліп алу.
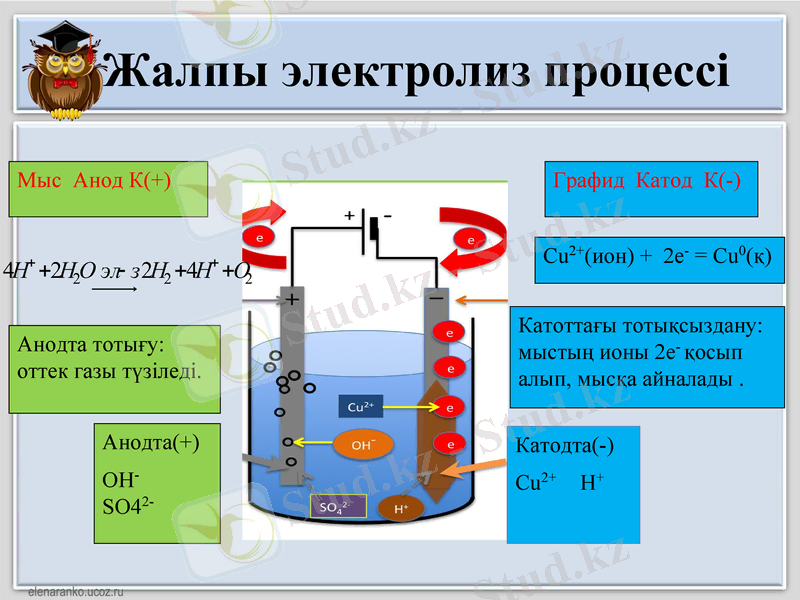
Жалпы электролиз процессі
Катодта(-)
Сu2+ Н+
Анодта(+)
ОН- SO42-
Катоттағы тотықсыздану: мыстың ионы 2е- қосып алып, мысқа айналады .
Графид Катод К(-)
Сu2+(ион) + 2e- = Cu0(қ)
Мыс Анод К(+)
Анодта тотығу: оттек газы түзіледі.

Біздің құрастырған құрылғымыз

Мыс купросының; 1) 0, 1м 2) 0, 2м 3) 0, 3м 4) 0, 4м ертінділерін дайындадық . CM = n / V катодпен анодты өлшеп, құрылғыны құрастырдық.

Электролит ерітінділерді дайындап, электроттарды орналастыра отырып
электролизды уақытпен бірге бастаймыз.
Электродтар
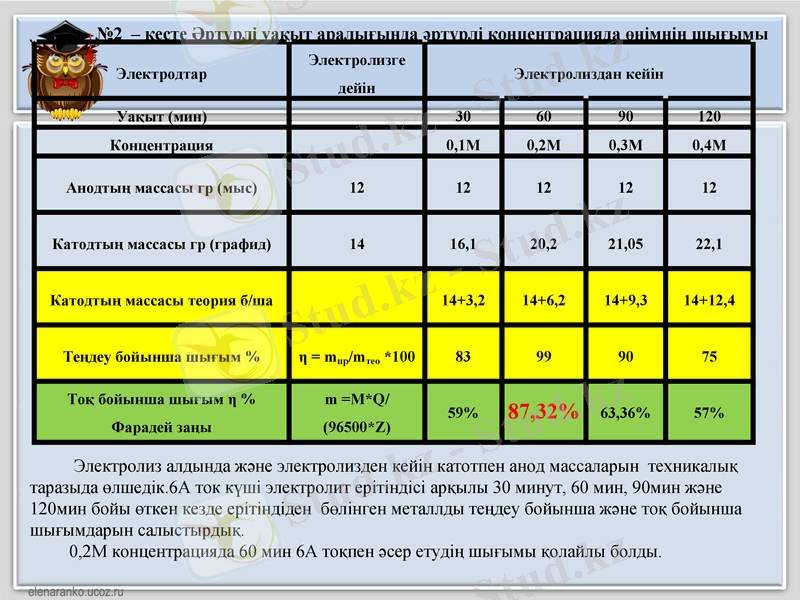
Электролизге дейін
Электролиздан кейін
Уақыт (мин)
30
60
90
120
Концентрация
0, 1М
0, 2М
0, 3М
0, 4М
Анодтың массасы гр (мыс)
12
12
12
12
12
Катодтың массасы гр (графид)
14
16, 1
20, 2
21, 05
22, 1
Катодтың массасы теория б/ша
14+3, 2
14+6, 2
14+9, 3
14+12, 4
Теңдеу бойынша шығым %
η = mпр/mтео *100
83
99
90
75
Тоқ бойынша шығым η %
Фарадей заңы
m =M*Q/ (96500*Z)
59%
87, 32%
63, 36%
57%
№2 - кесте Әртүрлі уақыт аралығында әртүрлі концентрацияда өнімнің шығымы
Электролиз алдында және электролизден кейін катотпен анод массаларын техникалық таразыда өлшедік. 6А ток күші электролит ерітіндісі арқылы 30 минут, 60 мин, 90мин және 120мин бойы өткен кезде ерітіндіден бөлінген металлды теңдеу бойынша және тоқ бойынша шығымдарын салыстырдық.
0, 2М концентрацияда 60 мин 6А тоқпен әсер етудің шығымы қолайлы болды.
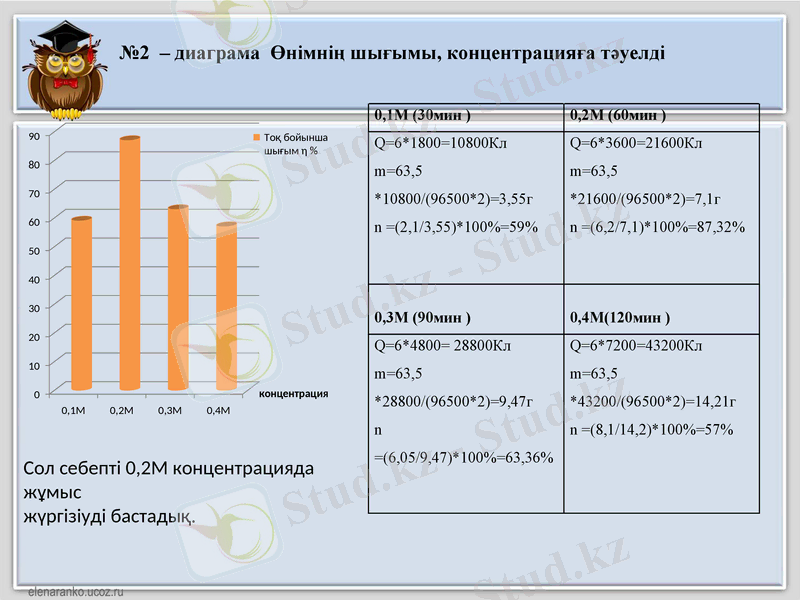
№2 - диаграма Өнімнің шығымы, концентрацияға тәуелді
Сол себепті 0, 2М концентрацияда жұмыс
жүргізіуді бастадық.
0, 1М (30мин )
0, 2М (60мин )
Q=6*1800=10800Кл
m=63, 5 *10800/(96500*2) =3, 55г
n =(2, 1/3, 55) *100%=59%
Q=6*3600=21600Кл
m=63, 5 *21600/(96500*2) =7, 1г
n =(6, 2/7, 1) *100%=87, 32%
0, 3М (90мин )
0, 4М(120мин )
Q=6*4800= 28800Кл
m=63, 5 *28800/(96500*2) =9, 47г
n =(6, 05/9, 47) *100%=63, 36%
Q=6*7200=43200Кл
m=63, 5 *43200/(96500*2) =14, 21г
n =(8, 1/14, 2) *100%=57%

GLX құрылғысының РН датчигінің көмегімен ерітіндінің РН мәндерін уақытқа байланысты өлшейміз, әрі дәптерге жазып отырамыз.
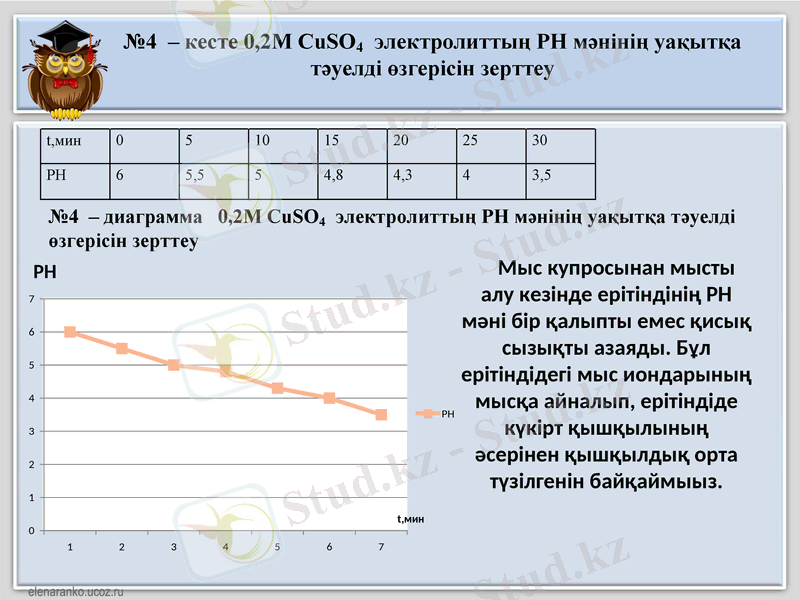
№4 - кесте 0, 2М СuSO4 электролиттың РН мәнінің уақытқа тәуелді өзгерісін зерттеу
t, мин
0
5
10
15
20
25
30
РН
6
5, 5
5
4, 8
4, 3
4
3, 5
№4 - диаграмма 0, 2М СuSO4 электролиттың РН мәнінің уақытқа тәуелді өзгерісін зерттеу
Мыс купросынан мысты алу кезінде ерітіндінің РН мәні бір қалыпты емес қисық сызықты азаяды. Бұл ерітіндідегі мыс иондарының мысқа айналып, ерітіндіде күкірт қышқылының әсерінен қышқылдық орта түзілгенін байқаймыыз.

Сулы ерітіндіде СuSO4 төмендегідей диссоцияланады:
CuSO4 ↔ Cu(2+) + SO4(2-) катотқа қарай мыстың катиондары жылжып, 2е- қабылдап алады да мыс тотықсызданады. Анодқа қарай аниондар жылжиды да сульфат-анион және судың ОН- ионы жылжып, ОН- ионы оттекті береді де, ертіндіде H+, SO42- иондары қалып қышқылдық ортаны тудырады, және бұл электролиз барысында артады. катодта төмендегідей процесс орын алады: катод (-) анод (+) Cu(2+) + 2ē → Cu(0) 2H2O - 4ē → 4H(+) + O2 ↑ ертіндіде : H+, SO42- а ) Графит анод А(+) : 2 H2O - 4e ---> 4 H+ + O2 1 - тотығу К(-) : Сu2+ + 2e ---> Cu0 2 - тотықсыздану 2CuSO4 + 2H2O = 2Cu + O2 ↑ + 2H2SO4 Егер анод ретінде мысты алсақ реакция нәтіижесінде катодта тек мыс түзіледі де, анод ериді.

Тамсырмалар:
Электрнды аспаптардың қандай бөлшектерінде бағалы металдар кздесетінін анықтау.
Бағалы металдарды радиоломна электролиз әдісін пайдаланып ертіндіге өткізу.
Ертіндіні тұндыру, бөліу, еріту арқылы бағалы металдарды бөліп алу.
Зерттеу жұмысының екінші бөлімінде:

Айналамызда осындай керексіз болып істен шыққан электротехникалар өте көп, Әрі олар жылдан жылға арта түсуде.
Олар уақыт өте келе ортаға зиянды қалдықтар бөліп, ауаны, экологяалық ортаны ластайды.

Экологиялық ортамен қоса адам денсаулығына аса зиян улы заттар бөлініп шығады.

Бағалы металдар радиодеталдың қандай бөлшектерінде кездеседі?
Қазіргі кезде жаңа технологияның дамуы бағалы металдарға деген сұраныс арта түсіуде, кеннен өңдеу азайып, сұранысты толық қамтамасыз ете алмай отыр. Сондықтан осы қалдықтарды, оның ішінде алтын, күміс, платина, мольбиден, тағы басқа бағалы металдарды қайта өңдеу алдеқайда тиімді. Радиодеталда, микросхем, разъем, транзисор, сағатта, компютердің платаларында, Радиолампаларда алтын, күміс, және оданда басқа платина тантал, тб бағалы металдар бар.

Механикалық жолмен радиоқалдықтарды бөліп, пластмассалармен, әйнектерден, керамикалардан бөліп тастаймыз.

Электролизге дейін және кейін

Тұзқышқылының 0, 1М ертіндісін дайындап азот қышқылының бірнеше тамшысы тамызамызып патышы сұйықтығын дайындаймыз. электролиз жүргізуге дайындадық.
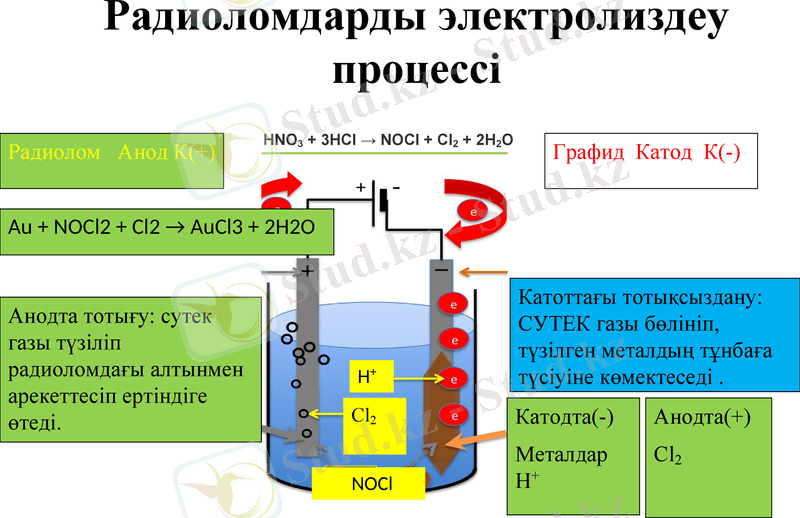
Радиоломдарды электролиздеу процессі
Катодта(-)
Металдар Н+
Анодта(+)
Сl2
Катоттағы тотықсыздану: СУТЕК газы бөлініп, түзілген металдың тұнбаға түсіуіне көмектеседі .
Графид Катод К(-)
Au + NOCl2 + Cl2 → AuCl3 + 2H2O
Радиолом Анод К(+)
Анодта тотығу: сутек газы түзіліп радиоломдағы алтынмен арекеттесіп ертіндіге өтеді.
HNO3 + 3HCl → NOCl + Cl2 + 2H2O
Н+
Сl2
NOCl

Химиялық реакцияның барысы : дайыындалғн патыша сұйықтығында (1 үлес азот қышқылымен үш үлес тұз қышқылының ) азот қышқылы тұз қышқылын тотықтырып нәтіижесінде бөлінген хлор металдарды оның ішінде алтындыда тотықсыздандырады ; HNO3 + 3HCl → NOCl + Cl2 + 2H2O Нитрозилхлорид пен хлор екі активті компенентке электролиз процесінде бөлінген хлорда өте зор асер етіп нәтіижесінде рекцияның жүруі тездейдіде алтын ертіндіге өте бастайды : НСl = H+ + Cl- (электролиз кезінде ) = H2 ↑+Cl2 ↑ Au + NOCl2 + Cl2 → AuCl3 + 2H2O реакция кезінде электролиз әсерінен ертіндінің температурасы көтеріледі температура керек емес, тек электролитты араластырып отыру жеткілікті. Хлордың жеткілікті мөлшерімен алтынның(III) хлориді тетрахлоралтынд түзеді. AuCl3 + HCl → H(AuCl4) нәтіижесінде ұсақ алтынның ұнтақтары пайда болады . Соңында ертіндіге өткен алтынның тетрахлоридін сутегі асқын тотығымен өңдеп, тотықтырып буландырамызда температурасын 50-60 С0-та үстіне SnCl2 және FeSO4 пен тұнбаға түсіреміз, қалған ертіндіны сүзіп тазалап, балқытқанда таза алтынның өзі қалады 2AuCl4 + 3H2O2 → 2Au + 8Cl + 6H2 + 3O2 3 SnCl2 + 2 AuCl3 = 2 Au + 3 SnCl4

Министерства образования и науки Республики Казахстан
Казахский национальный университет имени аль-Фараби
Центр физико-химических методов исследования и анализа
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz