Органикалық молекуладағы атомдардың өзара әсері: индуктивті және мезомерлік эффектілер, электрондық донорлық және акцепторлық орынбасарлар



Южно-Казахстанская Медицинская Академия
Оңтүстік Қазақстан Медициналық Академиясы
Химиялық пәндер кафедрасы
Презентация
Тақырыбы: Органикалық қосылыстардың молекуласындағы атомдардың өзара әсері. Индуктивті эффект, қосарлану эффектісі туралы түсінік. Электрондонорлы және электронакцепторлы орынбасарлар.

Жоспар
Кіріспе
Негізгі бөлім
Органикалық қосылыстардың молекуласындағы атомдардың өзара әсері
Индуктивті және қосарлану эффектілері
Электродонорлы және электроакцепторлы орынбасарлар
Қорытынды
Пайдаланылған әдебиеттер

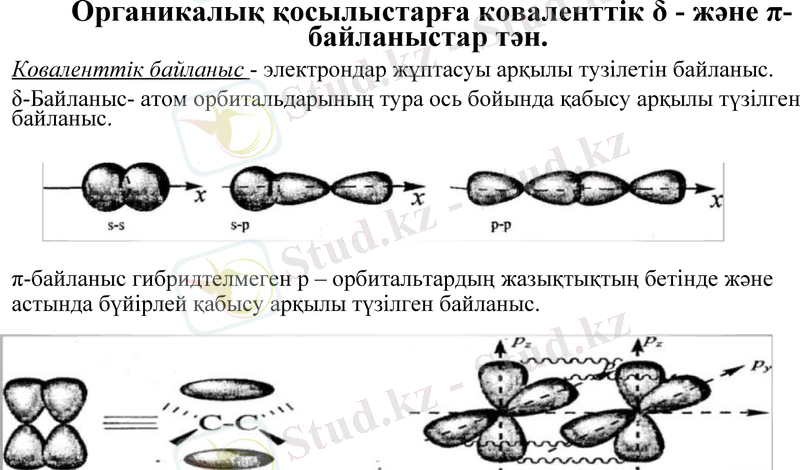
Органикалық қосылыстарға коваленттік δ - және π-байланыстар тән.
Коваленттік байланыс - электрондар жұптасуы арқылы тузілетін байланыс.
δ-Байланыс- атом орбитальдарының тура ось бойында қабысу арқылы түзілген байланыс.
π-байланыс гибридтелмеген p - орбитальтардың жазықтықтың бетінде және астында бүйірлей қабысу арқылы түзілген байланыс.

Ковалентті байланысты сипаттайтын көрсеткіштер:
Байланыс энергиясы-өзара байланысқан екі атомның түзілуіне немесе үзілуіне қажет энергия. Атомдар арасында байланыс түзілгенде неғұрлым энергия көп бөлінсе, соғұрлым байланыс мықты болады.
Байланыс ұзындығы- байланысқан атомдар орталықтарының арасындағы қашықтық.
Валенттік бұрышы- ортақ атомнан тұратын екі байланыстың арасындағы бұрыш. Органикалық қосылыстардағы X-C-Y ядро аралық байланыстардың бұрышы көміртек атомының гибридтелуіне сәйкес, яғни sp3-, sp2-, және sp- гибридтік күйге сәйкес 109, 5; 120 және 180 тең болады.

Байланыс полюстілігі -электрон тығыздығының әркелкі таралуы.
Электртерістілік -молекуладағы атомның химиялық байланысқа қатысатын валенттік электрондарды өзіне тарту қабілеті (күші) .
Ығысудың электрондық теориясы. Бұл теорияның екі мәні электрондық әсері жайлы мазмұндалған ілімде болатын: индуктивті және мезомерлі.
Оның біріншісін -индуктивті әсер арқылы таңбалайды және ол оң (+j) немесе теріс (-j) таңбалы болады. Индуктивті әсер (I- әсер) - орынбасарлардың электрондық әсерінің δ- байланыс бойында таралуы. Индуктифті әсер кейбір элементтердің Полинг (1932) шкаласы бойынша электртерістілігі әртүрлі атомдар арасындағы пайда болған байланыс полюсті болады.

Молекулада полюсті а- байланыстың болуы, көршілес екі-үш байланыстардың полюстігін өзгертеді де, көршілес атомдарда жартылай заряд (+5, 5”) пайда болады. 8+-электрон бұлтының жетіспеушілігін, ал 8” электрон бұлтының артқанын көрсетеді.
Индуктивті эффект - (I- эффект) орынбасарлардың электрондық әсерінің ст- байланыс бойында таралуы.
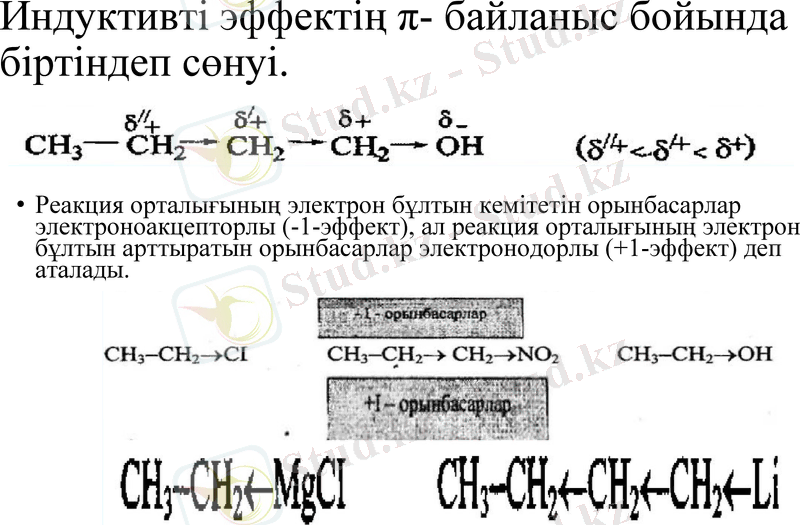
Индуктивті эффектің π- байланыс бойында біртіндеп сөнуі.
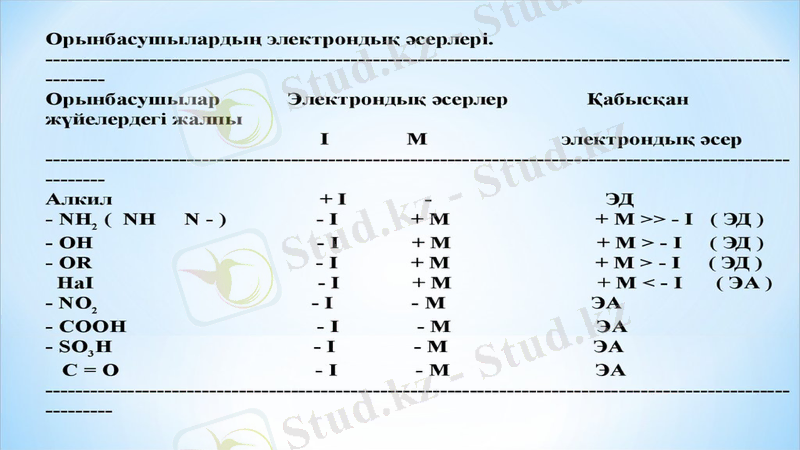
Реакция орталығының электрон бұлтын кемітетін орынбасарлар электроноакцепторлы (-1-эффект), ал реакция орталығының электрон бұлтын арттыратын орынбасарлар электронодорлы (+1-эффект) деп аталады.

Мезомерлі эффект немесе қабысу -орынбасарлардың электрондық әсерлерінің π-байланыс бойында таралуы.
π, π - қабысқан жүйе
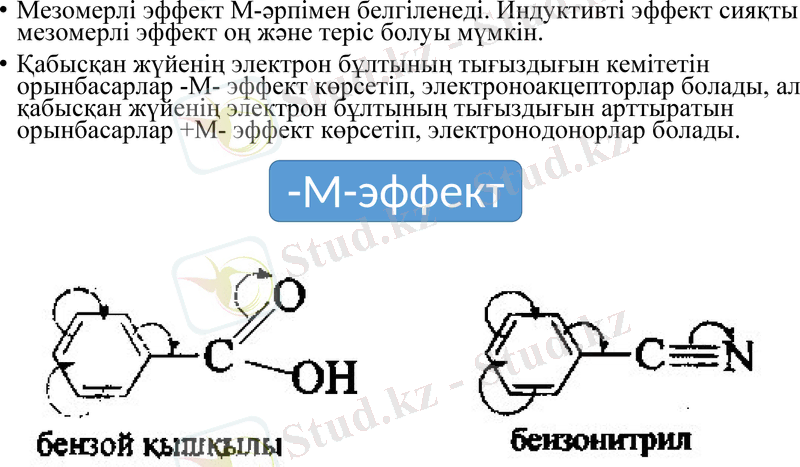
Мезомерлі эффект М-әрпімен белгіленеді. Индуктивті эффект сияқты мезомерлі эффект оң және теріс болуы мүмкін.
Қабысқан жүйенің электрон бұлтының тығыздығын кемітетін орынбасарлар -М- эффект көрсетіп, электроноакцепторлар болады, ал қабысқан жүйенің электрон бұлтының тығыздығын арттыратын орынбасарлар +М- эффект көрсетіп, электронодонорлар болады.
-М-эффект
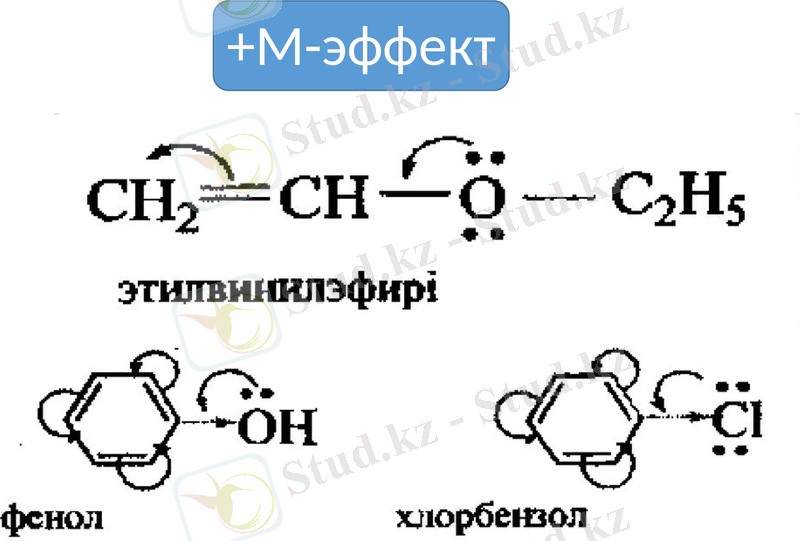
+М-эффект

Атомдардың өзара әсері.

Егер орынбасушы - байланыстардың электрондық тығыздығын, сутегімен салыстырғанда, өзіне қарай күштірек ығыстыратын болса, теріс индуктивтік әсер (-I) көрсетеді. Мұндай орынбасушыларға галогендер, OH, COOH, CHO, т. б жатады.
Егер орынбасушы тізбектегі электрон тығыздығын сутегімен салыстырғанда жоғарылататын болса, оң индуктивтік әсер (+I) көрсетеді. Мұндай әсерді алкилдік топтар жасайды.
Егер индуктивтік әсер электртерістілігі әртүрлі атомдары бар молекулаларда байқалатын болса, ал мезомерлік әсер үшін молекулада қабысқан бөлік болуы керек. Орынбасушылардың әсері - байланыстардың жүйесімен берілген болғандықтан, мезомерлік әсер қабысу әсері деп те аталады. Орынбасушының өзі қабысқан жүйені түзуге қатысады.



Қорытынды
Органикалық зат молекуласындағы атомдар ретсіз орналаспайды, олар өздерінің валенттіктеріне сай белгілі бір ретпен байланысады. А. М. Бутлеров молекуладағы атомдардың байланысу ретін заттың химиялық құрылысы деп атады.
Заттың қасиеті оның молекуласының құрамына, қандай атомдардың қанша мөлшерде кіретіндігіне тәуелді болуымен қатар молекуладағы атомдардың өзара байланысу ретіне де (яғни, химиялық құрылысына) тәуелді болады. Молекуладағы атомдардың байланысу реті көрсетілген химиялық формула, құрылымдық формула немесе құрылыс формуласы деп аталады. Зат молекуласының құрылысын осы заттың өзіне ғана тән жалғыз құрылымдық формуласы арқылы өрнектеуге болады.
Молекула құрамындағы атомдар мен атом топтары бір-бірінің химиялық қасиетіне әсер етеді. Бір-бірімен тікелей байланысқан атомдар мен атом топтарының өзара әсерлері күштірек болады.
Заттың қасиеті арқылы оның молекуласының құрылысын анықтауға және керісінше оның молекуласының химиялық құрылысы бойынша заттың қасиетін болжауға болады.

Пайдаланылған әдебиеттер
Патсаев Ә. Қ., Жайлауов С. Ж. «Органикалық химия негіздері». Шымкент, 2005, 1-кітап. - 359 б. 2005, 11-кітап. -441б., 2005, 111-кітап. 232б.
Патсаев Ә. Қ., Сейтімбетов Т. С, Шитыбаев С. А, Дәуренбеков Қ. Н. «Биоорганикалық химия». Шымкент, 2005, -443б.
Қуатбеков Ә. У., Патсаев Ә. К., Бақтыбаев У. Б. «Биоорганикалық химия практикумы», Шымкент, 2006, -582б.
Патсаев Ә. Қ., Дәуренбеков Қ. Н. «Биоорганикалық химияның тәжірибелік-зертханалық сабақтарына қолданба» Шымкент, 2005-318 б
И. Нұғыманұлы. Химияны оқыту әдістемесі. Алматы. Рауан. 1993.
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz