Гидролиз және тұздардың рН есептеулері: биохимиялық және фармацевтикалық маңызы



Тақырыбы: Гидролиз. Әр түрлі типті гидролизденуші түздардың рН есептеу. Дәрілік препараттарды алу мен сақтаудағы гидролиздің маңызы.

Жоспар:
КІРІСПЕ
1. Гидролизге түсінік
2. Тұздар гидролиз
II. НЕГІЗГІ БӨЛІМ
1. Тұздың сумен әрекеттесу жағдайы.
2. Гидролиз дәрежесі мен тұрақтысы
3. III. ҚОРЫТЫНДЫ
Гидролиздің бихимиялық процестердегі рөлі, оның фармациядағы маңызы

Гидролиз(гидро . . . Су және грек. lysіs - айыру, ыдырау) - су мен түрлі заттар арасындағы иондық алмасу реакциясы. Гидролизге тұздар, гидридтер, тиоангидридтер, галогенангидридтер, әр түрлі органикалық қосылыстар ұшырайды. Гидролиз - кейбір химиялық қосылыстардың су молекуласының әсерінен төмен молекулалы түзілімдер жиынтығына ыдырау қасиеті. Гидролиз сулы ерітінділер жағдайында немесе судың және су буының қатты, сұйық және газ тектес заттарға тигізер әсері нәтижесінде жүзеге асады.
Гидролиз - судың магма текті минералдармен негізгі химиялық реакциясы. Соның нәтижесінде сілтілік және сілтілік жер элементтерінің кристалл торындағы катиондар су сутектің иондарына алмасады
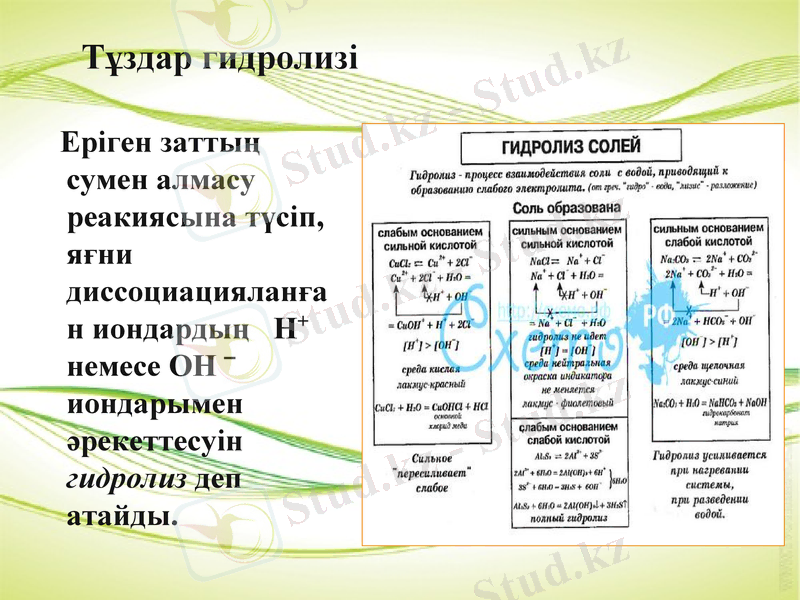
Тұздар гидролизі
Еріген заттың сумен алмасу реакиясына түсіп, яғни диссоциацияланған иондардың H+ немесе OH ‾ иондарымен әрекеттесуін гидролиз деп атайды.


Тұздардың сумен әркеттесуінің 4 жағдайы бар:
1. Егер тұз күшті негіздің катионы мен күшті қышқылдың анионынан түзілген болса, онда мұндай тұз гидролизге ұшырмайды және оның сулы ерітіндісінің ортасы бейтарап болады (pH=7) . Мысалы:КNO3, NaСI және т. с. с.
К2+ + CI ‾ + HOH ↔ К+ + OH‾ + H+ + CI
H2O ↔ H+ + OH ‾

2. Егер тұз күшті негіз катионы мен әлсіз қышқыл анионынан түзілген болса, онда тұз гидролизге анион бойынша ұшырайды. Орта сілтілік (рН›7) болады. Мысалы:
1) KCN + H2O ↔HCN +KOH
CN‾ + H2O ↔ HCN + OH
2) Na2 CO3+ H2O ↔ NaHCO3+NaOH
CO32- + H2O ↔ HCO3 + OH I-саты
NaHCO3 + H2O ↔H2CO3 +NaOH
HCO3- +H2O↔H2CO3 +OH- II-саты

3. Егер тұз әлсіз негіз катионы мен күшті қышқыл анионынан түзілсе, онда тұз гидролизге катион бойынша ұшырайды және оның сулы ертіндісінің ортасы қышқылдық (рН<7) болады. Мысалы:
NH4 CI+ H2O↔NH4 OH+HCI
NH4+ +H2O↔NH4OH+H+

4. Егер тұз әлсіз негіз катионы мен әлсіз қышқыл анионынан түзілсе, онда бұл тұз гидролизге катион бойынша да, анион бойынша да ұшырайды. Егер қышқыл мен негіздің күштері бір біріне өте жақын болса, онда сулы ерітіндінің ортасы нейтралға (рН≈7) өте жақын болады. Мысалы:
NH4 CH3 COO +HOH↔NH4 OH +CH3 COOH NH4 + +CH3 COO - +HOH↔NH4OH+CH COOH KNH4OH =1, 8*10-5 KCH3COOH =1, 8*10-5 рН≈7

Гидролиз дәрежесі

Гидролиз тұрақтысы
Гидролиз тұрақтысы-К -өрнекті гидролиз процесінен, су молекуласының тепе-теңдік тұрақтысынан және концентрация тұрақтылығынан алынуы. Мысылы:
CH3 COO‾+H2O↔CH3 COOH +OH‾
K=[CH3 COOH] [OH‾] /[CH3 COO‾] [H2O K[H2O] =[CH3 COOH] [OH‾] /[CH3 COO‾] =Kгидр.
яғни K[H2O] =[H-] [OH+], онда
Kгидр=KH2O/KCHOOH.

Бейорганикалық қосылыстардың гидролизі.
Гидролизге тұздардың қоспалары ұшырайды. Осыған байланысты тұздардың судағы қосылыстары әр түрлі рН мәніне ие болады:
Қышқылдық (рН<7) .
Негіздік (рН>7) .
Бейтарап (рН=7) .

Органикалық қосылыстардың гидролизі.
1. Галогеналкандардың гидролизі.
С2Н5Сl + Н2О →С2Н5ОН + НСl
2. Күрделі эфирлердің гидролизі .
СН3-СОО-С2Н5 + Н2О → СН3-СООН +С2Н5ОН
3. Дисахаридтар гидолизі.
С12Н22О11 + Н2О →С6Н12О6 + С6Н12О6
4. Полисахаридтар гидролизі.
(С6Н10О5) n + nН2О →nС6Н12О6
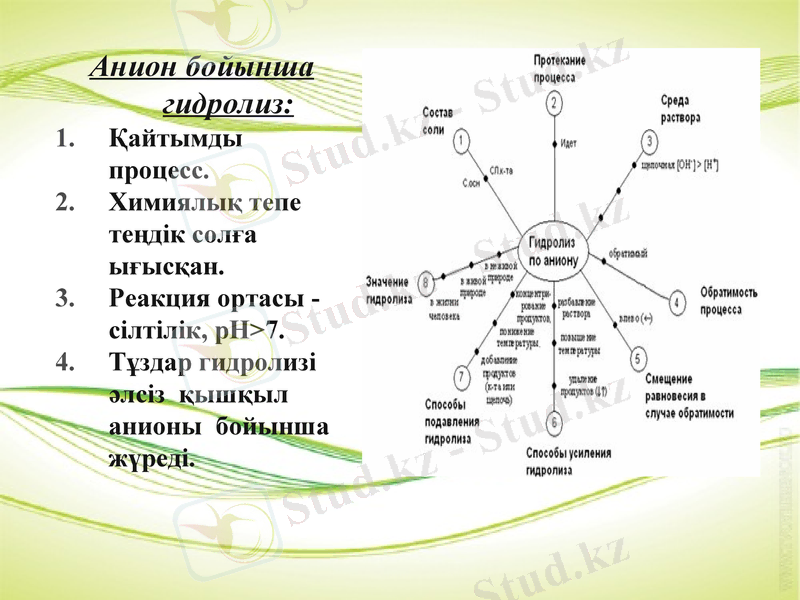
Анион бойынша гидролиз:
Қайтымды процесс.
Химиялық тепе теңдік солға ығысқан.
Реакция ортасы - сілтілік, рН>7.
Тұздар гидролизі әлсіз қышқыл анионы бойынша жүреді.
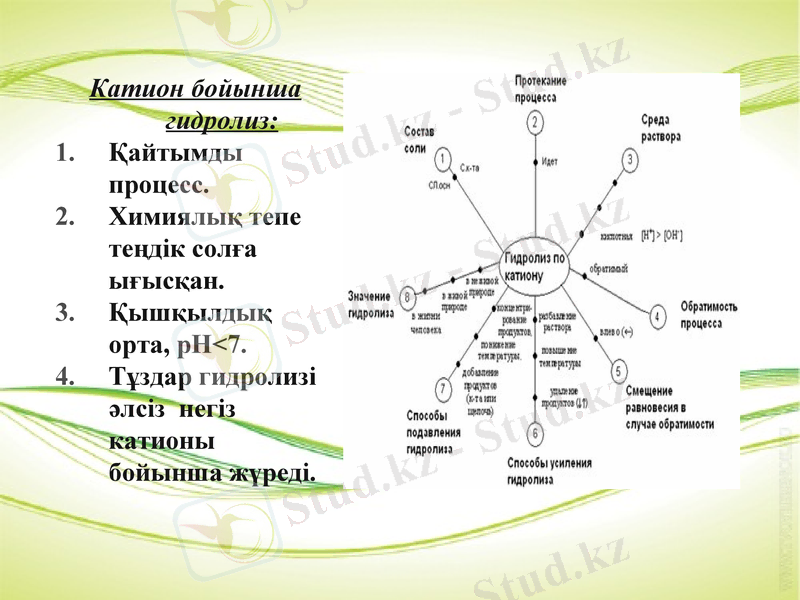
Катион бойынша гидролиз:
Қайтымды процесс.
Химиялық тепе теңдік солға ығысқан.
Қышқылдық орта, рН<7.
Тұздар гидролизі әлсіз негіз катионы бойынша жүреді.

Гидролиздің анион және катион бойынша жүруі.

Гидролизді күшейтуге болады:

Гидролизді тоқтатуға болады:

Гидролиздің биохимиялық процестердегі рөлі, оның фармациядағы маңызы
Көптеген дәрі дәрмек құралдардың химиялық терапевтік іс әрекеті олардың қышқылды негіздік қаиеттерімен байланысқан, демек бұл да олардың гидролизге бейімділігімен тығыз үндестікте болатындығы.
антисептикалық құрал ретінде қолданылуы, ол препарат асқазан сөлінің қышқылды ортасында формальдегидтің түзілуімен байланысты гидролизденеді.
(CN2) 6N2 + 6H2O↔HCOH + 4NH3


- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz