Фармацевтика өндірісінде сапаны бақылау: GMP стандарттары мен Қазақстандық нормативтер



«ФАРМАЦЕВТИКА ӨНДІРІСІНДЕ САПАНЫ БАҚЫЛАУ»
Орындаған:
Қабылдаған:

Жоспар:
Кіріспе
Негізгі бөлім
Қазақстан Республикасы Денсаулық сақтау министрінің 2009 жылғы 19 қарашадағы № 740 бұйрығы»
GMP стандарттары
Қорытынды
Пайдаланылған әдебиеттер

Кіріспе
Бүгінгі таңда халықаралық корпорациялардың құрамына кірмейтін отандық өндіруші үшін тірі қалудың жалғыз стратегиясы-нарықта "баға/сапа" қатынасы бойынша Шығыс Еуропа мен дамушы елдердің өнімдерімен бәсекелесуге қабілетті "сапалы отандық өнім" ретінде тиімді ұсынуға болатын өнім шығару болып табылады. Фармацевтикалық саланың дамуына, тұтастай алғанда, нарықтағы бәсекелестіктің өсуіне әкелуі тиіс, келесі маңызды оқиға Кеден одағының өндірістік фармацевтикалық алаңдарында GMP стандарттарын енгізу болады. Ресей, Белоруссия және Қазақстан фармацевтикалық нарықтарының едәуір өсу қарқыны халықтың ең көп санымен де, ТМД елдері арасында Денсаулық сақтау саласындағы реформалармен де байланысты.

НЕГІЗГІ БӨЛІМ "Дәрілік заттарды, медициналық мақсаттағы бұйымдар мен медициналық техниканы өндіру және олардың сапасын бақылау, сондай-ақ тұрақтылығына сынақтар жүргізу және сақтау және қайта бақылау мерзімін белгілеу Ережесін бекіту туралы" Қазақстан Республикасы Денсаулық сақтау министрінің 2009 жылғы 19 қарашадағы № 740 бұйрығы»
Ереже "Халық денсаулығы және денсаулық сақтау жүйесі туралы" Қазақстан Республикасының 2009 жылғы 18 қыркүйектегі Кодексіне, Қазақстан Республикасында фармацевтикалық қызметті регламенттейтін нормативтік құқықтық актілерге сәйкес әзірленді және дәрілік заттарды, медициналық мақсаттағы бұйымдар мен медициналық техниканы шығаратын Денсаулық сақтау субъектілерінің (бұдан әрі - өндіруші) өндірісін ұйымдастыруға және сапасын бақылауға қойылатын талаптарды қамтиды және дәрілік заттардың тұрақтылығына сынақтар жүргізу және сақтау мерзімі мен қайта бақылау кезеңін белгілеу тәртібін белгілейді.

GMP стандарттары
GMP стандарттарыңың негізі 1963 жылы АҚШ-та қаланды. Бұл ережелер 1992 жылға дейін бірнеше рет қайта өңдеуден өтіп, толықтырылып отырды. GMP стандарттарына халықаралық статусы 1968 жылы БДСҰ қатысында құрастылғаны үшін берілді. GMP ережелері бүкіл әлемде қолданылады. 2014 жылы барлық отандық фармацевтикалық өндіріс орындары GMP стандарттарына өтуі қажет. Қазіргі кезде GMP ДЗ өндірушілердің дамыған елдер нарығына шығуының шарты болып отыр.
Бұл стандарт өндірістің бастапқы заттарынан бастап, құрал-жабдықтар, ғимараттар және персоналдың жеке бас тазалығы сияқты барлық аспекттерін қамтиды.

Бұл халықаралық сапа стандарттарына сәйкес фармацевтикалық өнімдер өндірісін үнемі қолдау және бақылауды қамтамасыз ету жүйесі болып табылады. Сонымен бірге, фармацевтикалық өнім сапасын шикізат пен материалдардан бастап дайын өнімді шығарғанға дейінгі, оның ішіне тасымалдау мен сақтауды да ескере отырып, бақылау да кіреді.
GMP негізгі мақсаты-өндірілген өнімнің сапасының жоғары екендігіне кепіл болу.
Соңғы өнімнің сапасына әсерін тигізетін әр үрдіс үшін арнайы нұсқаулар мен жүйелер, өндірістің әр кезеңінде орындалатын барлық тиісті рәсімдерді растайтын құжаттар жасалған. GMP стандарты фармацевтикалық өндірістің барлық кезеңдерінде сапасыз өнім алу тәуекелін азайтуға шақырады.
.
Тиісті өндірістік тәжірибе - GMP (Good Manufacturing Practice) .

GMP стандартына сай өндіріс орындарының құрылысы ең басты мақсат - өнімнің таза болуына бағынуы тиіс.
Біздің елімізде «таза» өндіріс орындарында ауа қысымы айырмашылығы 4мм. сын. бағ., температура 23+20С, салыстырмалы ылғалдылығы 30-40%болуы қамтамасыз етіледі.

GMP негізгі талаптары
барлық өндірістік үрдістер айқын анықталған болуы тиіс және оларды жүре пайда болған тәжірибелерді ескере отырып, жүйелі түрде қадағалау қажет;
өндірістік үрдістің критикалық сатысы мен үрдістегі маңызы бар өзгерістер валидациялануы тиіс;
GMP арналған барлық құралдар болуы қажет.

Сәйкес ғимарат пен оның ауданы
Қажетті біліктілігі бар ғылыми қызметкер
Қажетті қондырғылар және оның дұрыс қызмет көрсетуі
Сәйкес заттар, біріншілік орам және заттаңба
1
2
3
4
GMP құралдары
әдістемелер мен нұсқаулық-тарды бекіту
сақтау мен тасымалдау сәйкестігі
сату немесе жабдықтау бойынша өнімнің кез-келген сериясын қайтарып алу жүйесі
сатылған өнімге білдірілген наразылықты қарау

Қызметкерлерге қойылатын GMP талаптары
Өндіруші қарамағында қажетті біліктілігі мен практикалық тәжірибесі бар тиісті қызметкерлер болуы.
Өндірушіде әрбір қызметкер сәйкес жұмыс орнында белгілі міндеттерін орындайтын схема болуы тиіс.
Басшы қызметкерлер: өндіріс және бөлім жетекшілері, олар бір-біріне бағынбайтын уәкілетті тұлғалар.

4. құжатқа сәйкес жүргізілуін қамтамасыз ету
3. өз бөлімінің жағдайын, қызмет көрсетуін және ғимараттар мен құрал-жабдықтарды бақылау
1. өндірісті қамтамасыз ету және қажетті сапаға жету барысында бекітілген құжаттарға сәйкес өнімді сақтау
5. бөлімдегі қызметкерлердің біріншілік және ары қарай оқуын қамтамасыз ету
2. өндірістік операцияларға қатысты нұсқауларды бекіту және олардың орындалуын қамтамасыз ету
Өндірістік бөлім жетекшісінің міндеттері

жұмысқа қабылданар алдында медициналық тексеруден өтуі тиіс
жұқпалы аурулармен немесе ашық жаралармен өндіріске кіруге тиым салынады
орындалатын жұмыс түріне байланысты қорғаныш киімін кию қажет
өндіріс аймағында тамақтануға, сусын ішуге жіне тағам, сусындар, табак өнімдерін сақтауға тиым салынады
ашық өнім мен оператор қолының тікелей жанасуынан абай болған жөн.
Қызметкерге қойылатын талаптар

Ғимараттар мен қондырғыларға қойылатын талаптар
ғимараттар мен қондырғылардың орналасуы, жобалануы, лайықты жабдықталуы, пайдаланылуы жүргізілетін операциялар түрлеріне байланысты талапқа жауап беруі тиіс;
олардың орналасуы мен конструкциясы өте аз тәуекелга әкелуі қажет;
қиыстырылған контаминацияны болдырмау мақсатында тиімді тазалау және қызмет көрсету мүмкіндігін қамтамасыз ету қажет.
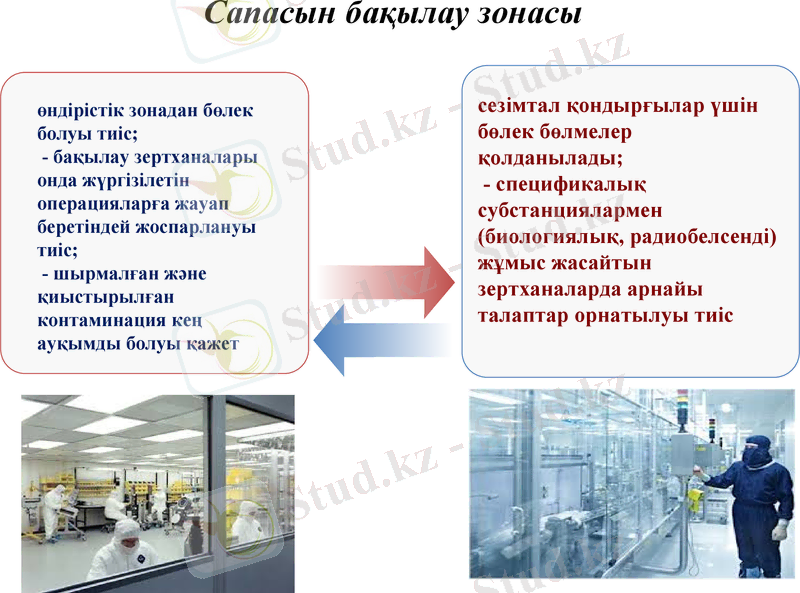
Сапасын бақылау зонасы
сезімтал қондырғылар үшін бөлек бөлмелер қолданылады;
- спецификалық субстанциялармен (биологиялық, радиобелсенді) жұмыс жасайтын зертханаларда арнайы талаптар орнатылуы тиіс
өндірістік зонадан бөлек болуы тиіс;
- бақылау зертханалары онда жүргізілетін операцияларға жауап беретіндей жоспарлануы тиіс;
- шырмалған және қиыстырылған контаминация кең ауқымды болуы қажет

Дұрыс пайдалану ережелері (GMP) :
барлық өндіріс үдерістерін нақты регламенттеу және қажетті сападағы ДЗ шығару үшін жарамды сапаны бақылау;
өнімнің сапасына әсер етуі мүмкін өндірістің барлық сатыларын валидациялау;
өндірістің оқытылған және білікті персоналмен, қажетті үй-жайлармен, негіздермен және қызмет көрсетумен, шикізатпен, қажетті сападағы қосалқы және өзге де материалдармен, шикізат пен материалдарды сақтау және тасымалдау үшін тиісті шарттармен қамтамасыз етілуі;

әрбір нақты өндіріс үшін бір мәнді және нақты жазылған технологиялық регламенттер мен нұсқаулықтардың болуы;
регламент бойынша талап етілетін барлық операциялардың орындалуын және алынған өнімдердің саны мен сапасы бойынша белгіленген талаптарға сәйкестігін растайтын өндірістің барлық кезеңдерін тіркеу;
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz