Қазақстан Республикасында дәрілік заттарды өндіру мен сапаны бақылаудың принциптері



«ҚР ДӘРІЛІК ЗАТТАРДЫ ӨНДІРУ ЖӘНЕ ОЛАРДЫҢ САПАСЫН БАҚЫЛАУ ПРИНЦИПТЕРІ»
Орындаған: Мәни Төребек
Топ: ТФП - 33
Қабылдаған: Мукушева. Г. К
Қарағанды, 2020

ЖОСПАР:
Кіріспе
Негізгі бөлім
Қазақстан Республикасында дәрілік заттарды өндіру
Қазақстанда сапасын бақылау принциптері
Қорытынды
Пайдаланылған әдебиеттер

КІРІСПЕ
Өзінің мықты фармацевтикалық өнеркәсібінің қалыптасуы жеткілікті дәрежеде ұзақ, еңбек сыйымды және қымбат процесс болып табылады. GMP халықаралық стандарттарына сәйкес заманауи технологиялар базасында фармацевтикалық және медициналық өнімдердің импортты алмастыру үшін жағдай жасау 2016 жылдың 1 қаңтарынан бастап Кеден одағы аумағында дәрілік заттардың бірыңғай нарығы жұмыс істей бастағанын ескере отырып, ҚР фармацевтикалық өнеркәсібін дамыту жөніндегі негізгі міндеттердің бірі болып табылады.

Негізгі бөлім
Қазақстанда шетелдік серіктестердің келуімен GMP халықаралық стандарттары бойынша сертификатталған өндірістік алаңдар пайда болды. Қазіргі уақытта 8 отандық фармацевтикалық компанияның 12 өндірістік алаңы GMP сертификатына ие болды.
Сондай-ақ, қазіргі уақытта Қазақстан Республикасында фармацевтикалық өнеркәсіптің 63 объектісі тиісті зертханалық практиканы (GLP), тиісті клиникалық практиканы (GCP), тиісті өндірістік практиканы (GMP), тиісті дистрибьюторлық практиканы (GDP), тиісті дәріхана практикасын (GPP) және тиісті фармакоқадағалау практикасын (GVP) қамтитын GxP халықаралық стандарттарын енгізді.

Қазақстан Республикасында дәрілік заттарды өндіру
Қазақстанның фармацевтикалық нарығын қалыптастыру жөніндегі мемлекеттің шешуші міндеттері:
инвестициялық жобаларды іске асыру шеңберінде жұмыс істеп тұрған өндірістерді жаңғырту және жаңа фармацевтикалық кәсіпорындар салу;
фармацевтикалық өнеркәсіп кәсіпорындарында халықаралық сапа стандарттарын (GMP) енгізу;
GMP халықаралық стандарттарына сәйкес қазіргі заманғы технологиялар базасында фармацевтикалық және медициналық өнімдердің импортты алмастыру үшін жағдай жасау;
саланы білікті кадрлармен қамтамасыз ету.

GMP (Good Manufacturing Practice, Жақсы өндірістік тәжірибе) - адамдарға және жануарларға арналған дәрілік заттарды өндіру мен сапасын бақылауға қойылатын талаптарды, сондай-ақ белсенді фармацевтикалық заттар мен дәрілік заттардың белгілі бір түрлерін өндіруге қойылатын арнайы талаптар. GMP стандарттары өндірістік көрсеткіштер мен зертханалық тестілеуді реттейді және бағалайды.
GLP (Good Laboratory Practice, Жақсы зертханалық практика) - ұйымдық үдерісті және денсаулық пен экологиялық қауіпсіздікпен байланысты дәрілік заттарды клиникалық емес зерттеулерді жүргізетін сапалық жүйе.
GCP (Good Clinical Practice, Жақсы клиникалық практика) - адами тақырыпты зерттеуді жоспарлау және жүргізу үшін халықаралық этикалық және ғылыми стандарт, сондай-ақ осындай зерттеулер нәтижелерін құжаттау және ұсыну.

Отандық фармацевтикалық кәсіпорындарда GMP халықаралық стандарттары
Фарм. кәсіпорын
АО «Нобел АФФ»
Қатты дәрілік заттар цехы
Сұйық және жұмсақ дәрілік заттар цехы
АО «Химфарм»
Ұнтақтарды асептикалық себу цехы
Шприцті толтыру ампулаларында инъекциялық ерітінділер өндіру цехы
Инъекциялық ерітінділер және инфузиялар цехының инъекциялық ерітінділерінің өндірістік желілері
ТОО «ВИВА Фарм»
Қатты дәрілік заттардың өндірістік учаскесі
ТОО «ФитОлеум»
Майлы сығындылардың өндірістік учаскесі
Суппозиториев өндірістік учаскесі
ТОО «Эйкос-фарм»
Қатты дәрілік заттардың өндірістік учаскесі
ТОО «Келун-Казфарм»
Инфузиялық ерітінділердің өндірістік учаскесі
ТОО «ПФК «Элеас»
Стерильді дәрілік заттарды тарататын цех
ТОО «DOSFARM»
Клиникаға дейінгі және клиникалық зерттеулер жүргізу, дәрілік препараттарды өндіріске енгізу
(Дереккөз: Қазақстан Республикасы Денсаулық сақтау және әлеуметтік даму министрлігі)

дәрілік заттарды өндірудің тараптарына қатысты GMP негізгі принциптері:
1. Персоналды басқару.
2. Персонал.
3. Үй-жайлар мен жабдықтар.
4. Құжаттама.
5. Өндіріс.
6. Сапасын бақылау.
7. Келісім-шарт бойынша жұмыстарды орындау.
8. Және кері қайтарып алу.
9. Өзіндік инспекция.
Сапа жүйесі - сапаны басқаруды жүзеге асыру үшін қажетті ұйымдастырушылық құрылымның, әдістемелердің, процестер мен ресурстардың жиынтығы. GMP стандарты дәрілік заттарды өндіретін кәсіпорындарда сапа жүйесін құруға арналған.

Дәрілік заттарды өндіру кезінде сапаны қамтамасыз ету жүйесі (Сапа жүйесі) мыналарға кепілдік беруі тиіс:

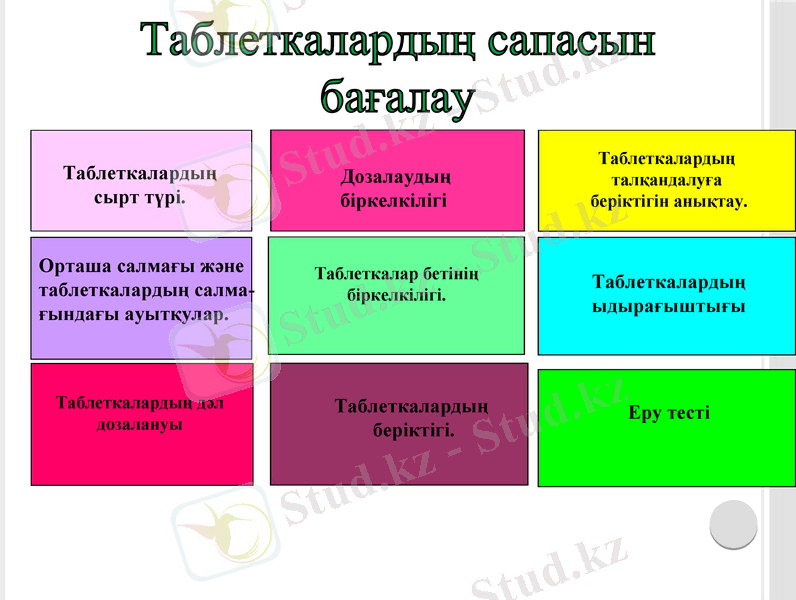
Таблеткалардың сапасын бағалау
Таблеткалардың сырт түрі.
Орташа салмағы және
таблеткалардың салма-
ғындағы ауытқулар.
Таблеткалардың дәл
дозалануы
Дозалаудың
біркелкілігі
Таблеткалар бетінің
біркелкілігі.
Таблеткалардың
беріктігі.
Таблеткалардың талқандалуға
беріктігін анықтау.
Таблеткалардың ыдырағыштығы
Еру тесті

Сапаны бақылауға қойылатын негізгі талаптар
қажетті үй-жайлар мен жабдықтардың, оқытылған персоналдың, сынамаларды іріктеу, бастапқы және буып-түю материалдарын, аралық, өлшеп-оралмаған және дайын өнімді тексеру және сынақтан өткізу, қажет болған жағдайда қоршаған ортаны бақылау бойынша бекітілген әдістемелердің болуы.
сапаны бақылау бөлімі бекіткен әдістемелерге сәйкес аттестатталған персоналдың бастапқы және буып-түю материалдарының, аралық, өлшеп-оралмаған және дайын өнімнің сынамаларын іріктеуін жүргізу.
сынақтарды аттестатталған (валидацияланған) әдістермен жүргізу.

сынамалар, тексерулер мен сынаулардың барлық қажетті іріктеулерін нақты жүргізуді, сондай-ақ кез келген ауытқулар мен тергеулерді толық көлемде тіркеуді растайтын хаттамаларды (қолжазба тәсілімен және/немесе техникалық құралдарды қолдана отырып толтырылатын) жасау.
дайын өнімнің тіркеу деректеріне сәйкес келетін сапалық және сандық құрамы бойынша белсенді ингредиенттерді қамтитынын, талап етілетін тазалығы бар, дұрыс буып-түйілген және таңбаланғанын растау.
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz