Адсорбция, абсорбция және хемосорбция: механизмдер, адсорбциялық изотермалар және беттік керілу



Орындаған: Орманбек А.
Топ: И-223-А
Тексерген: Слямова М. М
ШЫҒЫС ҚАЗАҚСТАН ОБЛЫСЫ СЕМЕЙ ҚАЛАСЫ ҚАЗАҚ ИННОВАЦИЯЛЫҚ ГУМАНИТАРЛЫҚ-ЗАҢ УНИВЕРСИТЕТІ

Берілген дененің (заттың) дисперстілік дәрежесі жоғарлаған сайын, ол өзінің көбейген бетіне басқа дененің көп бөлшегін сіңіреді. Еріген немесе газ қалпындағы заттардың қатты дене сұйық дене немесе сұйықтықтың бетіне өздігінен жиналып, шоғырлана келіп, қоюлану құбылысын сорбция дейді. Әдетте өзіне басқаны сіңіруші затты - сорбент, ал оған сіңірілетін затты сорбтив дейді. Ал сорбцияға кері құбылысты десорбция дейді. Егер сіңіру дененің тек беткі қабатында жүретін болса, онда оны адсорбция дейді.
Сіңіруші зат адсорбент
Сіңірілетін зат адсорбтив
Адсорбция
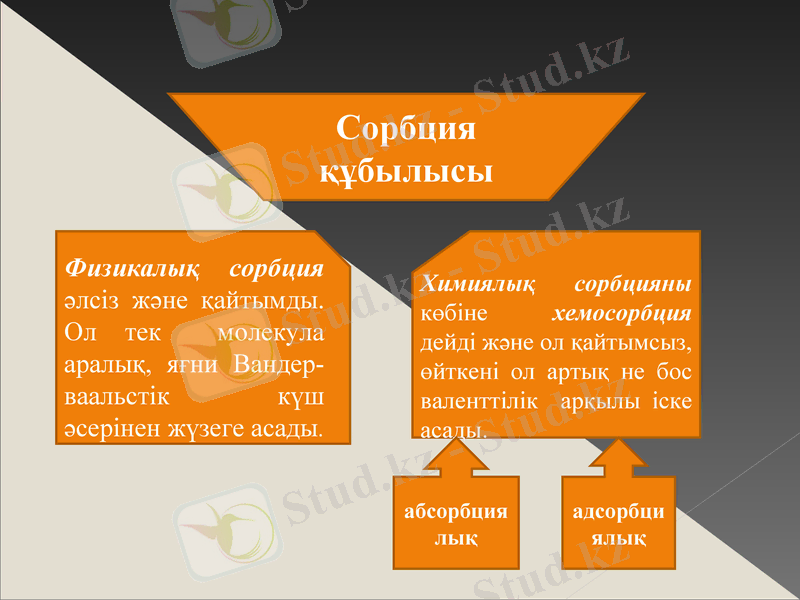
Сорбция құбылысы
Химиялық сорбцияны көбіне хемосорбция дейді және ол қайтымсыз, өйткені ол артық не бос валенттілік арқылы іске асады.
Физикалық сорбция әлсіз және қайтымды. Ол тек молекула аралық, яғни Вандер-ваальстік күш әсерінен жүзеге асады.
адсорбциялық
абсорбциялық

Абсорбция дегеніміз сорбент массасына диффузия арқылы газ енгендегі сорбция құбылысы. Ол берілген заттың (сорбтивтің) екінші бір затта (сорбентте) еру құбылысына пара-пар. Фаза аралығындағы заттың таралуы Генри заңына бағынады. Абсорбция құбылыстары өнеркәсіпте кең қолданылуда. Мысалы: өнеркәсіптегі тұз қышқылын өндіру толығымен хлорлы сутек газын судың абсорбциялау құбылысына негізделген.

Хемосорбция дегеніміз сіңетін және сіңіретін заттар арсындағы әрекеттесу терең жүру нәтижесінде жаңа химиялық зат пайда болатын процесс. Мысалы: натронды ізбестің көміртек (IV) оксиді мен күкірт (IV) оксидін өзіне сіңіріп, карбонат пен сульфат тұздарын түзетінін келтіруге болады. Хемосорбцияны физикалық сорбция мен абсорбциядан осы құбылыстар кезінде бөлінетін жылу шамасын өлшеп, ажыратуға болады.

Адсорбция дегеніміз екі фазаның жанасу шегіндегі заттар концентрациясының өздігінен өзгеруі немесе әдетте біреуі қатты зат болып келетін екі фазаның жанасу шегіндегі беттік қабаттама бір фаза концентрациясының жоғарлауы.
Адсорбция құбылысы. Термодинамиканың екінші заңына сәйкес бос энергия қоры болғандықтан, ол өзінен осы энергияны азайтуға ұмтылады. Бұл адсорбция және басқада физикалық құбылыстардың жүруіне тікелей не жанама ықпал етеді екен.

Адсорбент бетінің 1см2-на сіңген заттың мөлшерін меншікті адсорбция (Г) деп атайды. Іс жүзінде кез келген адсорбент бетін өлшеу мүмкіндігі бола бермейтіндіктен, 1кг адсорбент ке адсорбцияланған адсорбцияны мольмен өлшеп, (А) әріпімен белгілейді: А = х / м
Адсорбция (А) мен меншікті адсорбция арасындағы байланыс былайша өрнектеледі: А = Г * S0
Берілген адсорбентпен адсорбтив үшін меншікті адсорбцияның шамасы адсорбтив газ күйінде болса температура (Т) мен қысым (р), ал ерітінді болса температура (Т) мен концентрацияға (С) тәуелді. Адсорбция шамасы (2) теңдеу арқылы өрнектелетін болса, онда меншікті адсорбция температура мен концентрациядан (қысымнан) басқа адсорбенттің беткі қабатының ауданына да тәуелді болады.

Температура меншікті адсорбция және концентрациядан (қысым) сияқты үш өлшемнің математикалық тұрғыдан өзара функционалды байланыста болатын жалпы термодинамикалық теңдеумен өрнектеуге болады. :
Г = f ( Т, С ) немесе Г = f ( Т, р ) }
F = ( Г, Т, С) = 0 немесе f ( Г, Т, р) = 0 }
Бұл теңдеулерден адсорбция изотермиясы (Т=const) деп аталатын және оны сипаттайтын қосымша теңдеу туындайды:
Г = f (С ) немесе Г = f (р )

Көптеген зерттеулер көрсеткендей адсорбция қайтымды процесс. Адсорбция жүретін беткі қабатында орналасқан молекулалар аса мықты бекітілмеген. Олардың кейбіреулері адсорбенттің тартылыс күші әсер ететін шектен шығып кетуі мүмкін, яғни адсорбенттің бетінен бөлініп, өзін қоршаған ортаға кетеді. Мұны десорбция дейді. Бұл екі құбылыс белгілі бір мерзімде адсорбциялық жүйеде тепе-теңдік жағдайын тудырады:
Адсорбция Десорбция

Газдың қатты денедемен жанасу бетінде адсобциялануыекі компоненттен тұратын ең қарапайым жүйе. Көптеген тәжірибелер көрсетіп отырғандай, адсобцияланған газдың мөлшері оны адсобциялайтын активті беттің ауданы көбейген сайын артады екен. Үлкен мәндегі адсобция құбылысын жүргізу үшін сіңіретін заттың активті беті (ауданы) үлкен болуы қажет. Адсобенттің өзіне сіңіру қабілеті, оның тек қуыстығымен ғана анықталып қоймастан, оның физикалық күйімен де сипатталады: аморфты күйдегі адсобент, кристалды күйдегі адсобенттің адсобциялау қабілеті басым.
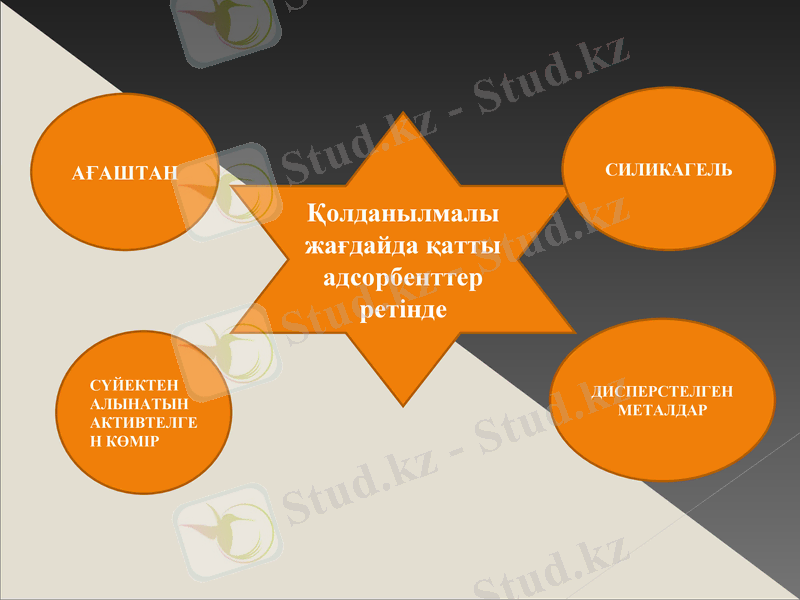
Қолданылмалы жағдайда қатты адсорбенттер ретінде
АҒАШТАН
СҮЙЕКТЕН АЛЫНАТЫН АКТИВТЕЛГЕН КӨМІР
СИЛИКАГЕЛЬ
ДИСПЕРСТЕЛГЕН МЕТАЛДАР


Адсорбция құбылысын түсіндіруге арналған бірнеше теория бар. Олардың бірі- физикалық теория. Бұл теорияға орай, адсорбциялық күш табиғаты молекула аралық күштердің пайда болуына сәйкес келеді. Физикалық адсорбция теориясының бірнеше түрлері белгілі. Олардың арасында 1915 жылы Ленгмюр ұсынған мономолекулалық адсорбция теориясы едәуір назар аударарлықтай. Бұл теорияны тұжырымдарда, оның авторы брнеше қағидаға сүйенеді:

1. Адсорбция валентті күштер не артылып қалған (қосымша) химиялық валенттілік күштері арқылы жүзеге асады.
2. Адсорбция берілген адсорбент бетінің бәріне бірдей жүре бермей, тек ондағы активті орталықтарда ғана жүреді. Осы активті орталықтардың әсері онда пайда болатын қанықпаған күш өрісінің күші болу салдарынан және сонң нәтидесінде осы орталықтарда газ молекулалары ұсталынып тұрады. Әрине, мұндағы адсорбент атомы не молекуласы аз қаныққан сайын, активті орталықтардың активтілігі артық болады.

3. Адсорбциялық күштердің әсері етуші радиусы кіші және осының салдарынан әрбір активті орталық адсорбтив молекуласының біреуін ғана адсорбциялайды, сөйтіп адсорбент бетінде адсорбтив молекуласының бір молекулалық (мономолекулалық) қабаты пайда болады.
4. Адсорбент бетінде адсорбцияланған газ молекулалары онда берік ұсталмайды: олар ылғи тоқтаусыз газды орта мен сол шеңберде алмасуда болады және бұл құбылыс динамикалық адсорбция тепе-теңдігі орнағанша жүреді. Осы құбылыстар кезіндегі әрбір молекула өзі адсорбцияланған бетте, дәлірек айтқанда активті орталықта аса ұзақ ұсталып тұра бермейді, энергияның басқа молекулаларға ауысуына орай, әуелгі молекулалар жаңадан келгендерге орнын береді.

Химиялық адсорбцияны немесе хемосорбцияны физикалық адсорбциямен салыстырғанда ол химиялық күш арқылы не соның көмегімен жүзиеге асады.
Физикалық адсорбция - қайтымды құбылыс.
Жылуы небәрі 8, 4-33, 5кДж/моль шамасында.
Температура жоғарлаған сайын төмендейді.
хемосорбция - қайтымсыз құбылыс. Жылуы бірнеше жүздеген кДж/мольге тең.
Температура жоғарлаған сайын хемосорбция жоғарлайды. Химиялық адсорбция жүру үшін, оған біршама активтендіру энергиясы (40-120кДж/моль) қажет

- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz