Комплексті қосылыстардың түзілу және бұзылу реакциялары



Профессор Рузуддиновтың медико-стоматологиялық колледжі
СӨЖ
Тақырыбы:Комплекстердің пайда болу және бұзылу реакциялары
Орындаған:Уәкілбек А. Н
Тексерген:Нурдаулет Ж.
Алматы 2020

Жоспары:
Комплексті қосылыстарға жалпы анықтама
Алынуы
Химиялық қасиеттері және бұзылу реакциялары
Қорытынды

Комплексі қосылыстар деп жеке компоненттердің тіркесінен түзілген (лат. - комплекс - тіркес) және кристалдық күйде де, еріген күйде де бола алатын күрделі иондар мен молекулаларды беретін күрделі құрамды қосылысты атайды. Комплексті қосылыстар жөніндегі түсінікті алғаш рет, ғылымға енгізген швейцар ғалымы А. Вернер (1898) . Комплексті қосылыстар химиясының дамуында Л. А. Чугаев және оның шәкірттері И. И. Черняев, А. А. Гринберг, В. В. Лебединский еңбектері үлкен роль атқарды. Вернердің координациялық теориясы бойынша көптеген комплексті қосылыстарда ішкі және сыртқы сфера болады. Комплексті қосылыстардың химиялық формулаларын жазғанда ішкі және сыртқы сфераны тік жақшаға алады. Мысалы, келесі комплексті қосылыстарда К2ВеҒ4] ішкі сфераны [ВеҒ4] 2- атомдар топталулары (комплексті иондар), ал сыртқы сфераны К+ құрайды. Ішкі сфераның орталық атомы комплекстүзуші, ал оның төңірегіндегі координацияланған молекулалар (иондар) - лигандалар деп аталады. Мысалы, К2[ВеҒ4] қосылысында ішкі сфера-комплексті анион [ВеҒ4] 2- тік жақшаға алынған. Комплекс түзуші атом- Ве2+ ионы, ал лиганда- фтордың төрт ионы.

Комплекстүзушінің төңірегіндегі лигандылар саны координациялық санды көрсетеді. Жоғарыда келтірілген мысалда ол төртке тең. Ішкі сфера заряды комплекстүзуші мен лиганда зарядтарының қосындысына тең және оң (комплексті катион жағдайында) теріс (комплексті анион жағдайында) және нөлге немесе бейтарап болуы мүмкін. Сыртқы сфера заряды ішкі координациялық сфера зарядына тең, бірақ таңбасы бойынша оған қарама-қарсы. Егер ішкі сфера заряды нөл болса, сыртқы сфера болмайды. Комплекстүзуші-ион заряды барлық қалған иондар зарядының алгебралық қосындысына тең, бірақ таңбасы жөнінен қарама-қарсы. Мысалы, К2[ВеҒ4] қосылысында сыртқы сфера иондарының заряды +2-ге тең комплекстүзуші-ион заряды лиганда (Ғ- төрт ионына) мен сыртқа сфера (К+ екі ионына) зарядтарының алгебралық қосындысына тең және таңбасы қарама-қарсы яғни Ве+2.

Лиганданың координациялық сыйымдылығы-комплекстің ішкі сферасында әр лиганда орналасатын орындар саны. Орталық атомда бір координациялық орын алатын лиганданы монодентатты деп атайды. Лигандалар екі және одан да көп (сегіз дейін) координациялық орынды комплекстүзушімен химиялық байланыстар сәйкес саны түзулуі арқылы алады. Мұндай лигандалар полидентатты делінеді, олар жиі кездеседі, мысалы, гистидин аминқышқылының анионы, хлорофилл, гемоглобин. 2. Элементтердің комплексті қосылыс түзуге қабілеттілігі атомның сыртқы электрондық деңгейінің құрылысына тәуелді және оның периодтық жүйедегі орнымен байланысты. Әдетте, комплекстүзуші жеткілікті бос орбиталь саны бар металдардың иондары мен атомдары. Лигандалар мен химиялық байланыс түзілгенде комплекстүзушілер акцептор ролін атқарады, яғни өзінің бос орбитальдарын береді. Бұл кезде егер комплекстүзуші химиялық байланыс үшін s - орбиталь берсе, онда тек сигма - байланыс, егер p-, d- немесе f- орбиталын берсе, онда сигма және пи байланыс түзеді.

Бір периодтан екінші периодқа өткенде элементтің координация саны өседі. I период элементтері үшін оның мәні 2-ге, II период элементтеріне 4 -ке (бір s - және үш р-орбитальдар) . III период элементтерінде 6 - ға (s р, f-орбитальдары) . V және VI период элементтері өте жоғары координациялық сан-8 көрсете алады. КОМПЛЕКСТІ қосылыстардағы лигандалар мынадай аниондар болуы мүмкін. F-фторо; SCN- родано; C2O42- оксалато; OH- гидроксо; NO3- нитро; CN- циано; CO32-карбонато. Бейтарап молекулалар: Н2О - акво; NO - нитрито; NН3 - амино; F2 - фторо; СО - карбонил; NН2 - СН2 - СН2 - NН2 - этилендиамин, т. б.
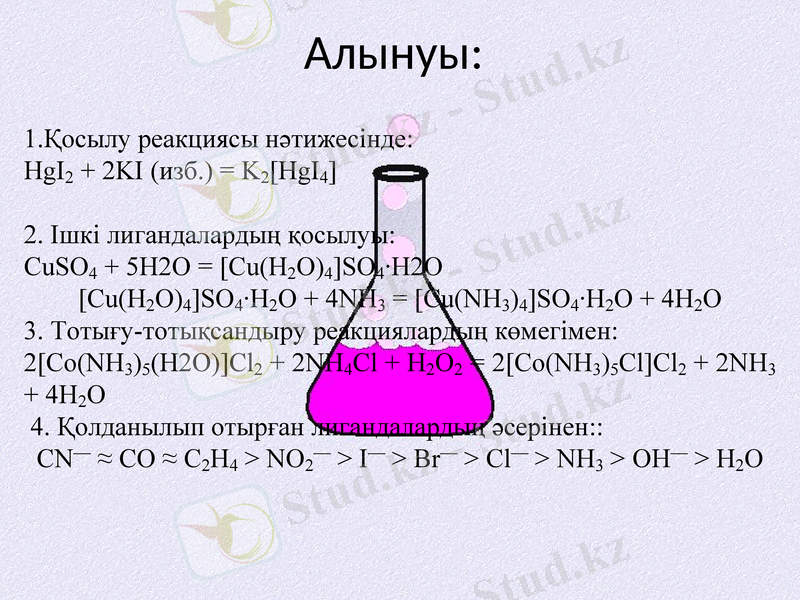
Алынуы:
1. Қосылу реакциясы нәтижесінде:
HgI2 + 2KI (изб. ) = K2[HgI4]
2. Ішкі лигандалардың қосылуы:
CuSO4 + 5H2O = [Cu(H2O) 4] SO4·H2O
[Cu(H2O) 4] SO4·H2O + 4NH3 = [Cu(NH3) 4] SO4·H2O + 4H2O
3. Тотығу-тотықсандыру реакциялардың көмегімен:
2[Co(NH3) 5(H2O) ] Cl2 + 2NH4Cl + H2O2 = 2[Co(NH3) 5Cl] Cl2 + 2NH3 + 4H2O
4. Қолданылып отырған лигандалардың әсерінен::
CN- ≈ CO ≈ C2H4 > NO2- > I- > Br- > Cl- > NH3 > OH- > H2O

Химиялық қасиеттері
1. Диссоциация:
Бастапқы (күшті электролиттер ретінде) :
K4[Ni(CN) 4] = 4K+ + [Ni(CN) 4] -4
Екіншілік (әлсіз электролиттер ретінде)
Ni(CN) 4] 4- = Ni0 + 4CN-
2. Алмасу реакциялары
Сыртқы сферадағы иондардың алмасуы
Na2[Hg(SCN) 4] + Co(NO3) 2 = Co[Hg(SCN) 4] + 2NaNO3
Ішкі сферадағы иондардың алмасуы
[Zn(NH3) 4] SO4 + CuSO4 = [Cu(NH3) 4] SO4 + ZnSO4

3. Тығыз комплекстің түзілуі
Na2[Zn(OH) 4] + CuSO4 = Cu[Zn(OH) 4] + Na2SO4
4. Тотығу-тотықсыздану реакциясы:
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz