Потенциометрия: теориялық негіздері мен аналитикалық әдістері



ПРОФЕССОР РУЗУДДИНОВТЫҢ МЕДИКО-СТОМАТОЛОГИЯЛЫҚ КОЛЛЕДЖІ
СӨЖ
ТАҚЫРЫБЫ:ПОТЕНЦИОМЕТРИЯ
Орындаған:Уәкілбек А. Н
Тексерген:Нурдаулет Ж.
Алматы 2020

Жоспары:
Физикалык-химиялық талдау әдістері
Потенциметрия
Қорытынды

Физика-химиялық əдісінің көмегімен кез-келген агрегаттық күйдегі анорганикалық жəне органикалық қосылыстарды сандық жəне сапалық тұрғыдан талдауға болады. Физикалық-химиялық талдау əдістері белгілі бір химиялық реакциясы нəтижесінде талданатын жүйедегі өзгерістердің: жарық сіңіру, жарық тысындыру, электр өткізгіштік, жылу өткізгіштік сияқты физикалық-химиялык сипатын бақылауға негізделген.

Талдаудың негізгі физика-химиялық әдістері.
Талдаудың физика-химиялық әдістерінің тобында физикалық әдістерді ажыратады. Бірақ бұл үшін қатаң және бірыңғай критерий жоқ, сондықтан физикалық әдістердің бөлінуінің принципиалды мәні болмайды.
Талдаудың физика-химиялық әдістерінің жалпы саны едәуір көп. Олардың ішінде:
Спектралды және басқа оптикалық әдістері;
Электрохимиялық әдістері;
Талдаудың хроматографиялық әдістері
-тәжірибелік мәні көбірек болып келедi.

Физикалык-химиялық талдау әдістері
Электрлік өткізгіштік, потенциал және басқа қасиеттерді өлшеуге негізделген талдаудың электрохимиялық әдістерінің тобына
Кондуктометрия,
Потенциометрия
Вольтамперометрия
-әдістepi және т. б., ал хроматографиялық әдістердің тобына
Газдың және сұйықтық хроматография,
Сұйык таралу, жұка қабатты,
Ион-алмасу
және басқа хроматография турлері жатады.

Анализдің потенциометрлік әдісі
Анализдің потенциометрлік әдістері өткен ғасырдың соңынан, Нернст өзінің белгілі тендеуін (1889 ж. ), ал Беренд бірінші потенциометрлік титрлеу туралы айтканнан (1883 ж. ) бepi белгілі. Соңғы жылдарда потенциометрияның қарқынды дамуы ерітіндідегі көптеген иондардың концентрациясын анықтауға мүмкіндік беретін түрлі ионселективті электродтардың пайда болуымен, құрастыру және потенциометрлік өлшемдер үшін құрылғылардың көптеген шығарылымымен байланысты.

Анализдің потенциометрлік әдісі
Анализдің потенциометрлік әдістері тура потенциометрия (ионометрия) және потенциометриялық титрлеуге бөледі. Тура потенциометрия әдістері сәйкес электрод потенциалы немесе тізбектің өлшенген ЭҚК бойынша электродтық реакцияға қатысушылардың концентрациясы немесе активтілігін табу ушін Нернст тендеуін тура қолдануға негізделген. Потенциометрлік титрлеу кезінде эквивалент нүктесі осы аймаққа жақын потенциалдың күрт өзгеруімен анықтайды.

Потенциометрия
Электрохимиялық тізбектің электрқозғаушы күшінің Е зерттелетін ионның белсенділігінен тәуелділігін Нернст теңдеуімен сипаттайды:
мұндағы: E0-редокс-жүйенің стандартты потенциалы;
R -универсалды газ тұрақтысы, 8, 312 Дж/(моль К) тең;
T - абсолютті температура, К;
F - Фарадей тұрақтысы, 96485 Кл/моль тең;
n - электродты реакцияға қатысатын электрондар саны;
aox, ared - редокс-жүйенің сәйкесінше тотыққан және тотықсызданған формаларының белсенділігі;
[ox], [red] -олардың молярлық концентрациялары;
γox, γred-активтілік коэффициенттері.

Потенциометрияның теориялық негіздері
Потенциометрлік əдіс қайтымды жəне қайтымсыз гальваникалық элементтердегі электродта пайда болатын электр потенциялдарының айырымын өлшеуге негізделген. Мұны ерітіндідегі заттың мөлшерімен физикалық-химиялық сипаттамасын анықтау үшін қолданады. Қолданылатын гальваникалық элементе индикаторлық жəне салыстырмалылық электродтар қолданылады.
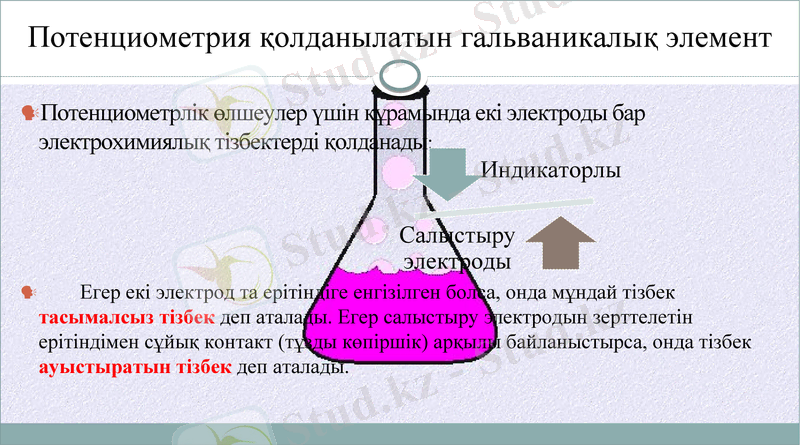
Потенциометрия қолданылатын гальваникалық элемент
Потенциометрлік өлшеулер үшін құрамында екі электроды бар электрохимиялық тізбектерді қолданады:
Егер екі электрод та ерітіндіге енгізілген болса, онда мұндай тізбек тасымалсыз тізбек деп аталады. Егер салыстыру электродын зерттелетін ерітіндімен сұйық контакт (тұзды көпіршік) арқылы байланыстырса, онда тізбек ауыстыратын тізбек деп аталады.

Анализдің потенциометрлік әдістерін екі түрге бөледі:
Тура потенциометрия әдісі ион концентрациясының анықталуы құрамында сәйкес ионселективті электрод бар электрохимиялық тізбектің өлшенген ЭҚК бойынша анықталуына негізделген.

Потенциалдың пайда болу табиғаты әртүрлі Потенциалдардың:
Электродтық потенциалдар;
Редокс-потенциалдар;
Мембраналық потенциалдар сияқты негізгі класын көрсетуге болады.

Қорытынды
Потенциометрия - теңгерілген электродты потенциал мен электрохимиялық реакцияға қатысушы қоспалардың термодинамикалық активтілігі арасындағы тәуелділікті анықтауға негізделген электрохимиялық зерттеудің тәсілі.
Потенциометрлік әдіс қайтымды немесе қайтымсыз гальваникалық элеменггердегі электродта пайда болатын электр потенциалдарының айырымын өлшеуге негізделген. Мұны ерітіндідегі заттың мөлшері мен физикалық-химиялық сипаттамасын анықтау үшін қолданады.

Пайдаланылған әдебиеттер:
1. Пономарев В. Д. Аналитикалық химия
2. Құлажанов Қ. С. Аналитикалық химия. -Алматы. Білім 1994
3. Өтелбаев Б. Т. Химия, б. 2, 3, 4. -Шымкент, 2000.
4. Мендалиева Д. К., Чекотаева К. А. ., Наурызбаев М. Қ. Аналитикалық химияның теориялық негіздері-Алматы, 2006
5. Ә. Қ. Патсаев, С. Ж. Жайлау, Ш. С. Шыназбекова, Б. Қ. МАхатов
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz