Химиялық-технологиялық үдерістердің негізгі заңдылықтары: термодинамика және кинетика



Химиялық-технологиялық үдерістердің негізгі заңдылықтары. ХТҮ-дің термодинамикасы және кинетикасы.
Оқытушы: Милисова Н. Б.
С. Ж. Асфендияров атындағы Қазақ Ұлттық Медицина Университеті
Казахский Национальный Университет имени С. Д. Асфендиярова
Алматы, 2020
Инженерлік пәндер кафедрасы

Жоспар:
Химиялық-технологиялық үдерістегі химиялық реакциялардың жіктелуі.
Реакция тәртібі және молекулярлығы.
Химиялық айналулар стехиометриясы.
Химиялық реакциялардың тепе-теңдігі.
Тепе-теңдікті ығыстыру тәсілдері.
ХТҮ кинетикасы.

Өнеркəсіптік үдерістерде жүретін химиялық реакциялар əртүрлі. Оларды əртүрлі белгілері бойынша жіктейді.
Реакцияны жүргізу жағдайы бойынша:
Химиялық реакцияның жіктелуі
Изотермиялық (Т=const) жəне изотермиялық емес (Т≠const ) ;
Тұрақты немесе ауыспалы қысымда;
Адиабаттық (қоршаған ортамен жылу алмаспау) жəне адиабаттық емес (қоршаған ортамен жылу алмасу) реакциялар
Бастапқы реагенттер мен реакция өнімдері бір немесе бірнеше фазалардан түзілуіне байланысты:
Гомофазалы реакциялар - бастапқы реагенттер, тұрақты аралық заттар жəне реакция өнімдері бір фазада болады.
Гетерофазалы реакцялар - бастапқы реагенттер, тұрақты аралық заттар жəне реакция өнімдері əртүрлі фазада болады.

Реагенттердің фазалық күйі бойынша гомогенді жəне гетерогенді реакциялар болып бөлінеді.
Реакцияның гомогендігі жəне гетерогендігі белгілі бір дəрежеде, реакцияның қандай да бір фаза көлемінде немесе фазалардың бөліну бетінде жүру механизмін көрсетеді.
Реакцияның механизмі бойынша:
- қарапайым,
- параллельді
- кезектесіп жүретін реакциялар.
Химиялық реакциялар жылу эффектісі бойынша жіктеледі. Экзотермиялық реакция жүргенде жылу бөлінеді де (Q>0) реакциялық жүйенің энтальпиясы кемиді (∆Н<0) . Эндотермиялық реакция жүргенде жылусіңіріледіде(Q<0), (∆Н>0) .

Реакцияның элементарлы актісіне қатысатын молекуланың санына байланысты химиялық реакцияның молекулалығы бойынша:
- моно-, би- жəне үшмолекулярлы реакциялар болып бөлінеді.
Кинетикалық теңдеудің түрі (химиялық реакция жылдамдығының реагенттер концентрациясына тəуелділігі) реакцияның реті бойынша жіктеуге мүмкіндік береді. Реакцияның реті - кинетикалық теңдеудегі реагенттердің концентрацияларының дəреже көрсеткіштерінің қосындысы.
- бірінші, екінші, үшінші, бөлшекті ретті реакциялар
Химиялық реакцияның жылдамдығын өзгертетін арнаулы заттар - катализаторлардың қолданылуы немесе қолданылмауына байланысты:
- катализдік,
- катализдік емес реакциялар

Реакция молекулярлығы
Реакцияға түсетін молекулалар саны реакцияның молекулярлығын көрсетеді.
Егер реакцияға бір молекула түсетін болса, ол бірмолекулярлы реакция деп аталады.
t0 h
А В Вг2 2Вг
a) мономолекулярлы: А В + С - реакции изомеризация реакциясы, термиялық ыдырау:
бутан изобутан
бимолекулярлы: А + В С ең кең таралған реакция типі
Н2 + Вг2 = 2НВг
тримолекулярлы: А + 2В С, 3А В өте сирек кездеседі
NO + NO+ O2 = 2NO2
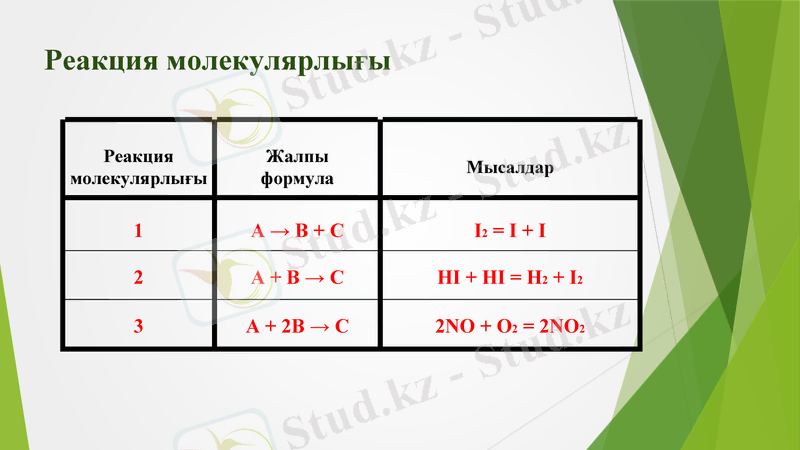
Реакция молекулярлығы
Жалпы
формула
Мысалдар
1
А → В + С
I2 = I + I
2
А + В → С
HI + HI = H2 + I2
3
А + 2В → С
2NO + O2 = 2NO2
Реакция молекулярлығы

Реакцияның тәртібі реакцияның кинетикалық теңдеуімен анықталады және осы теңдеудегі концентрациялардағы көрсеткіштердің қосындысына тең.
Реакциялар 1-ші, 2-ші, 3-ші, сонымен қатар бөлшек немесе нөлдік тәртіпте болуы мүмкін.
Реакция
Кинетикалық теңдеу түрі
Реакция
тәртібі
А → В + Д
υ = - dC/dt = КСА
1
А +В → Д
υ = - dC/dt = К·СА·СВ
2
А +В + С → Д
υ = - dC/dt = К·СА·СВ·СС
3
Реакция тәртібі

Химиялық айналулар стехиометриясы.
Өнеркəсіптік химиялық-технологиялық үдерістердің негізіне жататын химиялық реакцияларды өрнектеу үшін химияның негізгі заңдары - стехиометрия заңдары, химиялық тепе-теңдік жəне химиялық кинетика қолданылады.
Стехиометрия - əрекеттесуші заттардың массалары немесе көлемдерінің арақатынасы туралы ғылым. Стехиометрия негізіне - массалар сақталу, эквиваленттік, Авагадро, Гей-Люссак, құрамтұрақтылық, еселі қатынас заңдары жатады. Реакцияға қатысатын заттардың арақатынасы стехиометриялық деп аталады
Химияда стехиометрия заңдары заттар дың формуласына байланысты есептеулерде жəне алынатын реакция өнімдерінің теориялық мүмкін болатын массаларын анықтауда қолда нылады. Реакцияның стехиометриялық теңдеуі массалар сақталу заңы негізінде жазылады.

Реакцияның сол жағында реагенттер, оң жағында өнімдер:
алгебралық ережеге сəйкес:
болып жазылады немесе жалпы түрде:
Мұндай жазуда стехиометриялық коэффициенттің jj белгісі - берілген заттың реагент (онда стехиометриялық коэффициент теріс, jj <0) неме-се реакция өнімі (онда, jj >0) болатынын анықтауға мүмкіндік береді. Егер n тəуелсіз кезектескен немесе параллельді сатылардан тұратын күрделі реакция болса, онда реакцияның стехиометриясы келесі n типті теңдеулерден тұратын жүйемен өрнектеледі:

Энергия жылу немесе жұмыс түрінде енгізілгенде не болмаса шығарылғанда термодинамикалық жүйе күйінің өзгеруін термодинамикалық үдеріс деп атайды.
Көптеген өнеркəсіптік химиялық реакциялар қайтымды. Бұл кезде химиялық өзгеру үдерісі екі бағытта жүреді. Бастапқы заттар арасында химиялық əрекеттесулермен қатар (тура реакция) өнімдер арасында əрекеттесулер (кері реакция) жүреді. Үдерістің жүру барысында тура реакцияның жылдамдығы кемиді, кері реакцияның жылдамдығы артады. Бұл реакцияның жылдамдықтары теңескенде химиялық тепе-теңдік орнайды.
Химиялық тепе-теңдік сыртқы жағдайлар өзгермеген кезде химиялық жүйені құрайтын заттардың молекулалар санының өзгермейтіндігін сипаттайды. Өйткені тұрақты температура мен қысымда тепе-теңдік өлшемі Гиббс энергиясының (dG=0) минимумы болса, онда химиялық тепе-теңдік кезінде:
теңдігі сақталуы керек.
Мұндағы: компонентінің химиялық потенциалы; компонентінің мөлшері (моль) . Ал химиялық потенциалдың мəні мынаған тең:
Химиялық реакцияның тепе-теңдігі

Технологиялық процестердегі тепе-теңдік және оған әсер ететін факторлар.
Химиялық реакциялар қайтымды және қайтымсыз болып бөлінеді.
Шындығында барлық реакциялар қайтымды. Берілген жағдайда байланысты (Т, Р, С) реакция тура және кері жүре алады. Дегенмен көптеген химиялық реакциялар бір бағытта өте аз жылдамдықпен (іс жүзінде ноль жылдамдықпен) жүре алады, сондықтан мұндай реакцияларды шартты түрде қайтымсыз реакция деп санайды.
Мысалы, Әк «сүтінің» СО2-ні сіңіру реакциясы
CO2 + Ca(OH) 2 → CaCO3 + H2O
Іс жүзінде қайтымсыз, өйткені түзілген CaCO3 суда аз ериді, сөйтіп тұнбаға түседі. Технологиялық процестерді іске асырғанда ең алдымен мынаны білу керек:
Таңдап алған шикізатты өңдегенде қандай реакция жүреді (қайтымды-қайтымсыз) .
Берілген өнімді қамтамасыз ететін негізгі реакция қаншалықты терең жүреді.
Мақсатты өнімінің максималды шығымы қандай.
Негізгі реакцияның қаншалықты терең жүретінін реакцияның тепе-теңдік орнау жағдайларынан білеміз. Сондықтан тепе-теңдікте жүретін реакцияға оптималдық жағдайларды орнатуды білу керек.

Жылжымалы тепе-теңдік

Тепе-теңдікке концентрацияның әсері

Тепе-теңдікке температураның әсері
Ле-Шателье принципі бойынша химиялық тепе-теңдік күйіне келіп тұрған системаның жағдайының (С, Т, Р) біреуін өзгерту тепе-теңдікті сол өзгертуге қарсы әрекет туғызатын реакция бағытына қарай ығыстырылады. Мысалы, егер қайтымды экзотермиялық күкіртті ангидридті тотығу реакциясы жүрсе
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz