Атом құрылысының квантмеханикалық теориясы және кванттық сандар



АТОМ ҚҰРЫЛЫСЫНЫҢ КВАНТМЕХАНИКАЛЫҚ ТЕОРИЯСЫ
АМАНҒАЛИЕВА АЙЖАН
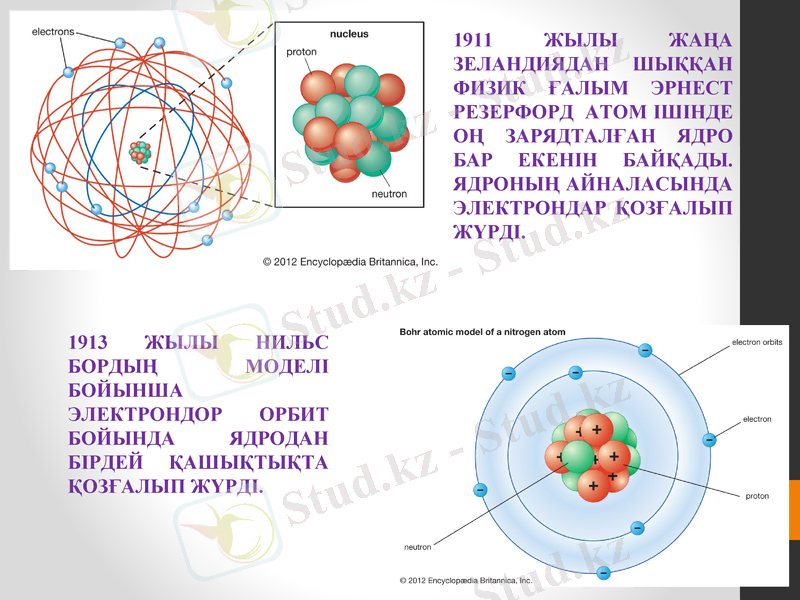
1911 ЖЫЛЫ ЖАҢА ЗЕЛАНДИЯДАН ШЫҚҚАН ФИЗИК ҒАЛЫМ ЭРНЕСТ РЕЗЕРФОРД АТОМ ІШІНДЕ ОҢ ЗАРЯДТАЛҒАН ЯДРО БАР ЕКЕНІН БАЙҚАДЫ. ЯДРОНЫҢ АЙНАЛАСЫНДА ЭЛЕКТРОНДАР ҚОЗҒАЛЫП ЖҮРДІ.
1913 ЖЫЛЫ НИЛЬС БОРДЫҢ МОДЕЛІ БОЙЫНША ЭЛЕКТРОНДОР ОРБИТ БОЙЫНДА ЯДРОДАН БІРДЕЙ ҚАШЫҚТЫҚТА ҚОЗҒАЛЫП ЖҮРДІ.

РЕЗЕРФОРД ТӘЖІРИБЕСІ
1911 жылы Резерфорд өзінің шәкірттері Г. Гейгер және Э . Марсденмен бірге альфа-бөлшектер шоғын өте жұқа алтын фольгадан өткізіп, бірнеше тәжірибелер жасады. Осы тәжірибелерді зерделеу нәтижесінде атомның ядролық, басқаша айтсақ, планетарлық моделі өмірге келді.
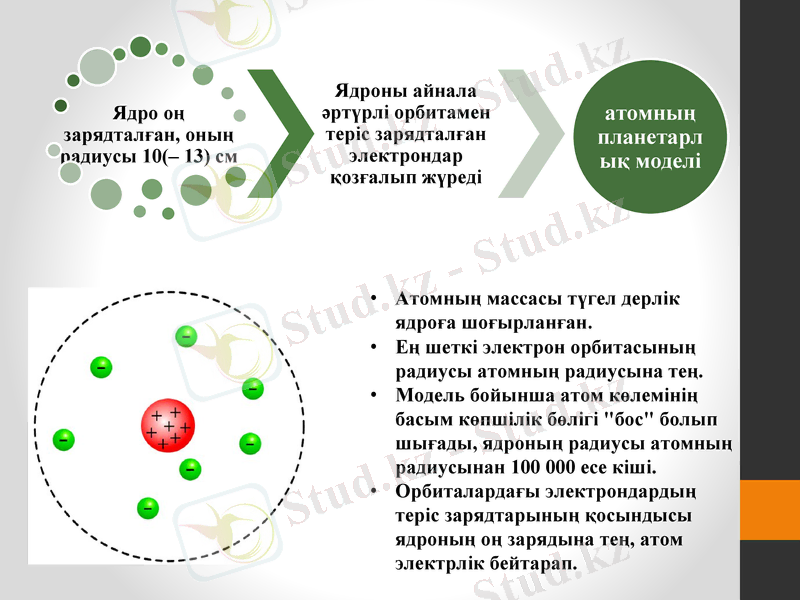
Атомның массасы түгел дерлік ядроға шоғырланған.
Ең шеткі электрон орбитасының радиусы атомның радиусына тең.
Модель бойынша атом көлемінің басым көпшілік бөлігі "бос" болып шығады, ядроның радиусы атомның радиусынан 100 000 есе кіші.
Орбиталардағы электрондардың теріс зарядтарының қосындысы ядроның оң зарядына тең, атом электрлік бейтарап.

БОР ҚАҒИДАЛАРЫ
1. Атомдар, тек стационарлық күйлер деп аталатын қандай да бiр күйлерде ғана бола алады. Электрондар мұндай орнықты орбита бойымен қозғалып жүргенде сәуле шығармайды.
2. Сәуле шығару немесе жұту тек бiр стационарлық күйден екiншi стационарлық күйге өткен кезде ғана болады. Ал шығарылған немесе жұтылған сәуленiң жиiлiгi мына шарттан анықталады
3. (Орбиталардың кванттану ережесі) :Стационарлық күйдегі атомдардың шеңбер бойымен қозғалғанда импульс моменттері тек дискретті мән қабылдай алады
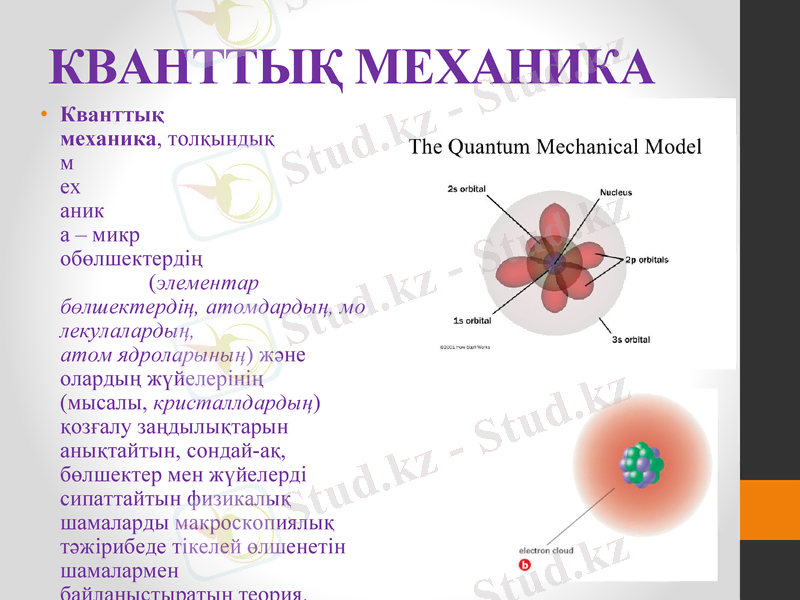
КВАНТТЫҚ МЕХАНИКА
Кванттық механика, толқындық механика - микробөлшектердің (элементар бөлшектердің, атомдардың, молекулалардың, атом ядроларының) және олардың жүйелерінің (мысалы, кристаллдардың) қозғалу заңдылықтарын анықтайтын, сондай-ақ, бөлшектер мен жүйелерді сипаттайтын физикалық шамаларды макроскопиялық тәжірибеде тікелей өлшенетін шамалармен байланыстыратын теория.
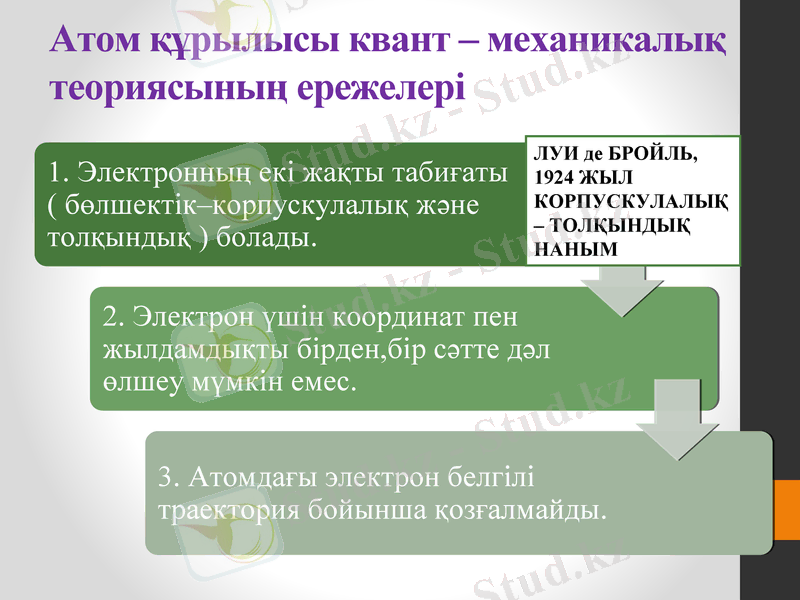
Атом құрылысы квант - механикалық теориясының ережелері
ЛУИ де БРОЙЛЬ, 1924 ЖЫЛ
КОРПУСКУЛАЛЫҚ - ТОЛҚЫНДЫҚ НАНЫМ


КВАНТ САНДАРЫ
Кванттық сандар- кванттық жүйелерді (атом ядросын, атомды, молекуланы, т. б. ), жеке элементар бөлшектерді, жорамал бөлшектерді (кварктер мен глюондарды) сипаттайтын физикалық шамалардың мүмкін мәндерін анықтайтын бүтін немесе бөлшек сандар.
Атомдағы электронның күйі үш кеңістіктік координата және спинмен байланысқан электронның төрт еркіндік дәрежесіне сәйкес келетін төрт кванттық санмен анықталады.

БАС КВАНТ САНЫ
Квант сандарының белгілі мәндеріне сәйкес келетін электрон күйі атомдық электрондык орбиталь (АО) деп аталады.
n - (бас квант саны) атомдағы электронның энергиясын және энергетикалық деңгейін, яғни АО өлшемін анықтайды.
Бас квант саны 1-7 мәндерін (периодтық жүйедегі период номеріне сәйкес) қабылдайды. Деңгей саны артқан сайын электронның энергиясы да жоғарлайды.
Бас квант сан периодты жүйедегі период номеріне тең.
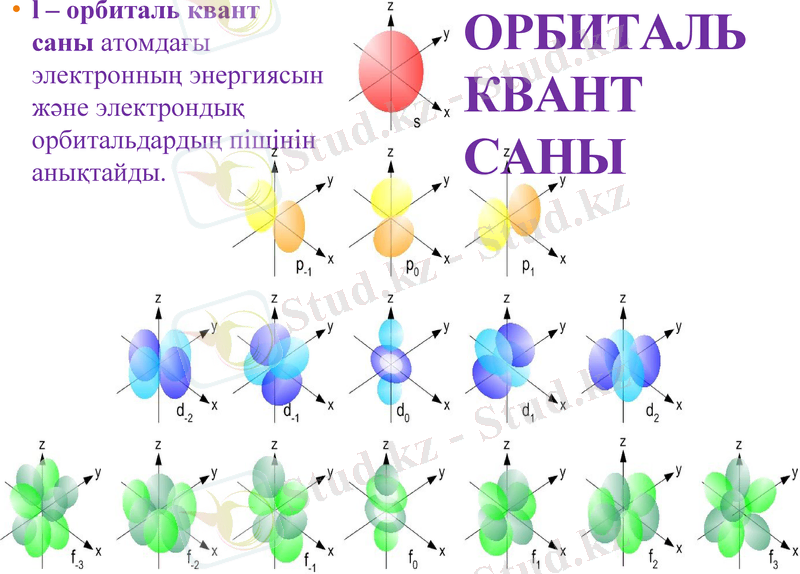
ОРБИТАЛЬ КВАНТ САНЫ
l - орбиталь квант саны атомдағы электронның энергиясын және электрондық орбитальдардың пішінін анықтайды.

МАГНИТ КВАНТ САНЫ
Магнит квант саны ml - электронның магнит моментімен байланысты, электронның магнит өрісіндегі бағытын, электронның қабылдаған бағытына қатысты электрондық бұлттың ориентациясын (бағытын) көрсетеді.
L-ДІҢ МӘНДЕРІ
СӘЙКЕС ДЕҢГЕЙШЕЛЕР
МАГНИТ КВАНТ САНЫНЫҢ МӘНДЕРІ
ОРБИТАЛЬДАРДЫҢ САНДАРЫ
0
1
2
3
S
P
d
f
0
-1, 0, +1
-2, -1, 0, +1, +2
-3, -2, -1, 0, +1, +2, +3
1
3
5
7

СПИН КВАНТ САНЫ
Спин квант саны ms - электронның ішкі қозғалысын сипаттайды.
Спин квант саны ms электронның өз осінен айналуын сипаттайды. Электрон өз осі бойымен біріне-бірі қарама-қарсы бағытта айнала алатындықтан онын тек екі мәні болады: + 1/2 және − 1/2.
Егер екі электронның басқа квант сандары бірдей болса, олардың спиндері әр түрлі болады. Ондай электрондарды жұптасқан деп атайды да, қарама-қарсы айналатынын былай ↑↓ белгілейді.
Егер ұяда бір электрон болса, оны дара деп атап былай белгілейді ↑.

ЕРЕЖЕЛЕРІ
Элементтер атомдарындағы электрондардың атомдық орбитальдарда орналасуы үш жағдаймен анықталады: Паули принципі, Клечковский және Хунда ережелері.

Кванттық механика бойынша электронның толқындық және бөлшектікіндей қасиеті болады. Яғни толқын сияқты оның толқындық жиілігі болады, ал бөлшек сияқты оның пішіні, массасы болады. Атом құрылысын зерттей зерделеу зат қасиеттерін жүйелеуге, химиялық реакцияларды және олардың механизмін жіктей реттеуге, биохимиялық және фармацевтикалық сан алуанды түрде болуын пайымдай түсуге мүмкіндік береді.
ҚОРЫТЫНДЫ

НАЗАР АУДАРҒАНДАРЫҢЫЗҒА РАХМЕТ!!!
- Іс жүргізу
- Автоматтандыру, Техника
- Алғашқы әскери дайындық
- Астрономия
- Ауыл шаруашылығы
- Банк ісі
- Бизнесті бағалау
- Биология
- Бухгалтерлік іс
- Валеология
- Ветеринария
- География
- Геология, Геофизика, Геодезия
- Дін
- Ет, сүт, шарап өнімдері
- Жалпы тарих
- Жер кадастрі, Жылжымайтын мүлік
- Журналистика
- Информатика
- Кеден ісі
- Маркетинг
- Математика, Геометрия
- Медицина
- Мемлекеттік басқару
- Менеджмент
- Мұнай, Газ
- Мұрағат ісі
- Мәдениеттану
- ОБЖ (Основы безопасности жизнедеятельности)
- Педагогика
- Полиграфия
- Психология
- Салық
- Саясаттану
- Сақтандыру
- Сертификаттау, стандарттау
- Социология, Демография
- Спорт
- Статистика
- Тілтану, Филология
- Тарихи тұлғалар
- Тау-кен ісі
- Транспорт
- Туризм
- Физика
- Философия
- Халықаралық қатынастар
- Химия
- Экология, Қоршаған ортаны қорғау
- Экономика
- Экономикалық география
- Электротехника
- Қазақстан тарихы
- Қаржы
- Құрылыс
- Құқық, Криминалистика
- Әдебиет
- Өнер, музыка
- Өнеркәсіп, Өндіріс
Қазақ тілінде жазылған рефераттар, курстық жұмыстар, дипломдық жұмыстар бойынша біздің қор #1 болып табылады.



Ақпарат
Қосымша
Email: info@stud.kz